医薬品情報
| 総称名 | ノーベルバール |
|---|---|
| 一般名 | フェノバルビタールナトリウム |
| 欧文一般名 | Phenobarbital Sodium |
| 製剤名 | フェノバルビタールナトリウム凍結乾燥製剤 |
| 薬効分類名 | 抗けいれん剤 |
| 薬効分類番号 | 1139 |
| ATCコード | N03AA02 |
| KEGG DRUG |
D00701
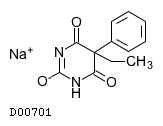
フェノバルビタールナトリウム
|
| KEGG DGROUP |
DG00845
フェノバルビタール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第5版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ノーベルバール静注用250mg | NOBELBAR 250mg for Injection | ノーベルファーマ | 1139400F1023 | 1835円/瓶 | 劇薬, 向精神薬(第三種), 習慣性医薬品注1), 処方箋医薬品注2) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分又はバルビツール酸系化合物に対し過敏症の既往歴のある患者
2.2 急性間欠性ポルフィリン症の患者[ポルフィリン合成が増加し、症状が悪化するおそれがある。]
2.3 ボリコナゾール、タダラフィル(肺高血圧症を適応とする場合)、マシテンタン、チカグレロル、アルテメテル・ルメファントリン、ダルナビル・コビシスタット、ドラビリン、リルピビリン、イサブコナゾニウム硫酸塩、ミフェプリストン・ミソプロストール、ニルマトレルビル・リトナビル、リルピビリン・テノホビル アラフェナミド・エムトリシタビン、ビクテグラビル・エムトリシタビン・テノホビル アラフェナミド、ダルナビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド、エルビテグラビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド、ソホスブビル・ベルパタスビル、ドルテグラビル・リルピビリン、カボテグラビルを投与中の患者[10.1参照]
4. 効能または効果
○新生児けいれん
○てんかん重積状態
5. 効能または効果に関連する注意
本剤は、作用発現が遅く、長時間作用型に属することから、てんかん重積状態の患者では、速効性の薬剤を第一選択とし、本剤は第二選択以降に使用することが望ましい。[18.1参照]
6. 用法及び用量
<新生児けいれん>
初回投与
フェノバルビタールとして、20mg/kgを静脈内投与する。けいれんがコントロールできない場合は、患者の状態に応じ、初回投与量を超えない範囲で用量を調節し、静脈内に追加投与する。
維持投与
フェノバルビタールとして、2.5〜5mg/kgを1日1回静脈内投与する。
<てんかん重積状態>
フェノバルビタールとして、15〜20mg/kgを1日1回静脈内投与する。
7. 用法及び用量に関連する注意
<効能共通>
<新生児けいれん>
7.2 新生児では、5〜10分かけて緩徐に投与すること。ただし、患者の状態に応じ、より緩徐に投与することも考慮すること。また、追加投与を行う際には、患者の状態を観察し、初回投与から十分な間隔をあけた上で、実施すること。[17.1.1参照]
<てんかん重積状態>
7.3 小児及び成人では、10分以上かけて緩徐に投与すること。ただし、100mg/分の投与速度を超えないこと。
8. 重要な基本的注意
8.3 本剤投与中の患者には自動車の運転など危険を伴う機械の操作に従事させないよう注意すること。眠気、注意力・集中力・反射運動能力等の低下が起こることがある。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 虚弱者
9.1.2 呼吸機能の低下している患者
呼吸抑制を起こすことがある。[11.1.6参照]
9.1.3 頭部外傷後遺症又は進行した動脈硬化症の患者
本剤の作用が強くあらわれることがある。
9.1.4 心障害のある患者
血圧低下や心拍数減少を起こすおそれがある。
9.1.5 アルコール中毒のある患者
中枢抑制作用が増強される。
9.1.6 薬物依存の傾向又は既往歴のある患者
精神依存及び身体依存を示すことがある。[11.1.3参照]
9.1.7 重篤な神経症の患者
依存を示すおそれがある。[11.1.3参照]
9.1.8 甲状腺機能低下症の患者
甲状腺機能の異常をきたすおそれがある。
9.2 腎機能障害患者
症状の悪化、また血中濃度上昇のおそれがある。腎機能障害患者を対象とした有効性及び安全性を指標とした臨床試験は実施していない。[8.2参照]
9.3 肝機能障害患者
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性(母体のてんかん発作頻発を防ぎ、胎児を低酸素状態から守る)が危険性を上回ると判断される場合にのみ投与すること。妊娠中に本剤を単独、又は併用投与された患者の中に、口唇裂、口蓋裂、心奇形1)2)3)4)5)、大動脈縮窄症等を有する児を出産した例が多いとの疫学的調査報告がある。
9.5.2 妊娠中の投与により、新生児に出血傾向、呼吸抑制等を起こすことがある。
9.5.3 分娩前に連用した場合、出産後新生児に離脱症状(多動、振戦、反射亢進、過緊張等)があらわれることがある。
9.5.4 妊娠中の投与により、葉酸低下が生じるとの報告がある6)。
9.6 授乳婦
9.7 小児等
9.8 高齢者
10. 相互作用
相互作用序文
薬物代謝酵素CYP3A等の誘導作用を有する10)。
薬物代謝酵素用語
CYP3A
10.1 併用禁忌
| ボリコナゾール (ブイフェンド) タダラフィル (肺高血圧症を適応とする場合:アドシルカ) マシテンタン (オプスミット) チカグレロル (ブリリンタ) アルテメテル・ルメファントリン (リアメット配合錠) ダルナビル・コビシスタット (プレジコビックス配合錠) ドラビリン (ピフェルトロ) リルピビリン (エジュラント) イサブコナゾニウム硫酸塩 (クレセンバ) [2.3参照] | これらの薬剤の代謝が促進され、血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用による。 |
| ミフェプリストン・ミソプロストール (メフィーゴ) [2.3参照] | ミフェプリストンの代謝が促進され、血中濃度が低下し効果が減弱するおそれがあるので、本剤の影響がなくなるまで投与しないこと。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用による。 |
| ニルマトレルビル・リトナビル (パキロビッド) [2.3参照] | ニルマトレルビル及びリトナビルの血中濃度が低下するため、効果が減弱し、耐性が発現する可能性がある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用による。 |
| リルピビリン・テノホビル アラフェナミド・エムトリシタビン (オデフシィ配合錠) [2.3参照] | リルピビリン及びテノホビル アラフェナミドの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びP糖蛋白誘導作用による。 |
| ビクテグラビル・エムトリシタビン・テノホビル アラフェナミド (ビクタルビ配合錠) [2.3参照] | ビクテグラビル及びテノホビル アラフェナミドの血中濃度が低下するため、この薬剤の効果が減弱し、この薬剤に対する耐性が発現する可能性がある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びP糖蛋白誘導作用による。 |
| ダルナビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド (シムツーザ配合錠) [2.3参照] | ダルナビル、コビシスタット及びテノホビル アラフェナミドの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びP糖蛋白誘導作用による。 |
| エルビテグラビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド (ゲンボイヤ配合錠) [2.3参照] | エルビテグラビル、コビシスタット及びテノホビル アラフェナミドの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びP糖蛋白誘導作用による。 |
| ソホスブビル・ベルパタスビル (エプクルーサ配合錠) [2.3参照] | ソホスブビル及びベルパタスビルの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びP糖蛋白誘導作用による。 |
| ドルテグラビル・リルピビリン (ジャルカ配合錠) [2.3参照] | ドルテグラビル及びリルピビリンの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びUGT1A1誘導作用による。 |
| カボテグラビル (ボカブリア) [2.3参照] | カボテグラビルの血漿中濃度が低下し、効果が減弱するおそれがある。 | 本剤のUGT1A1誘導作用による。 |
10.2 併用注意
| 中枢神経抑制剤 フェノチアジン誘導体 バルビツール酸誘導体 トランキライザー トピラマート等 抗ヒスタミン剤 ジフェンヒドラミン等 アルコール | 相互に作用が増強されることがあるので、減量するなど注意すること。 | 相加的中枢神経抑制作用による。 |
| MAO阻害剤 | 相互に作用が増強されることがあるので、減量するなど注意すること。 | 作用機序は不明である。 |
| 三環系抗うつ剤 イミプラミン等 四環系抗うつ剤 マプロチリン等 | (1)相互に作用が増強されることがあるので、減量するなど注意すること。 (2)これらの抗うつ剤の血中濃度が低下することがある注)。 | (1)相加的中枢神経抑制作用による。 (2)本剤の肝薬物代謝酵素誘導作用による。 |
| メチルフェニデート | 本剤の血中濃度が上昇することがあるので、本剤を減量するなど注意すること。 | メチルフェニデートが肝代謝を抑制すると考えられている。 |
| バルプロ酸 | (1)本剤の血中濃度が上昇し、作用が増強されることがある。 (2)バルプロ酸の血中濃度が低下することがある注)。 (3)バルプロ酸による高アンモニア血症の発現リスクが高まるおそれがある。 | (1)バルプロ酸が肝代謝を抑制する。 (2)本剤の肝薬物代謝酵素誘導作用による。 (3)作用機序は不明である。 |
| スチリペントール | (1)本剤の血中濃度が上昇し、作用が増強されることがある。 (2)スチリペントールの血中濃度が低下することがある注)。 | (1)スチリペントールが肝代謝を抑制する。 (2)本剤の肝薬物代謝酵素誘導作用による。 |
| クロバザム | (1)本剤の血中濃度が上昇することがある。 (2)クロバザムの血中濃度が低下することがある注)。 | (1)作用機序は不明である。 (2)本剤の肝薬物代謝酵素誘導作用による。 |
| イリノテカン11) | イリノテカンの活性代謝物の血中濃度が低下し、作用が減弱することがあるので、併用を避けることが望ましい。 | 本剤の肝薬物代謝酵素誘導作用による。 |
| 主にCYP3Aの基質となる薬剤 アゼルニジピン12) イグラチモド イマチニブ カルバマゼピン シクロスポリン ゾニサミド タクロリムス フェロジピン べラパミル モンテルカスト13) エンシトレルビル フマル酸等 副腎皮質ホルモン剤 デキサメタゾン等 卵胞ホルモン剤・黄体ホルモン剤 ノルゲストレル・エチニルエストラジオール等 PDE5阻害剤 タダラフィル(勃起不全、前立腺肥大症に伴う排尿障害を適応とする場合:シアリス、ザルティア)、シルデナフィル、バルデナフィル | これらの薬剤の血中濃度が低下し、作用が減弱することがあるので、用量に注意すること注)。 | 本剤の肝薬物代謝酵素誘導作用による。 |
| アミノフィリン水和物 クロラムフェニコール テオフィリン パロキセチン14) フレカイニド メトロニダゾール | これらの薬剤の血中濃度が低下し、作用が減弱することがあるので、用量に注意すること注)。 | 本剤の肝薬物代謝酵素誘導作用による。 |
| ラモトリギン デフェラシロクス カナグリフロジン ラルテグラビル | これらの薬剤の血中濃度が低下することがある注)。 | 本剤がこれらの薬剤のグルクロン酸抱合を促進する。 |
| ルフィナミド | これらの薬剤の血中濃度が低下することがある注)。 | 作用機序は不明である。 |
| アピキサバン | これらの薬剤の血中濃度が低下することがある注)。 | 本剤の肝薬物代謝酵素誘導作用及びP糖蛋白誘導作用による。 |
| ソホスブビル レジパスビル・ソホスブビル グレカプレビル・ピブレンタスビル テノホビル アラフェナミド | これらの薬剤の血中濃度が低下することがある注)。 | 本剤のP糖蛋白誘導作用による。 |
| ドルテグラビル ドルテグラビル・ラミブジン ドルテグラビル・アバカビル・ラミブジン | ドルテグラビルの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A4)誘導作用及びUGT1A1誘導作用による。 |
| レナカパビルナトリウム | レナカパビルの血漿中濃度が低下する可能性があり、レナカパビルの効果が減弱し、レナカパビルに対する耐性が発現する可能性がある。本剤との併用は推奨されない。 | 本剤の中程度のCYP3A、P-gp及びUGT1A1誘導作用による。 |
| ドキシサイクリン | ドキシサイクリンの血中濃度半減期が短縮することがある。 | 本剤の肝薬物代謝酵素誘導作用による。 |
| クマリン系抗凝血剤 ワルファリン | クマリン系抗凝血剤の作用が減弱することがあるので、通常より頻回に血液凝固時間の測定を行い、クマリン系抗凝血剤の量を調整すること。 | 本剤の肝薬物代謝酵素誘導作用による。 |
| アルベンダゾール | アルベンダゾールの活性代謝物の血中濃度が低下し、効果が減弱することがある。 | 作用機序は不明である。 |
| 利尿剤 チアジド系降圧利尿剤等 | 起立性低血圧が増強されることがあるので、減量するなど注意すること。 | 作用機序は不明であるが、高用量の本剤は血圧を低下させることがある。 |
| アセタゾラミド | くる病、骨軟化症があらわれやすい。 | 本剤によるビタミンDの不活性化促進、又はアセタゾラミドによる腎尿細管障害、代謝性アシドーシス等が考えられている。 |
| アセトアミノフェン15) | 本剤の長期連用者は、アセトアミノフェンの代謝物による肝障害を生じやすくなる。 | 本剤の肝薬物代謝酵素誘導作用により、アセトアミノフェンから肝毒性を持つN-アセチル-p-ベンゾキノンイミンへの代謝が促進されると考えられている。 |
| セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 | 本剤の代謝が促進され、血中濃度が低下するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | セイヨウオトギリソウの肝薬物代謝酵素誘導によると考えられている。 |
| リオチロニンナトリウム レボチロキシンナトリウム水和物 | これらの薬剤の血中濃度を低下させることがあるので、併用する場合にはこれらの薬剤を増量するなど慎重に投与すること。 | 本剤は甲状腺ホルモンの異化を促進すると考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用注1)があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)16)、皮膚粘膜眼症候群(Stevens-Johnson症候群)16)、紅皮症(剥脱性皮膚炎17)18)19)20))(頻度不明)
発熱、紅斑、水疱・びらん、そう痒感、咽頭痛、眼充血、口内炎等の異常が認められた場合には、投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと21)。
11.1.2 過敏症症候群(0.1%)
初期症状として発疹、発熱がみられ、さらにリンパ節腫脹、肝機能障害等の臓器障害、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること12)。
11.1.3 依存性(頻度不明)
11.1.4 顆粒球減少(0.3%)、血小板減少(0.1%)[8.2参照]
11.1.5 肝機能障害(2.6%)
11.1.6 呼吸抑制22)(0.8%)
注1)発現頻度は使用成績調査(新生児けいれん、てんかん重積状態)の結果を含む。
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | 中毒疹様発疹 | 猩紅熱様発疹、麻疹様発疹 | |
| 血液及びリンパ系 | 巨赤芽球性貧血 | ||
| 内分泌系 | 甲状腺機能検査値(血清T4値等)の異常 | ||
| 精神神経系 | 眠気 | 眩暈、頭痛、精神機能低下 | アステリキシス(asterixis)、せん妄、昏迷、鈍重、構音障害、知覚異常、運動失調、興奮、多動 |
| 心及び血管系 | 血圧低下 | 徐脈 | |
| 消化器 | 食欲不振 | ||
| 肝臓 | 黄疸 | ||
| 骨・歯 | くる病注2)、骨軟化症注2)、歯牙の形成不全注2)、低カルシウム血症 | ||
| 腎臓注3) | 蛋白尿等の腎障害 | ||
| その他 | 酸素飽和度低下、発熱、気管支分泌増加、体温低下、尿量減少 | 血清葉酸値の低下、ヘマトポルフィリン尿注3) |
13. 過量投与
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 通常、1バイアルを5mLの注射用水又は生理食塩液に溶解する(溶解後の濃度:フェノバルビタールとして50mg/mL)。なお、溶解後は、速やか(6時間以内)に使用すること。
14.1.2 以下に示す注射剤との配合変化を起こすことが確認されているので、混合しないこと。
ドパミン塩酸塩、L-アスパラギン酸カリウム、メナテトレノン(ビタミンK)、ベクロニウム臭化物、アミカシン硫酸塩、ゲンタマイシン硫酸塩、注射用エリスロマイシン(エリスロマイシンラクトビオン酸塩)。
ドパミン塩酸塩、L-アスパラギン酸カリウム、メナテトレノン(ビタミンK)、ベクロニウム臭化物、アミカシン硫酸塩、ゲンタマイシン硫酸塩、注射用エリスロマイシン(エリスロマイシンラクトビオン酸塩)。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 血清免疫グロブリン(IgA、IgG等)の異常があらわれることがある24)。
15.1.2 本剤と他の抗てんかん薬(フェニトイン、カルバマゼピン)との間に交差過敏症(過敏症症候群を含む皮膚過敏症)を起こしたとの報告がある。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
本剤を新生児けいれんに対し、初回投与量として20mg/kgを、けいれんがコントロールできない場合は追加投与として同量を、維持投与量として1日1回2.5〜5mg/kgを、静脈内投与した。その結果、初回投与量は17.5〜20.8mg/kg、追加投与量は20.1mg/kg、維持投与量は2.2〜5mg/kgであった。初回投与後2時間における血中濃度(9例)は、22.38±2.34μg/mL(18.8〜25.8μg/mL);平均±標準偏差(最小値〜最大値)であり、追加投与(初回投与30分後)を実施した1例では42.8μg/mLであった。また、維持投与最終投与前(中止時)の血中濃度(10例)は、27.65±9.46μg/mL(18.7〜45.3μg/mL)であった29)30)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<新生児けいれん>
17.1.1 医師主導治験
新生児けいれんを有する患児10症例(年齢;平均日齢2.5日(範囲:日齢1〜5日)、出生体重;平均2,867.7g(範囲:1,144〜3,796g)、在胎週数;平均38.23週(範囲:33.1〜41.1週))を対象に、本剤の初回投与(けいれんが消失しなかった場合は、初回投与30分後に追加投与を実施)30分後での臨床所見に基づくけいれんの有無を主要評価項目として非対照、非盲検の多施設共同試験を行った結果、全例で「著効」と判定された。なお、追加投与が実施された症例は、1例であり、本症例については、初回投与後30分では、「有効」と判定されたものの、断続的にけいれんが持続したため、追加投与が行われ、追加投与後にけいれんが消失し「著効」と判定された。また、本試験では、6日間の維持投与期間を設定して実施したが、維持投与が実施された9例のうち、2例にけいれんの再発が認められた。また、本剤投与終了後の後観察期では、中止例1例を含む4例にけいれんの再発が認められた。副作用は10例中6例(60%)に発現し、呼吸抑制3例3件(30%)、酸素飽和度低下2例2件(20%)、血圧低下1例1件(10%)、徐脈1例1件(10%)、体温低下1例1件(10%)、気管支分泌増加1例1件(10%)、尿量減少1例1件(10%)であった29)30)。[7.2参照]
<てんかん重積状態>
17.1.2 国内では臨床試験を実施していない。
17.2 製造販売後調査等
<新生児けいれん>
17.2.1 使用成績調査
有効性を評価した276例における有効率は94.2%(260/276例)であった。
安全性を評価した329例中、副作用(臨床検査値異常を含む)発現症例は17例22件(5.2%)で、主な副作用は、血圧低下4例4件(1.2%)、呼吸抑制2例2件(0.6%)であった。(再審査終了時)
安全性を評価した329例中、副作用(臨床検査値異常を含む)発現症例は17例22件(5.2%)で、主な副作用は、血圧低下4例4件(1.2%)、呼吸抑制2例2件(0.6%)であった。(再審査終了時)
<てんかん重積状態>
17.2.2 使用成績調査
有効性を評価した804例における有効率は94.9%(763/804例)であった。
安全性を評価した834例中、副作用(臨床検査値異常を含む)発現症例は107例176件(12.8%)で、主な副作用は、肝機能障害30例33件(3.6%)、眠気13例14件(1.6%)、血圧低下12例12件(1.4%)、呼吸抑制6例7件(0.7%)であった。(再審査終了時)
安全性を評価した834例中、副作用(臨床検査値異常を含む)発現症例は107例176件(12.8%)で、主な副作用は、肝機能障害30例33件(3.6%)、眠気13例14件(1.6%)、血圧低下12例12件(1.4%)、呼吸抑制6例7件(0.7%)であった。(再審査終了時)
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. フェノバルビタールナトリウム
22. 包装
250mg[1バイアル]×6
23. 主要文献
- Holmes LB,et al., Arch Neurol., 61 (5), 673-8, (2004) »PubMed
- Arpino C,et al., Epilepsia., 41 (11), 1436-43, (2000) »PubMed
- Thakker JC,et al., Indian Pediatr., 28 (1), 73-5, (1991) »PubMed
- Anderson RC., J Pediatr., 89 (2), 318-9, (1976) »PubMed
- Annegers JF,et al., Birth Defects Orig Artic Ser., 11 (5), 157-60, (1975) »PubMed
- Delgado-Escueta AV,et al., Neurology., 42 (Suppl 5), 149-60, (1992)
- 鈴木喜八郎,他, 周産期医学, 9 (8), 1259-64, (1979)
- 磯部健一,他, 発達薬理誌, 5 (1), 68-70, (1992)
- Bhargava VO,et al., Dev Pharmacol Ther., 11, 8-13, (1988) »PubMed
- 岩橋和彦,他, 臨床精神薬理, 1 (7), 721-7, (1998)
- Crews KR,et al., Clin Cancer Res., 8, 2202-9, (2002) »PubMed
- Capewell S,et al., Lancet., ii, 480-2, (1988)
- Holland S,et al., Clin Pharmacol Ther., 63, 231, (1998)
- Greb WH,et al., Acta Psychiatr Scand., 80 (suppl 350), 95-8, (1989)
- Bray GP,et al., Human Experimental Toxicol., 11, 265-70, (1992)
- 松本鐐一,他, 皮膚科の臨床, 12 (11), 973-83, (1970)
- 富田斉,他, 日本小児科学会雑誌, 91 (6), 1465-71, (1987)
- 井上正和,他, 山田赤十字病院雑誌, 10 (10), 100-3, (1988)
- 尾崎元昭,他, 皮膚科紀要, 74 (1,2), 51-5, (1979)
- Sexton DL,et al., J Am Med Assoc., 116 (8), 700-1, (1941)
- 狩野葉子, アレルギーの臨床, 21 (5), 355-9, (2001)
- 田代哲男,他, 精神神経学雑誌, 88 (6), 441-2, (1986)
- 山下衛, 小児科臨床, 40増, 2923-36, (1987)
- 久野保夫,他, 小児科臨床, 31 (9), 1681-4, (1978)
- Schain RJ,et al., Exper Neurol., 47, 509-15, (1975) »PubMed
- Diaz J,et al., Biol Neonate., 32, 77-82, (1977) »PubMed
- Thorpe E,et al., Food Cosmet Toxicol., 11, 433-42, (1973) »PubMed
- Rossi L,et al., Int J Cancer., 19, 179-85, (1977) »PubMed
- 社内資料:医師主導治験(2008年10月16日承認、申請資料概要2.7.6.1)
- Kawada K,et al., Jpn J Clin Pharmacol Ther., 42 (4), 205-10, (2011) »DOI
- Brunton LL,et al., Goodman & Gilman's The Pharmacological Basis of Therapeutics.11th ed., 510-1, (2006), (NewYork,McGraw-Hill)
- 熊谷洋 監修, 臨床薬理学大系, 4, 102-4, (1963), (東京,中山書店)
- 佐藤公道, 薬局, 35 (1), 81-6, (1984)
- 第十七改正日本薬局方解説書, C-4403-8, (2016), (東京,廣川書店)
24. 文献請求先及び問い合わせ先
文献請求先
ノーベルファーマ株式会社
カスタマーセンター
〒104-0033
東京都中央区新川1-17-24
電話:フリーダイヤル:0120-003-140
製品情報問い合わせ先
ノーベルファーマ株式会社
カスタマーセンター
〒104-0033
東京都中央区新川1-17-24
電話:フリーダイヤル:0120-003-140
26. 製造販売業者等
26.1 製造販売元
ノーベルファーマ株式会社
東京都中央区新川1-17-24