医薬品情報
| 総称名 | ピレスパ |
|---|---|
| 一般名 | ピルフェニドン |
| 欧文一般名 | Pirfenidone |
| 製剤名 | ピルフェニドン錠 |
| 薬効分類名 | 抗線維化剤 |
| 薬効分類番号 | 3999 |
| ATCコード | L04AX05 |
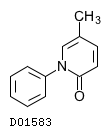
| KEGG DRUG |
D01583
ピルフェニドン
|
| KEGG DGROUP |
DG02019
インターロイキン阻害薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年3月 改訂(第1版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ピレスパ錠200mg | Pirespa Tablets | 塩野義製薬 | 3999025F1021 | 360.7円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
本剤の使用は、特発性肺線維症の治療に精通している医師のもとで行うこと。
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人にはピルフェニドンとして初期用量1回200mgを1日3回(1日600mg)食後に経口投与し、患者の状態を観察しながら1回量を200mgずつ漸増し、1回600mg(1日1800mg)まで増量する。
なお、症状により適宜増減する。
なお、症状により適宜増減する。
7. 用法及び用量に関連する注意
7.1 本剤は初期用量として1回200mg(1日600mg)から開始し、2週間を目安に1回200mgずつ漸増し、1回600mg(1日1800mg)で維持することが望ましい。
7.2 胃腸障害等の発現時には必要に応じて減量又は休薬を検討すること。なお、症状が軽減した場合、7.1に従い漸増し、維持用量の目安を1回400mg(1日1200mg)以上とすることが望ましい。
7.3 食後投与と比べ空腹時投与では、本剤の血漿中濃度が高値を示し、副作用があらわれるおそれがあるので、食後に投与すること。[16.2.1参照]
8. 重要な基本的注意
8.1 光線過敏症があらわれることがあるため、投与にあたっては、事前に患者に対し以下の点について十分に指導すること。
・外出時には長袖の衣服、帽子等の着用や日傘、日焼け止め効果の高いサンスクリーン(SPF50+、PA+++)の使用により、紫外線にあたることを避けるなど、光曝露に対する防護策を講じること。[15.2.2参照]
・発疹、そう痒等の皮膚の異常が認められた場合には、速やかに医師に連絡すること。
8.2 眠気、めまい、ふらつきが起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
8.3 肝機能障害、黄疸があらわれることがあるので、本剤投与中は定期的に検査を行い、患者の状態を十分に観察すること。[11.1.1参照]
8.4 無顆粒球症、白血球減少、好中球減少があらわれることがあるので、定期的に血液検査を行うこと。[11.1.2参照]
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
腎機能障害患者を対象とした臨床試験は実施していない。
9.3 肝機能障害患者
肝機能障害を悪化させるおそれがある。
9.5 妊婦
9.6 授乳婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には減量又は投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害(頻度不明)、黄疸(0.4%)
AST、ALT等の上昇を伴う肝機能障害、黄疸があらわれ、肝不全に至ることがある。[8.3参照]
11.1.2 無顆粒球症、白血球減少、好中球減少(いずれも頻度不明)[8.4参照]
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 皮膚 | 光線過敏症(51.7%)、発疹 | そう痒、紅斑、湿疹、扁平苔癬 | ||
| 消化器 | 食欲不振(23.0%)、胃不快感(14.0%)、嘔気(12.1%)、下痢、胸やけ | 腹部膨満感、嘔吐、便秘、逆流性食道炎、口内炎、腹部不快感、腹痛、口唇炎 | 口唇びらん | |
| 循環器 | 動悸 | |||
| 精神神経系 | 眠気、めまい、ふらつき(感) | 頭痛、頭重 | 抑うつ、不安、不眠 | |
| 肝臓 | γ-GTP上昇(20.0%)、AST上昇、ALT上昇、Al-P上昇、LDH上昇 | ビリルビン上昇 | ||
| 血液 | 白血球増加、好酸球増加 | 血小板減少 | ||
| その他 | 倦怠感 | 体重減少、発熱、味覚異常、筋骨格痛、ほてり |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 ヒトにおける光曝露に伴う皮膚の発がんの可能性について十分な情報はないが、チャイニーズハムスター肺由来培養細胞を用いた光染色体異常試験において、光照射による染色体構造異常誘発性が認められており、光毒性(光線過敏症)が惹起される血漿中濃度と光遺伝毒性を生じる薬物濃度には乖離はない6)。
15.2.2 モルモットを用いた皮膚光毒性試験において、皮膚光毒性を有することが認められた。なお、SPF50+、PA+++のサンスクリーンで光毒性の発現を予防できることが確認されている7)。[8.1参照]
15.2.3 マウス、ラットを用いた長期がん原性試験(104週)において、肝細胞腫瘍(マウス800mg/kg/日以上、ラット750mg/kg/日以上)及び子宮腫瘍(ラット1500mg/kg/日)の発生増加が認められたが、いずれもげっ歯類に特異的な機序によるものと考えられる8)。なお、遺伝毒性試験の結果は陰性であった9)。
15.2.4 ラット、イヌを用いた心血管系試験において、血圧低下(ラット300mg/kg)、心拍数増加(ラット、イヌともに100mg/kg以上)が観察され、心電図では、房室ブロック(ラット100mg/kg以上)、連発性の心室性期外収縮(ラット300mg/kg)、QTc間隔への影響(イヌ100mg/kg以上)が認められた。なお、in vitro心臓電気生理学的試験では、心筋活動電位やhERG電流に対する影響は少ないことが確認されている10)。
16. 薬物動態
16.1 血中濃度
16.1.1 空腹時単回投与
健康成人男性各6例に本剤200mg、400mg及び600mgを空腹時単回経口投与したときの血漿中濃度を図16-1に、薬物動態パラメータを表16-1に示す。Cmax、AUCはいずれも投与量に比例して増大した11)。
図16-1 空腹時単回経口投与時の血漿中濃度
| 投与量(mg) | 例数 | Cmax(μg/mL) | Tmax(hr) | AUC0-48(μg・hr/mL) | T1/2(hr) |
| 200 | 6 | 3.88±0.82 | 0.75±0.27 | 13.97±2.71 | 2.10±0.45 |
| 400 | 6 | 9.24±1.74 | 0.58±0.20 | 29.10±11.77 | 1.96±0.55 |
| 600 | 6 | 10.57±1.78 | 0.83±0.26 | 37.03±11.97 | 1.76±0.40 |
16.1.2 反復投与
健康成人男性12例に本剤200mg、400mg及び600mgを漸増法でそれぞれ1日3回朝、昼、夕の毎食後6日間(投与第1日目及び6日目は朝と昼投与の1日2回)計18日間反復経口投与したときの薬物動態パラメータを表16-2に示す。各投与量における投与第1日目と6日目の血漿中濃度はほぼ同様の時間推移を示し、投与第6日目のCmax、AUCはいずれも投与量にほぼ比例して増大した11)。
| 1回投与量(mg) | 例数 | 投与日(通算) | Cmax0-4※1(μg/mL) | Tmax0-4※1(hr) | Cmax4-24※2(μg/mL) | Tmax4-24※2(hr) | AUC0-24※3(μg・hr/mL) | T1/2(hr) |
| 200 | 12 | 1 | 2.71±0.91 | 1.08±0.47 | 2.83±1.12 | 6.04±1.05 | 19.17±6.46 | 2.17±0.30 |
| 6 | 3.06±1.28 | 1.08±0.82 | 2.70±0.51 | 6.29±0.96 | 22.03±5.47 | 2.25±0.29 | ||
| 400 | 1(7) | 4.94±1.29 | 1.79±0.89 | 6.22±1.59 | 5.79±1.36 | 46.13±10.01 | 2.42±0.48 | |
| 6(12) | 6.19±1.89 | 1.17±0.54 | 5.91±2.09 | 6.38±1.15 | 48.69±11.21 | 2.36±0.38 | ||
| 600 | 1(13) | 8.20±1.29 | 1.25±0.45 | 9.21±1.97 | 6.33±1.15 | 77.22±15.44 | 2.53±0.42 | |
| 6(18) | 8.19±1.54 | 1.71±0.54 | 10.00±1.70 | 6.13±1.00 | 82.31±16.50 | 2.55±0.45 |
16.2 吸収
16.2.1 食事の影響
健康成人男性6例に本剤400mgを食後及び空腹時単回経口投与したときの血漿中濃度を図16-2に、薬物動態パラメータを表16-3に示す。食事によりCmax、AUCは有意に低下し、Tmaxは有意に遅延した11)。[7.3参照]
図16-2 食後及び空腹時単回経口投与時の血漿中濃度
| 投与量(mg) | 例数 | Cmax(μg/mL) | Tmax(hr) | AUC0-48(μg・hr/mL) | T1/2(hr) | |
| 400 | 食後 | 6 | 4.88±1.72 | 1.83±0.75 | 22.13±10.63 | 1.77±0.55 |
| 空腹時 | 9.24±1.74 | 0.58±0.20 | 29.10±11.77 | 1.96±0.55 | ||
16.3 分布
16.3.1 組織移行
ラットに[14C]-ピルフェニドン100mg/kgを単回経口投与したとき、血漿より高い放射能濃度を示す臓器・組織は、肝臓、腎臓、膵臓及び包皮腺であった。大部分の臓器・組織中放射能濃度は、投与後5〜30分に最高濃度を示した後、半減期4〜7時間で消失したが、包皮腺の半減期は他組織に比べ長く約15時間であった12)。
16.3.2 蛋白結合率
健康成人に本剤600mgを空腹時単回経口投与したとき、限外ろ過法にて測定した血清蛋白結合率は、投与後1時間及び3時間後において、54〜62%であった11)。
16.4 代謝
16.5 排泄
健康成人男性各6例に本剤200mg、400mg及び600mgを空腹時単回経口投与したとき、いずれの投与量においても48時間までの尿中排泄率は未変化体1%未満、ピルフェニドン-5-カルボン酸体(主代謝物)約90%であった11)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(二重盲検試験)
承認時におけるプラセボを対照とした二重盲検比較試験において、ピルフェニドン投与はプラセボに比べて52週後の肺活量の低下を抑制することが示された(表17-1)。なお、本試験の対象は、厚生労働省びまん性肺疾患調査研究班第4次改訂の特発性間質性肺炎の臨床的診断基準に基づき特発性肺線維症と診断され、投与前に実施したトレッドミルを用いた6分間歩行試験時の労作時SpO2最低値が85%以上かつ安静時SpO2との差が5%以上である患者とした14)。
| 群 | 有効性評価対象例数 | 調整平均(L) | 標準誤差 | プラセボ群との比較 | ||
| 調整平均の差 (90%信頼区間) | 両側p値 | |||||
| ピルフェニドン | 1800mg/日 | 104 | −0.09 | 0.02 | 0.07 (0.01,0.13) | 0.0416 |
| 1200mg/日 | 54 | −0.08 | 0.03 | 0.09 (0.02,0.16) | 0.0394 | |
| プラセボ | 103 | −0.16 | 0.02 | − | − | |
副作用(症状)は、本剤1800mg/日群で96/109例(88.1%)、本剤1200mg/日群で43/55例(78.2%)に認められた。主な副作用(症状)は、本剤1800mg/日群では光線過敏症56例(51.4%)、食欲不振15例(13.8%)、胃不快感11例(10.1%)、本剤1200mg/日群では光線過敏症29例(52.7%)、食欲不振及び胃不快感が各6例(10.9%)であった。
また、副作用(臨床検査値)は、本剤1800mg/日群で46/109例(42.2%)、本剤1200mg/日群で20/55例(36.4%)に認められた。主な副作用(臨床検査値)は、本剤1800mg/日群ではγ-GTP上昇18例(16.5%)、CRP上昇13例(11.9%)、本剤1200mg/日群ではγ-GTP上昇8例(14.5%)であった14)。
また、副作用(臨床検査値)は、本剤1800mg/日群で46/109例(42.2%)、本剤1200mg/日群で20/55例(36.4%)に認められた。主な副作用(臨床検査値)は、本剤1800mg/日群ではγ-GTP上昇18例(16.5%)、CRP上昇13例(11.9%)、本剤1200mg/日群ではγ-GTP上昇8例(14.5%)であった14)。
18. 薬効薬理
18.1 作用機序
炎症性サイトカイン(TNF-α、IL-1、IL-6等)の産生抑制と抗炎症性サイトカイン(IL-10)の産生亢進を示し、Th2型への偏りの改善(Th1・Th2バランスの修正)につながるIFN-γレベルの低下の抑制を示し、線維化形成に関与する増殖因子(TGF-β1、b-FGF、PDGF)の産生抑制を示すなどの各種サイトカイン及び増殖因子に対する産生調節作用を有する。また、線維芽細胞増殖抑制作用やコラーゲン産生抑制作用も有する。これらの複合的な作用に基づき抗線維化作用を示すと考えられる15)。
19. 有効成分に関する理化学的知見
19.1. ピルフェニドン
22. 包装
500錠[瓶、バラ]
100錠[10錠(PTP)×10]
23. 主要文献
- 社内資料:生殖発生毒性試験(2008/10/16承認、申請資料概要2.6.6.6)
- 社内資料:胎盤・胎児移行性(2008/10/16承認、申請資料概要2.6.4.4)
- 社内資料:乳汁移行性(2008/10/16承認、申請資料概要2.6.4.6)
- 社内資料:フルボキサミン、シプロフロキサシンによる薬物動態への影響
- 社内資料:タバコによる薬物動態への影響
- 社内資料:光遺伝毒性(2008/10/16承認、申請資料概要2.6.6.9)
- 社内資料:皮膚光感作性試験及び皮膚光毒性試験(2008/10/16承認、申請資料概要2.6.6.8)
- 社内資料:がん原性試験(2008/10/16承認、申請資料概要2.6.6.5、2.6.6.9)
- 社内資料:遺伝毒性試験(2008/10/16承認、申請資料概要2.6.6.4)
- 社内資料:安全性薬理試験、心血管系(2008/10/16承認、申請資料概要2.6.2.4)
- 社内資料:臨床における薬物動態(2008/10/16承認、申請資料概要2.7.1.2、2.7.2.2)
- 社内資料:ラットにおける体内組織への移行性(2008/10/16承認、申請資料概要2.6.4.4)
- 社内資料:酸化的代謝に関与するCYP分子種の同定
- 社内資料:第III相臨床試験(2008/10/16承認、申請資料概要2.5.5、2.7.6.5)
- 社内資料:抗線維化作用メカニズム(2008/10/16承認、申請資料概要2.6.2.6)
24. 文献請求先及び問い合わせ先
文献請求先
塩野義製薬株式会社
医薬情報センター
〒541-0045
大阪市中央区道修町3丁目1番8号
電話:0120-956-734
FAX:06-6202-1541
製品情報問い合わせ先
塩野義製薬株式会社
医薬情報センター
〒541-0045
大阪市中央区道修町3丁目1番8号
電話:0120-956-734
FAX:06-6202-1541
26. 製造販売業者等
26.1 製造販売元
塩野義製薬株式会社
大阪市中央区道修町3丁目1番8号