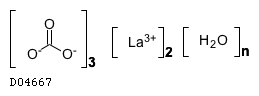医薬品情報
| 総称名 | ホスレノール |
|---|---|
| 一般名 | 炭酸ランタン水和物 |
| 欧文一般名 | Lanthanum Carbonate Hydrate |
| 製剤名 | 炭酸ランタン水和物チュアブル錠 |
| 薬効分類名 | 高リン血症治療剤 |
| 薬効分類番号 | 2190 |
| ATCコード | V03AE03 |
| KEGG DRUG |
D04667
炭酸ランタン水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年10月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ホスレノールチュアブル錠250mg | Fosrenol Chewable Tablets 250mg | バイエル薬品 | 2190029F1026 | 69.8円/錠 | 処方箋医薬品注) |
| ホスレノールチュアブル錠500mg | Fosrenol Chewable Tablets 500mg | バイエル薬品 | 2190029F2022 | 102.7円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
慢性腎臓病患者における高リン血症の改善
5. 効能または効果に関連する注意
本剤は血中リンの排泄を促進する薬剤ではないので、食事療法等によるリン摂取制限を考慮すること。
6. 用法及び用量
通常、成人にはランタンとして1日750mgを開始用量とし、1日3回に分割して食直後に経口投与する。以後、症状、血清リン濃度の程度により適宜増減するが、最高用量は1日2,250mgとする。
7. 用法及び用量に関連する注意
7.1 本剤投与開始時又は用量変更時には、1週間後を目安に血清リン濃度の確認を行うことが望ましい。
7.2 増量を行う場合は増量幅をランタンとして1日あたりの用量で750mgまでとし、1週間以上の間隔をあけて行うこと。
7.3 2週間で効果が認められない場合には、他の適切な治療法に切り替えること。
8. 重要な基本的注意
本剤の投与にあたっては、定期的に血清リン、カルシウム及びPTH濃度を測定しながら慎重に投与すること。血清リン及びカルシウム濃度の管理目標値は学会のガイドライン等、最新の情報を参考にすること。低カルシウム血症及び二次性副甲状腺機能亢進症の発現あるいは発現のおそれがある場合には、ビタミンD製剤やカルシウム製剤の投与あるいは他の適切な治療法に切り替えることを考慮すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 活動性消化性潰瘍、潰瘍性大腸炎、クローン病、腸管狭窄のある患者
本剤の主な副作用は消化器症状のため、これらの疾患に影響を及ぼすおそれがある。
9.1.2 腸管憩室のある患者
腸管穿孔を起こした例が報告されている。
9.1.3 腹膜炎又は腹部外科手術の既往歴のある患者
イレウスを起こした例が報告されている。
9.1.4 消化管潰瘍又はその既往歴のある患者
症状が悪化又は再発した例が報告されている。
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者
重度の肝機能障害を有する患者は臨床試験では除外されている。胆汁排泄が著しく低下しているおそれのある重度の肝機能障害患者では、注意深く観察すること。本剤は主に胆汁中に排泄される。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒトにおいてランタンの乳汁への移行が報告されている3)。
9.7 小児等
投与しないことが望ましい。小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| テトラサイクリン系抗生物質 テトラサイクリン、ドキシサイクリン等 ニューキノロン系抗菌剤 レボフロキサシン水和物、シプロフロキサシン塩酸塩水和物等 | 左記薬剤の吸収が低下し、効果が減弱されるおそれがあるので、本剤服用後2時間以上あけて投与すること。 | ランタンと難溶性の複合体を形成し、左記薬剤の腸管からの吸収を妨げることが考えられる。 |
| 甲状腺ホルモン剤 レボチロキシンナトリウム水和物等 | 左記薬剤の吸収が低下するおそれがあるので、併用する場合には本剤との投与間隔をできる限りあけるなど慎重に投与すること。 | ランタンと難溶性の複合体を形成し、左記薬剤の腸管からの吸収を妨げることが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 腸管穿孔、イレウス(いずれも頻度不明)
これらの病態を疑わせる持続する腹痛、嘔吐等の異常が認められた場合には、投与を中止し、腹部の診察やCT、腹部X線、超音波等を実施すること。また、これらの中には画像検査等により本剤が噛み砕かれていない状態で腸管内に認められた例も報告されている。[14.1.1参照]
11.1.2 消化管出血、消化管潰瘍(いずれも頻度不明)
吐血、下血及び胃、十二指腸、結腸等の潰瘍があらわれることがある。異常が認められた場合には、腹部の診察や内視鏡、腹部X線、CT等を実施すること。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 消化器 | 嘔吐、悪心、便秘 | 胃不快感、腹痛、下痢、逆流性食道炎、腹部膨満感、食欲不振、消化不良 | 腹部不快感、放屁増加、胃潰瘍、胃炎 | |
| 過敏症 | 発疹、そう痒 | |||
| 肝臓 | AST上昇、ALT上昇 | |||
| 血液 | 貧血 | 好酸球増多 | ||
| 内分泌 | 副甲状腺機能亢進症 | |||
| その他 | Al-P上昇 | 胸痛、背部痛、倦怠感、めまい、高カルシウム血症、低リン血症 | 低カルシウム血症、末梢性浮腫 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 本剤は噛み砕かずに服用すると溶けにくく、腸管穿孔、イレウスを起こした例の中には噛み砕いていない例もある。また、十分に噛み砕かずに服用し、本剤を誤嚥した症例が報告されているので、口中で十分に噛み砕き、唾液又は少量の水で飲み込むよう指導すること。なお、噛み砕くことが困難な患者(高齢者等)には、本剤を粉砕して投与することが望ましい。[11.1.1参照]
14.1.2 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.2 薬剤投与中の注意
本剤服用患者の腹部X線撮影時には、ランタンが存在する胃腸管にバリウム様の陰影を認めることがある。
15. その他の注意
15.1 臨床使用に基づく情報
胃腸管にランタンの沈着又は薬剤残留物が認められることがある。胃・十二指腸の粘膜におけるランタンの沈着は、内視鏡により様々な大きさ及び形の白っぽい病変として確認されている。また、ランタンが沈着した胃・十二指腸の粘膜では、慢性又は活動性炎症、腺萎縮、再生性変化、小窩過形成、腸上皮化生、新生物など様々な病理学的特徴が確認されたとの報告があるが、ランタンの沈着との関連性は明らかではない。
15.2 非臨床試験に基づく情報
動物における薬物動態試験において、本剤の反復経口投与により、他の組織に比べて特に骨、消化管及び肝臓でランタン濃度が高く推移し、消失も遅延していた。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人男子8例に本剤250及び1000mgを単回投与した際のランタンの薬物動態パラメータを表に示した4)。
| 投与量 | Cmax(ng/mL) | tmax※(h) | t1/2(h) | AUC(ng・h/mL) |
| 250mg | 0.156 | 4.00 | 7.8 | 1.56 |
| 1000mg | 0.192 | 5.25 | 19.2 | 3.69 |
16.1.2 反復投与
日本人健康成人男子9例に本剤1000mgを1日3回10日間反復投与したときの定常状態における血漿中ランタン濃度は、投与後6時間目に最高値に達し、Cmax及びAUC(0-8)はそれぞれ0.558ng/mL及び3.67ng・h/mLであった5)。
16.1.3 透析患者
日本人透析患者に本剤を最大4500mg注)/日投与した国内長期投与試験における投与開始後28、52及び156週目の平均血漿中ランタン濃度はそれぞれ0.406ng/mL、0.463ng/mL及び0.558ng/mLであった6)。
16.1.4 保存期慢性腎臓病患者
日本人の保存期慢性腎臓病患者に本剤を最大2250mg/日投与した国内長期投与試験における投与開始後32及び60週目の平均血漿中ランタン濃度(幾何平均値)はそれぞれ0.564ng/mL及び0.797ng/mLであった7)。
16.2 吸収
本剤1000mg単回経口投与時の絶対的バイオアベイラビリティーは0.002%未満であった8)(外国人データ)。
16.3 分布
16.3.1 高リン血症を呈する血液透析患者15例を対象として本剤を1日750mgから投与を開始し、1日4500mg注)まで適宜増減して最長3年間投与した国内骨生検試験において、本剤投与開始前及び投与開始3年後に骨生検を行った結果、骨中ランタン濃度は投与開始前の57.3±33.5ng/gに対して、投与3年後には4100.6±2297.2ng/gと、血漿中ランタン濃度の0.60±0.41ng/mL(投与開始前:検出感度以下)よりも高く、骨に蓄積する傾向が認められた9)。また、血液透析患者1359例(本剤682例、標準療法群677例)を対象として本剤を1日3000mg注)まで最長2年間投与した海外長期投与試験においても、測定が可能であった28例における骨中ランタン濃度は投与開始前80.9±59.8ng/g、投与開始2年後1855.3±1338.3ng/gであり、同患者の血漿中ランタン濃度(投与開始前:0.0±0.07ng/mL、投与開始2年後:0.5±0.65ng/mL)よりも高かった10)。
16.3.2 In vitro試験において、ランタンのヒト血漿タンパク結合率は高かった(99.7%)11)。
16.4 代謝
本剤は体内で代謝を受けない。In vitro代謝試験において、ランタンは1A2、2C9/10、2C19、2D6及び3A4/5の各CYP分子種に対して阻害作用を示さなかった12)。
16.5 排泄
16.5.1 単回投与
日本人健康成人男子8例に本剤250及び1000mgを単回投与した際の尿中ランタン濃度はほとんどの被験者で定量下限未満であった。また、120時間目までの糞中回収率はそれぞれ59.5%、66.9%であった4)。
| 投与量 | 糞中回収率※(%) |
| 250mg | 59.5 |
| 1000mg | 66.9 |
16.5.2 反復投与
日本人健康成人男子9例に本剤1000mgを1日3回注)10日間反復投与した際の最終投与後48時間までにすべての被験者から平均で投与量の0.0000164%が尿中に排泄され、投与したランタンの59.8%が糞中から回収された5)。
注)本剤の承認された最高用量は1日2,250mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相比較試験
高リン血症を呈する血液透析患者259例(本剤126例、沈降炭酸カルシウム133例)を対象とした比較試験において、本剤を1日750mgから投与を開始し、1日2250mgまで適宜増減した。その結果、血清リン濃度(Mean±SD)は、投与開始時8.35±1.38mg/dLから投与終了時5.78±1.44mg/dLと低下が認められた。また、血清カルシウム濃度(Mean±SD)は、投与開始時9.02±0.69mg/dL、投与終了時9.22±0.61mg/dLと変化は認められず、本剤の臨床的有用性が確認された。
副作用(臨床検査値異常を含む)は126例中29例(23.0%)に認められた。主な副作用は、嘔吐14例(11.1%)、悪心12例(9.5%)、胃不快感4例(3.2%)、上腹部痛3例(2.4%)、便秘2例(1.6%)等であった13)。
17.1.2 国内第III相一般臨床試験
高リン血症を呈する腹膜透析患者45例を対象として本剤を1日750mgから投与を開始し、1日2250mgまで適宜増減した結果、血清カルシウム濃度を上昇させることなく血清リン濃度(Mean±SD)が投与開始時7.16±1.21mg/dLから投与終了時5.54±1.31mg/dLと低下した。
副作用(臨床検査値異常を含む)は45例中7例(15.6%)に認められた。主な副作用は、嘔吐2例(4.4%)、腹痛2例(4.4%)、下痢2例(4.4%)等であった14)。
副作用(臨床検査値異常を含む)は45例中7例(15.6%)に認められた。主な副作用は、嘔吐2例(4.4%)、腹痛2例(4.4%)、下痢2例(4.4%)等であった14)。
17.1.3 国内長期投与試験
高リン血症を呈する血液透析患者145例を対象として本剤を1日750mgから投与を開始し、1日4500mg注)まで適宜増減して最長3年間投与した結果、血清リン濃度低下効果が維持された患者も認められた。
副作用(臨床検査値異常を含む)は145例中83例(57.2%)に認められた。主な副作用は、嘔吐45例(31.0%)、悪心43例(29.7%)、胃不快感18例(12.4%)、下痢12例(8.3%)、上腹部痛12例(8.3%)等であった6)。
副作用(臨床検査値異常を含む)は145例中83例(57.2%)に認められた。主な副作用は、嘔吐45例(31.0%)、悪心43例(29.7%)、胃不快感18例(12.4%)、下痢12例(8.3%)、上腹部痛12例(8.3%)等であった6)。
17.1.4 国内第III相比較試験
高リン血症を呈する保存期の慢性腎臓病患者141例(本剤86例、プラセボ55例)を対象とした比較試験において、本剤を1日750mgから投与を開始し、1日2250mgまで適宜増減した。その結果、血清リン濃度(Mean±SD)は、本剤投与群において、投与開始時6.17±1.30mg/dLから投与終了時5.14±1.43mg/dLと低下が認められた。一方、プラセボ投与群では、投与開始時は6.15±1.04mg/dL、投与終了時は6.10±1.05mg/dLであった。
投与開始時から終了時(8週時)の血清リン濃度変化量の最小二乗平均値の差[95%信頼区間]は−0.97mg/dL[−1.37mg/dL、−0.58mg/dL]であり、本剤のプラセボに対する優越性が示された(P<0.0001、共分散分析モデル)。
副作用(臨床検査値異常を含む)は87例中20例(23.0%)に認められた。主な副作用は、便秘9例(10.3%)、悪心9例(10.3%)、嘔吐5例(5.7%)、下痢2例(2.3%)等であった15)。
投与開始時から終了時(8週時)の血清リン濃度変化量の最小二乗平均値の差[95%信頼区間]は−0.97mg/dL[−1.37mg/dL、−0.58mg/dL]であり、本剤のプラセボに対する優越性が示された(P<0.0001、共分散分析モデル)。
副作用(臨床検査値異常を含む)は87例中20例(23.0%)に認められた。主な副作用は、便秘9例(10.3%)、悪心9例(10.3%)、嘔吐5例(5.7%)、下痢2例(2.3%)等であった15)。
17.1.5 国内第III相長期投与試験
高リン血症を呈する保存期の慢性腎臓病患者123例を対象とした長期投与試験において、本剤を1日750mgから投与を開始し、最高1日2250mgまで投与した結果、血清リン濃度低下効果が維持された患者も認められた。なお、本剤の投与期間(平均値±標準偏差)は173.6±121.6日であった。
副作用(臨床検査値異常を含む)は123例中29例(23.6%)に認められた。主な副作用は、便秘10例(8.1%)、悪心7例(5.7%)、嘔吐6例(4.9%)、消化不良3例(2.4%)、腹部不快感2例(1.6%)等であった7)。
副作用(臨床検査値異常を含む)は123例中29例(23.6%)に認められた。主な副作用は、便秘10例(8.1%)、悪心7例(5.7%)、嘔吐6例(4.9%)、消化不良3例(2.4%)、腹部不快感2例(1.6%)等であった7)。
注)本剤の承認された最高用量は1日2,250mgである。
18. 薬効薬理
18.1 作用機序
炭酸ランタンは、消化管内で食物由来のリン酸イオンと結合して不溶性のリン酸ランタンを形成し、腸管からのリン吸収を抑制することにより、血中リン濃度を低下させる16)。
18.2 リン結合作用
In vitro試験において、炭酸ランタンをリン酸ナトリウム溶液中で反応させた結果、リン除去率はpH3で97.5%、pH5で97.1%及びpH7で66.6%であった17)。
18.3 血清リン濃度低下作用
5/6腎摘出ラットに炭酸ランタンを6週間反復投与したとき、血清リン濃度は溶媒対照群に比して有意に低下した18)。
19. 有効成分に関する理化学的知見
19.1. 炭酸ランタン水和物
20. 取扱い上の注意
湿気により、製品の品質が影響を受けるので、PTPシートの状態で保存すること。
22. 包装
<ホスレノールチュアブル錠250mg>
100錠[10錠(PTP)×10]
<ホスレノールチュアブル錠500mg>
90錠[6錠(PTP)×15]
23. 主要文献
- 社内資料:妊娠ラットにおける出生前及び出生後の発生並びに母体の機能に関する試験(2008年10月16日承認、CTD2.6.6.6)
- 社内資料:妊娠ウサギにおける胚・胎児発生に関する試験(2008年10月16日承認、CTD2.6.6.6)
- Wappelhorst O,et al., Nutrition., 18, 316-322, (2002) »PubMed »DOI
- 社内資料:単回経口投与薬物動態試験(2008年10月16日承認、CTD2.7.6.4)
- 社内資料:反復経口投与薬物動態試験(2008年10月16日承認、CTD2.7.6.5)
- 社内資料:長期投与試験(2008年10月16日承認)
- 社内資料:保存期の慢性腎臓病患者を対象とした長期投与試験(2013年8月20日承認)
- Pennick M,et al., J Clin Pharmacol., 46, 738-746, (2006) »PubMed »DOI
- 社内資料:骨生検試験(2008年10月16日承認)
- 社内資料:海外長期投与試験(2008年10月16日承認、CTD2.7.6.23)
- 社内資料:血漿タンパク結合(in vitro)(2008年10月16日承認、CTD2.6.4.4)
- 社内資料:チトクロームP450(CYP)分子種(in vitro)(2008年10月16日承認、CTD2.6.4.5)
- 社内資料:二重盲検比較試験(2008年10月16日承認、CTD2.7.6.19)
- 社内資料:腹膜透析患者を対象とした一般臨床試験(2008年10月16日承認、CTD2.7.6.20)
- 社内資料:保存期の慢性腎臓病患者を対象とした二重盲検試験(2013年8月20日承認)
- Harrison TS,et al., Drugs., 64, 985-996, (2004)
- 社内資料:リン結合作用(in vitro)(2008年10月16日承認、CTD2.6.2.2)
- 社内資料:血清リン濃度低下作用(2008年10月16日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
バイエル薬品株式会社
メディカルインフォメーション
〒530-0001
大阪市北区梅田二丁目4番9号
文献請求先
製品情報問い合わせ先
バイエル薬品株式会社
電話:0120-106-398
バイエル医療用医薬品のお問い合わせ先
26. 製造販売業者等
26.1 製造販売元
バイエル薬品株式会社
大阪市北区梅田二丁目4番9号