医薬品情報
| 総称名 | ファロム |
|---|---|
| 一般名 | ファロペネムナトリウム水和物 |
| 欧文一般名 | Faropenem Sodium Hydrate |
| 薬効分類名 | 経口用ペネム系抗生物質製剤 |
| 薬効分類番号 | 6139 |
| ATCコード | J01DI03 |
| KEGG DRUG |
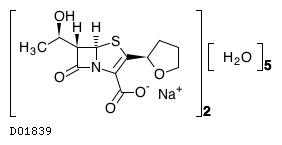
D01839
ファロペネムナトリウム水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ファロムドライシロップ小児用10% | Farom Dry Syrup for Pediatric | マルホ | 6139001R1032 | 180.2円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
<適応菌種>
<適応症>
表在性皮膚感染症、深在性皮膚感染症、リンパ管・リンパ節炎、慢性膿皮症、咽頭・喉頭炎、扁桃炎、急性気管支炎、肺炎、膀胱炎、腎盂腎炎、中耳炎、副鼻腔炎、歯周組織炎、猩紅熱、百日咳
5. 効能または効果に関連する注意
<咽頭・喉頭炎、扁桃炎、急性気管支炎、中耳炎、副鼻腔炎>
「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
6. 用法及び用量
通常、小児に対してファロペネムナトリウム水和物として1回5mg(力価)/kgを1日3回、用時溶解して経口投与する。
なお、年齢、体重及び症状に応じて適宜増減する。増量の場合は1回10mg(力価)/kgを上限とする。
なお、年齢、体重及び症状に応じて適宜増減する。増量の場合は1回10mg(力価)/kgを上限とする。
7. 用法及び用量に関連する注意
7.1 患者の状態等によって投与量を増量する場合であっても、1回10mg(力価)/kgを超えないこととし、慎重に行うこと。
7.2 年長児への投薬にあたっては、成人での上限用量の1回300mg(力価)、1日3回(1日900mg(力価))を超えないよう留意すること。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.2 ショックがあらわれるおそれがあるので、十分な問診を行うこと。[11.1.1参照]
8.3 AST・ALT・Al-P等の上昇、黄疸があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.6参照]
8.4 本剤で最も発現頻度が高い副作用は下痢、軟便であり、次のような傾向が認められているので、投与量に留意するとともに、便の状態を十分に観察し、下痢、軟便があらわれた場合には、その症状、程度、経過に応じ、本剤の投与を中止するなどの適切な処置を行うこと。また、下痢、軟便があらわれた場合には症状の経過に十分に留意し、医師の指示を受けるよう患者の保護者や患者を指導すること。[9.1.4、11.2参照]
・下痢、軟便の副作用発現頻度は、3歳以上(4.0%)に比べ3歳未満(13.5%)の患者で高いので3歳未満の乳幼児への投与に際しては観察を十分に行うこと。
・下痢、軟便の発現は投与開始から3日目までにみられることが多いので投与開始の初期には特に注意し、観察すること。
・1回投与量が高くなるにつれ、下痢、軟便の発現頻度が高くなる傾向が認められた(5mg(力価)/kg:5.4%、7.5mg(力価)/kg:9.2%、10mg(力価)/kg:10.9%)ので投与量に留意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 ペニシリン系、セフェム系又はカルバペネム系薬剤に対し過敏症の既往歴のある患者
9.1.2 本人又は両親、兄弟が気管支喘息、発疹、蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者
9.1.3 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
ビタミンK欠乏症状があらわれることがある。
9.1.4 下痢症状を呈している患者
下痢症状を悪化させる可能性がある。[8.4参照]
9.2 腎機能障害患者
9.2.1 高度の腎機能障害の患者
投与量を減量するか投与間隔をあけて使用すること。本剤の主たる排泄経路は腎臓であり、血中濃度半減期が延長し、血中濃度が持続する。[16.6.1参照]
9.7 小児等
低出生体重児、新生児を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
不快感、口内異常感、喘鳴、呼吸困難、眩暈、便意、耳鳴、発汗、全身潮紅、血管浮腫、血圧低下等があらわれた場合には投与を中止し、適切な処置を行うこと。[8.2参照]
11.1.2 急性腎障害(頻度不明)
急性腎障害等の重篤な腎機能障害があらわれることがある。
11.1.3 偽膜性大腸炎等の血便を伴う重篤な大腸炎(頻度不明)
腹痛、頻回の下痢があらわれた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.4 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.5 間質性肺炎、PIE症候群(いずれも頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、PIE症候群があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.6 肝機能障害、黄疸(いずれも頻度不明)
AST・ALT・Al-P等の上昇、黄疸があらわれることがある。[8.3参照]
11.1.7 無顆粒球症(頻度不明)
11.1.8 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等を特徴とする横紋筋融解症があらわれ、これに伴って急性腎障害等の重篤な腎機能障害があらわれることがある。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 過敏症 | 発疹、蕁麻疹 | そう痒、発熱、発赤、紅斑 | |
| 血液 | 好酸球増多 | 白血球分画の異常等、顆粒球数の変動、血小板数の変動 | |
| 肝臓 | AST・ALT・γ-GTP・Al-P・LDHの上昇 | ビリルビンの上昇 | |
| 腎臓 | BUNの上昇 | クレアチニンの上昇 | |
| 消化器 | 下痢注1) | 軟便注1) | 嘔気、嘔吐、腹痛、食欲不振、腹部膨満感、口角炎、口唇炎、胃腸障害、消化不良、胃炎、便秘 |
| 菌交代症 | カンジダ症注2) | 口内炎 | |
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等) | ||
| その他 | しびれ、ほてり、頭痛、めまい、眠気、浮腫、口唇乾燥、眼痛、爪変色、倦怠感 |
12. 臨床検査結果に及ぼす影響
12.1 テステープ反応を除くベネディクト試薬、フェーリング試薬による尿糖検査では偽陽性を呈することがあるので注意すること。
12.2 直接クームス試験陽性を呈することがあるので注意すること。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は用時調製の製剤であるので、調製後の保存は避け、水に溶解後は速やかに使用すること。やむをえず保存を必要とする場合は、冷蔵庫内に保存し、できるかぎり速やかに使用すること。
14.1.2 市販飲料により調製する場合は、用時調製し、速やかに使用すること。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
小児患者に5及び10mg(力価)/kgを食後に経口投与すると、約1時間後にそれぞれ1.3、2.1μg/mLの最高血漿中濃度に到達し、その半減期は約1時間であった7)。
図 小児患者の食後経口投与時の血漿中濃度推移
| 投与量(mg/kg) | 例 | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC(0-24hr)(μg・hr/mL) |
| 5 | 12 | 1.32±0.72 | 1.17±0.39 | 1.66±1.12 | 4.10±2.32 |
| 10 | 11 | 2.08±1.28 | 1.27±0.65 | 1.14±0.53 | 5.89±3.76 |
16.2 吸収
小児における平均吸収率は成人の1/2程度(10%)と推定された8)。
16.3 分布
16.4 代謝
吸収されたファロペネムは代謝を受けずに尿中に排泄される他に、腎に存在するDehydropeptidase-I(DHP-I)により代謝された後に尿中に排泄される。ヒトの血漿及び尿中には抗菌活性を有する代謝物は認められていない14)(ファロム錠 成人の場合)。
16.5 排泄
主として腎より排泄され、小児(食後)における5及び10mg(力価)/kg経口投与時の尿中排泄率(0〜6時間)はそれぞれ3.7及び3.1%で、最高尿中濃度は5mg(力価)/kg投与では2〜4時間で27μg/mL、10mg(力価)/kgでは0〜2時間で41μg/mLであった7)。
16.6 特定の背景を有する患者
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内一般臨床試験
小児の各種細菌感染患者615例を対象に、本剤を1回3〜10mg(力価)/kg1日3回、3〜14日間経口投与した一般臨床試験17)の有効性解析対象494例の有効率は、次のとおりであった。
副作用は安全性解析対象548例中36例(6.6%)に認められ、下痢又は軟便32例(5.8%)、臀部カンジダ症、蕁麻疹、下痢・臀部カンジダ症、下痢・発疹各1例(各0.2%)であった。
副作用は安全性解析対象548例中36例(6.6%)に認められ、下痢又は軟便32例(5.8%)、臀部カンジダ症、蕁麻疹、下痢・臀部カンジダ症、下痢・発疹各1例(各0.2%)であった。
| 感染症名 | 有効率(%) | |||
| 皮膚感染症 | 表在性皮膚感染症 | 39/48 | (81.3) | 61/72(84.7) |
| 深在性皮膚感染症 | 4/4 | (100) | ||
| リンパ管・リンパ節炎 | 16/17 | (94.1) | ||
| 慢性膿皮症 | 2/3 | (66.7) | ||
| 呼吸器感染症 | 肺炎 | 33/37 | (89.2) | 234/246(95.1) |
| 咽頭・喉頭炎、扁桃炎、急性気管支炎 | 201/209 | (96.2) | ||
| 尿路感染症 | 腎盂腎炎、膀胱炎 | 51/51(100) | ||
| 猩紅熱 | 46/46(100) | |||
| 百日咳 | 14/16(87.5) | |||
| 耳鼻咽喉科感染症 | 中耳炎 | 25/35 | (71.4) | 26/36(72.2) |
| 副鼻腔炎 | 1/1 | (100) | ||
| 歯科・口腔外科感染症 | 歯周組織炎 | 1/1(100) | ||
17.1.2 国内一般臨床試験
小児の各種細菌感染患者40例を対象に、本剤を1回5mg(力価)/kg1日3回、3〜14日間経口投与した一般臨床試験18)の有効性解析対象37例の有効率は、次のとおりであった。
副作用は安全性解析対象39例中12例(30.8%)に認められ、下痢又は軟便10例(25.6%)、発疹の増強、蕁麻疹様発疹各1例(2.6%)であった。
副作用は安全性解析対象39例中12例(30.8%)に認められ、下痢又は軟便10例(25.6%)、発疹の増強、蕁麻疹様発疹各1例(2.6%)であった。
| 感染症名 | 有効率(%) | |||
| 呼吸器感染症 | 肺炎 | 8/8 | (100) | 30/31(96.8) |
| 咽頭・喉頭炎、扁桃炎、急性気管支炎 | 22/23 | (95.7) | ||
| 耳鼻咽喉科感染症 | 中耳炎 | 5/6(83.3) | ||
18. 薬効薬理
18.1 作用機序
18.2 抗菌作用
19. 有効成分に関する理化学的知見
19.1. ファロペネムナトリウム水和物
20. 取扱い上の注意
<瓶包装品>
本剤は吸湿しやすいので、調剤後その都度密栓すること(香料の減少や吸湿による主成分の分解により特異臭や、吸湿により塊が発生することがある)。
22. 包装
分包
0.5g×120
瓶(乾燥剤入り)
50g×1、100g×1
23. 主要文献
- 厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
- 金井 靖ら, 薬理と治療, 25 (9), 2343-2346, (1997)
- 藤谷朝通ら, 薬理と治療, 25 (7), 1781-1799, (1997)
- 杉山和志ら, Chemotherapy, 42 (S-1), 101-114, (1994) »DOI
- 岡本雅春ら, 薬理と治療, 26 (1), 13-21, (1998)
- 釜田 悟ら, Chemotherapy, 42 (S-1), 131-160, (1994) »DOI
- 藤井良知ら, 日本化学療法学会雑誌, 45 (10), 872-890, (1997) »DOI
- 社内資料:薬物動態試験(1999年9月22日承認、申請資料へ.2.3)(1))
- 岩垣明隆ら, Chemotherapy, 42 (S-1), 389-399, (1994) »DOI
- 佐々木次郎ら, Chemotherapy, 42 (S-1), 642-655, (1994) »DOI
- 荒田次郎ら, Chemotherapy, 42 (S-1), 503-522, (1994) »DOI
- 馬場駿吉ら, 耳鼻と臨床, 40 (3), 479-487, (1994) »DOI
- 斎藤 功ら, Chemotherapy, 42 (S-1), 427-436, (1994) »DOI
- 中島光好ら, Chemotherapy, 41 (12), 1277-1292, (1993) »DOI
- 松本文夫ら, Chemotherapy, 42 (S-1), 339-344, (1994) »DOI
- 高本正祇ら, Chemotherapy, 42 (S-1), 375-380, (1994) »DOI
- 社内資料:国内一般臨床試験(1999年9月22日承認、申請資料ト.2.1))
- 砂川慶介ら, Jpn.J.Antibiot., 50 (9), 739-755, (1997) »PubMed
- 横田 健ら, Chemotherapy, 42 (S-1), 13-24, (1994) »DOI
- 西野武志ら, Chemotherapy, 42 (S-1), 51-71, (1994) »DOI
- 那須孝昭ら, Chemotherapy, 42 (S-1), 72-81, (1994) »DOI
- 井上栄子ら, Chemotherapy, 42 (S-1), 1-12, (1994) »DOI
- 那須孝昭ら, Chemotherapy, 42 (S-1), 25-37, (1994) »DOI
- 永平和広ら, Chemotherapy, 42 (S-1), 38-50, (1994) »DOI
- 岡本清美ら, Pharma medica, 15 (10), 135-142, (1997)
- 那須孝昭ら, Pharma medica, 15 (10), 143-146, (1997)
24. 文献請求先及び問い合わせ先
文献請求先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
製品情報問い合わせ先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
26. 製造販売業者等
26.1 製造販売(輸入)
マルホ株式会社
大阪市北区中津1-5-22