医薬品情報
| 総称名 | ミオカーム |
|---|---|
| 一般名 | ピラセタム |
| 欧文一般名 | Piracetam |
| 製剤名 | ピラセタム内服液 |
| 薬効分類名 | ミオクローヌス治療剤 |
| 薬効分類番号 | 1190 |
| ATCコード | N06BX03 |
| KEGG DRUG |
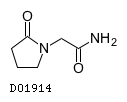
D01914
ピラセタム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年4月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ミオカーム内服液33.3% | MYOCALM SOLUTION | ユーシービージャパン | 1190013S1037 | 24.2円/mL | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
皮質性ミオクローヌスに対する抗てんかん剤などとの併用療法
6. 用法及び用量
通常、成人は1回12mL(ピラセタムとして4g)を1日3回、3〜4日間経口投与する。その後患者の状態に合わせて、1回3mL(ピラセタムとして1g)ずつ1日3回の割合で3〜4日ごとに増量し、至適用量を決定し、投与を継続する。なお、1回15〜21mL(ピラセタムとして5〜7g)、1日3回まで漸増するが、最高量は1回21mL(ピラセタムとして7g)、1日3回までとし、症状に応じて適宜増減する。
7. 用法及び用量に関連する注意
7.1 ピラセタムはほぼ100%腎臓から排泄されるため、腎機能障害患者及び腎機能が低下している患者に対しては下記基準を参考とし投与量を調節する。
| クレアチニン・クリアランス | 血清クレアチニン | ピラセタム投与量 |
| 60〜40mL/分 | 1.25〜1.70mg/dL | 通常量の1/2 |
| 40〜20mL/分 | 1.7〜3.0mg/dL | 通常量の1/4 |
7.2 本剤は他の抗てんかん剤などとの併用にて使用すること。
7.3 通常投与を中止する場合には3〜4日間毎に1回3mL(ピラセタムとして1g)ずつ1日3回の割合で減量すること。連用中における投与量の急激な減量ないし投与の中止により、ミオクローヌス重積状態があらわれることがある。[11.1.1参照]
8. 重要な基本的注意
8.1 本剤の投与に際しては、次のことを含めて本剤の有効性及び安全性について患者に十分説明し、同意を得ること。
・国内においては比較臨床試験が実施されていないこと。
・一般臨床試験において、少数例で有効性と安全性が検討されたものであること。
8.2 連用中には定期的に肝・腎機能検査、血液検査を行うことが望ましい。
8.3 眠気、抑うつ、運動過剰等があらわれることがあるので、本剤投与中の患者には自動車の運転等、危険を伴う機械の操作に従事させないよう注意すること。
8.4 目のかすみ、白内障があらわれることがあるので、定期的に眼科検査を行うことが望ましい。[11.1.2参照]
8.5 長期投与により横紋筋融解症があらわれる可能性があるので観察を十分に行うとともに、必要に応じてCK等の臨床検査を行うことが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 出血傾向のある患者
9.1.2 甲状腺機能亢進症の患者
錯乱、過敏状態、睡眠障害があらわれるおそれがある。
9.1.3 ハンチントン病の患者
症状を悪化させるおそれがある。
9.2 腎機能障害患者
9.2.1 重症腎不全の患者(クレアチニン・クリアランスが20mL/分以下)
9.2.2 腎機能障害のある患者(クレアチニン・クリアランス20mL/分〜60mL/分)[7.1参照]
9.3 肝機能障害患者
肝機能障害が悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験で胎盤関門の通過が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト乳汁中へ移行することが報告されている。
9.7 小児等
9.7.1 小児等に対する臨床試験は実施していない。
9.7.2 海外では約3g/日投与において活動性亢進、不眠、抑うつ、興奮、不安が報告されている(頻度不明)。
9.8 高齢者
少量から投与を開始するなど用量に留意すること。一般的に生理機能(腎機能、肝機能)が低下していることが多い。
[7.1参照]
[7.1参照]
10. 相互作用
10.2 併用注意
| 甲状腺抽出物(T3(リオチロニン)、T4(レボチロキシン)) | 錯乱、過敏状態、睡眠障害があらわれたとの報告がある。異常が認められた場合には投与を中止するなど適切な処置を行うこと。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 けいれん発作(1.7%)
連用中における投与量の急激な減量ないし投与の中止によりけいれん発作があらわれることがある。[7.3参照]
11.1.2 白内障(1.7%)
定期的に眼科検査を行うなど観察を十分に行い、目のかすみ等の症状があらわれた場合には減量、休薬等の適切な処置を行うこと。[8.4参照]
11.2 その他の副作用
| 5%以上 | 5%未満 | |
| 血液 | 白血球減少 | 血小板減少 |
| 精神神経系 | 眠気 | 倦怠感、ふらつき感、易怒・粗暴性、記銘力低下、運動過剰、神経過敏、不安感、抑うつ、不眠 |
| 消化器 | 下痢・軟便 | 嘔気・嘔吐、食欲不振、胃部不快感、腹痛、口渇、舌苔 |
| 肝臓 | 肝機能異常 | |
| その他 | 熱感・発汗、胸部圧迫感、筋肉痛、感冒様症状、女性型乳房、血圧上昇、皮疹、ALP増加、CK増加 |
16. 薬物動態
16.1 血中濃度
16.1.1 血漿中濃度
健康成人男子にピラセタムとして6.4g単回経口投与した場合、投与後1.0時間にCmax173.7μg/mLを示し、半減期5.6時間で消失した。健康成人男子にピラセタムとして1回6.4g、1日3回7日間反復経口投与した場合、血漿中濃度は投与3日目で定常状態に達した4)。
| 投与量 | AUC(0→∞)(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) |
| 6.4g | 1192.5±159.4 | 173.7±25.2 | 1.00±0.52 | 5.6±2.0 |
単回投与における血漿中ピラセタム濃度推移
16.4 代謝
健康成人男子にピラセタムとして6.4gを単回又は1日3回7日間反復経口投与した後の血漿中、尿中には未変化体のみが確認され、代謝物は検出されなかった4)。
16.5 排泄
健康成人男子にピラセタムとして6.4g単回経口投与した場合、投与後48時間までに投与量の92.7%が尿中に排泄された。健康成人男子にピラセタムとして1回6.4g、1日3回7日間反復経口投与した場合、累積尿中排泄率は投与後3〜7日目においてほぼ一定の値を示した4)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
脊髄性ミオクローヌスを除くミオクローヌスを有する15歳以上の患者60例を対象として、初めに用量設定試験を4〜16日間で行い、患者毎に至適投与量としての維持量を決定した。まず12g/日を投与し、4日後に「無効」と判定された場合には、最高24g/日まで4日ごとに1日量を3gずつ増量した。そして、その維持量を4週間投与した。
皮質性ミオクローヌス35例におけるミオクローヌス評価指数(平均値±標準偏差)は、4.7±1.6から3.3±1.5と有意に減少し、ミオクローヌスの改善が認められた5)。
副作用発現頻度は、30.2%(16/53例、26件)であり、主な副作用は、下痢9.4%(5件/53例)、眠気、吐気、倦怠感が各3.8%(2件/53例)であった。
17.1.2 国内長期投与試験
国内第II相試験を完了した患者36例を対象として、原則として国内第II相試験における維持量を1年間投与した。また、1年間の投与期間を終了した症例については、引き続き試験を継続してもよいこととした。
皮質性ミオクローヌスにおけるミオクローヌス評価指数は1年後の集計(23例)において4.6±1.4から2.8±1.5と有意に減少し、また、2年後の集計(14例)において4.6±1.5から2.8±1.6と有意に減少した6)。
副作用発現頻度は、1年後では6.9%(2/29例)で、副作用は眠気、毛舌症が各3.4%(1/29例)であった。2年後では6.3%(1/16例)で眠気であった。
18. 薬効薬理
18.1 作用機序
18.1.1 神経伝達物質の受容体に対する作用
ラット及びウシの脳を用いた受容体結合試験において、グルタミン酸受容体に対する50%阻害濃度は1.3mMであった。また、GABA、ベンゾジアゼピン、オピエート及びセロトニン受容体に対する50%阻害濃度は17.0〜57.0mMであった7)。
18.1.2 神経伝達物質に対する作用
ラットにおいて5-hydroxytryptophan投与により誘発されるhead-twitchの回数を増加させた。また、線条体、黒質及び脳幹の5-hydroxytryptamineと5-hydroxyindoleacetic acid含量を増加させ、セロトニン代謝回転を促進することが示唆された8)。
18.2 薬理作用
ラット尿素誘発ミオクローヌスモデルにおいて、自発性ミオクローヌスの出現頻度及び体性感覚誘発電位(SEP)を低下させ、また、脳波の高振幅律動性徐波を抑制し、低電位速波化した9)。
19. 有効成分に関する理化学的知見
19.1. ピラセタム
20. 取扱い上の注意
冷蔵庫等の低温の場所に保存すると液層の分離、凍結、結晶析出の可能性がある。
22. 包装
380mL[1瓶]
23. 主要文献
- Bick R L,et al., Int Symp on Nootropic Drugs Rio de Janeiro Oct 25-26., 253-255, (1979)
- Moriau M,et al., Arzneim-Forsch/Drug Res., 43, 110-118, (1993)
- Moriau M,et al., Arzneim-Forsch/Drug Res., 43, 526-535, (1993)
- 木下利彦 他, 基礎と臨床, 30, 2211-2229, (1996)
- 池田昭夫 他, 臨床医薬, 13, 457-484, (1997)
- 池田昭夫 他, 臨床医薬, 13, 485-500, (1997)
- Bering B,et al., Arzneim-Forsch/Drug Res., 35, 1350-1352, (1985)
- Allikmets L H,et al., Activ Nerv Sup., 25, 61-63, (1983)
- 社内資料:尿素誘発ミオクローヌスに対するPiracetamの影響−ラットにおける電気生理学的研究
24. 文献請求先及び問い合わせ先
文献請求先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
製品情報問い合わせ先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
26. 製造販売業者等
26.1 製造販売元
ユーシービージャパン株式会社
東京都新宿区西新宿8丁目17番1号
26.2 販売元
大鵬薬品工業株式会社
東京都千代田区神田錦町1-27