医薬品情報
| 総称名 | ナサニール |
|---|---|
| 一般名 | ナファレリン酢酸塩水和物 |
| 欧文一般名 | nafarelin acetate hydrate |
| 製剤名 | ナファレリン酢酸塩水和物点鼻液 |
| 薬効分類名 | Gn-RH誘導体製剤 |
| 薬効分類番号 | 2499 |
| ATCコード | H01CA02 |
| KEGG DRUG |
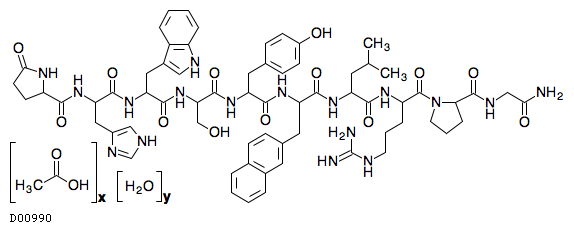
D00990
ナファレリン酢酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年8月 改訂(効能変更、用法変更)(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ナサニール点鼻液0.2% | Nasanyl Nasal Spray 0.2% | ファイザー | 2499702Q1043 | 4915.1円/瓶 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<子宮筋腫の縮小及び子宮筋腫に基づく過多月経、下腹痛、腰痛、貧血の改善>
5.1 本剤による子宮筋腫に対する治療は根治療法ではないことに留意し、手術が適応となる患者の手術までの保存療法並びに閉経前の保存療法としての適用を原則とすること。なお、下腹痛、腰痛に対する効果は、投与初期には認められないので、その間は、適当な対症療法を考慮すること。
<生殖補助医療における早発排卵の防止>
5.2 本剤の投与にあたっては、患者及びパートナーの検査を十分に行い、本剤の投与の適否を判断すること。特に、甲状腺機能低下、副腎機能低下、高プロラクチン血症及び下垂体又は視床下部腫瘍等が認められた場合、当該疾患の治療を優先すること。
6. 用法及び用量
<子宮内膜症、子宮筋腫の縮小及び子宮筋腫に基づく過多月経、下腹痛、腰痛、貧血の改善>
通常、成人には1回あたり片側の鼻腔に1噴霧(ナファレリンとして200μg)を1日2回、月経周期1〜2日目より投与する。
<生殖補助医療における早発排卵の防止>
通常、1回あたり片側の鼻腔に1噴霧(ナファレリンとして200μg)を1日2回投与する。
7. 用法及び用量に関連する注意
<子宮内膜症、子宮筋腫の縮小及び子宮筋腫に基づく過多月経、下腹痛、腰痛、貧血の改善>
<子宮内膜症>
7.2 本剤の長期投与において、エストロゲン低下作用に基づく骨塩量の低下がみられるとの報告があるので、6ヵ月以上は投与しないことが望ましい。
<子宮筋腫の縮小及び子宮筋腫に基づく過多月経、下腹痛、腰痛、貧血の改善>
7.3 本剤の長期投与において、エストロゲン低下作用に基づく骨塩量の低下がみられることがあるので、6ヵ月を超える投与は原則として行わないこと。6ヵ月を超える投与の安全性は確立していない。
<生殖補助医療における早発排卵の防止>
7.4 以下のいずれかの方法で投与する。
・通常、調節卵巣刺激を行う前の月経周期の黄体期中期又は2日目から本剤の投与を開始し、下垂体脱感作を確認した後に調節卵巣刺激を開始する。調節卵巣刺激に引き続く最終的な卵胞成熟の誘発まで本剤の投与を継続する。
・通常、調節卵巣刺激を行う月経周期の1又は2日目から本剤の投与を開始し、調節卵巣刺激に引き続く最終的な卵胞成熟の誘発まで本剤の投与を継続する。
8. 重要な基本的注意
<効能共通>
8.1 マウス、ラットに長期投与した試験で下垂体腫瘍、膵小島腺腫及び副腎髄質良性腫瘍の発現率が増加したとの報告があるので、長期にわたり漫然と投与しないこと。
<子宮内膜症、子宮筋腫の縮小及び子宮筋腫に基づく過多月経、下腹痛、腰痛、貧血の改善>
8.2 投与に際して、類似疾患(悪性腫瘍など)との鑑別に留意し、投与中腫瘤が増大したり、臨床症状の改善がみられない場合は投与を中止すること。
<子宮内膜症>
8.3 再治療を行う場合は、骨塩量の低下に留意しながら、慎重に投与すること。
<子宮筋腫の縮小及び子宮筋腫に基づく過多月経、下腹痛、腰痛、貧血の改善>
8.4 本剤の再投与については、安全性が確立していない。やむを得ず再投与する場合には、可能な限り骨塩量の検査を行い慎重に投与すること。
<生殖補助医療における早発排卵の防止>
8.5 本剤は、不妊治療に十分な知識と経験のある医師のもとで使用すること。本剤投与により予想されるリスク及び注意すべき症状について、あらかじめ患者に説明を行うこと。
8.6 本剤を用いた不妊治療により、卵巣過剰刺激症候群があらわれることがある。患者に対しては、自覚症状(下腹部痛、下腹部緊迫感、悪心、腰痛等)や急激な体重増加が認められた場合には直ちに医師等に相談するよう、あらかじめ説明すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 粘膜下筋腫のある患者
出血症状を増悪させることがある。
9.4 生殖能を有する者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。他のGn-RH誘導体による流産の報告があり、本剤の動物実験で流産などの生殖障害が報告されている。妊娠ラットに本剤6.4μg/kg/日(ヒトに1日400μgを鼻腔内投与したときの10倍に相当)を筋肉内投与したところ、外形及び形態分化への影響が認められたが、妊娠ラットを用いた別の試験並びに妊娠マウス及び妊娠ウサギを用いた試験では認められなかった。妊娠ラットを用いた試験においては、用量依存的な胎児死亡率の増加が認められ、本剤によるホルモン量の変化によるものと考えられた。[2.2、7.1、9.4参照]
9.6 授乳婦
投与しないこと。動物実験で乳汁中へ移行することが報告されている。[2.3参照]
9.7 小児等
小児等を対象とした国内臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| 性ホルモン製剤 エストラジオール誘導体 エストリオール誘導体 結合型エストロゲン製剤 卵胞ホルモンと黄体ホルモンの合剤 両性混合ホルモン剤 等 | 本剤の効果を減弱することがある。 | 本剤は性ホルモンの分泌を低下させることにより薬効を示す。従って、性ホルモンの投与は本剤の治療効果を減弱する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 うつ状態(0.1〜5%未満)
エストロゲン低下作用に基づく更年期障害様のうつ状態があらわれることがある。
11.1.2 血小板減少(0.1%未満)
11.1.3 肝機能障害(0.1〜5%未満)、黄疸(頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.4 不正出血(0.1〜5%未満)
大量の不正出血があらわれることがある。
11.1.5 卵巣のう胞破裂(頻度不明)
卵巣のう胞が破裂することがあるので、観察を十分に行い、腹部膨満感、下腹部痛(圧痛等)等の異常が認められた場合には、適切な処置を行うこと。
11.1.6 アナフィラキシー(頻度不明)
アナフィラキシー(呼吸困難、熱感、全身紅潮等)があらわれることがある。
注)発現頻度は使用成績調査を含む
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 低エストロゲン症状 | ほてり | 腟乾燥 | リビドー減退、腟炎 | |
| 子宮・卵巣 | 帯下 | 卵巣過剰刺激症状 | 卵巣のう腫(胞)、卵巣過剰刺激症候群 | |
| 乳房 | 乳房緊満 | 乳房萎縮、乳房痛 | ||
| 皮膚 | ざ瘡、脱毛 | 皮膚乾燥、脂漏、多毛 | ||
| 過敏症 | 発疹、胸痛 | 湿疹、蕁麻疹、そう痒、息切れ | ||
| 消化器 | 便秘、下痢、口渇、食欲減退、腹痛、悪心・嘔吐 | 胃部不快感、食欲亢進 | ||
| 筋骨格系 | 肩こり | 疼痛(四肢・肩・腰等)、血清リン上昇、関節痛 | 筋肉痛 | |
| 精神神経系 | 頭痛 | めまい、神経過敏、しびれ感、傾眠、不安、発汗、立ちくらみ、耳鳴、不眠 | 感覚異常 | 手指のこわばり |
| 循環器 | 心悸亢進、四肢冷感、血圧上昇 | |||
| 鼻 | 鼻腔粘膜刺激症状、鼻炎 | |||
| 血液 | 白血球減少 | |||
| その他 | β-リポ蛋白上昇 | 浮腫、体重増加、咽喉刺激、倦怠感、コレステロール上昇、トリグリセライド上昇 | 味覚異常、顔面浮腫、体重減少、嗅覚異常 |
14. 適用上の注意
14.1 薬剤交付時の注意
投与前には吸収を安定にするため鼻をかむ等の指導をすること。
16. 薬物動態
16.1 血中濃度
健康成人(正常月経を有する健康な女性)に本剤を単回鼻腔内投与した場合、ナファレリンの血漿中濃度は投与後20〜40分で最高値に達し、24時間後にはほとんど消失した。Cmax及びAUCは用量に依存して増大し、半減期は4〜7時間であった1)。
ナファレリン酢酸塩水和物の単回投与時の血中ナファレリン濃度の推移
| 投与量 | Cmax(ng/mL) | Tmax(min) | 半減期(min) | AUC(ng・min/mL) |
| 100μg | 0.59±0.46 (0.11〜1.30) | 34.0±5.48 (30〜40) | 409.8±318.3 (234.7〜886.3) | 95.2±67.9 (26.8〜196.4) |
| 200μg | 0.92±0.66 (0.50〜2.15) | 26.7±8.16 (20〜40) | 245.0±47.7 (181.6〜298.0) | 132.3±62.8 (82.4〜253.6) |
| 400μg | 1.43±0.87 (0.58〜3.09) | 25.7±7.87 (20〜40) | 309.9±119.3 (217.5〜567.1) | 235.2±163.9 (84.8〜561.5) |
また、1日400μg(1回200μg:1日2回)を22日間反復投与した場合、ナファレリンの蓄積性は認められなかった1)。
16.5 排泄
健康成人(正常月経を有する健康な女性)に本剤を単回鼻腔内投与した場合、ナファレリンの尿中への排泄量(24時間排泄量の平均値)は100、200及び400μg投与群でそれぞれ212、352及び613ngであった。これらの各投与量に対する割合は各々1%以下であった1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<子宮内膜症>
17.1.1 国内臨床試験
<子宮筋腫の縮小及び子宮筋腫に基づく過多月経、下腹痛、腰痛、貧血の改善>
17.1.2 国内第II相/第III相試験
二重盲検比較試験を含む総計164例の子宮筋腫患者における臨床試験での最終全般改善率は78.1%(114例/146例)であった。投与量は400μg/日で、投与期間は4ヵ月以内であった。
(1)臨床効果
(2)比較対照試験
二重盲検比較試験において、本剤の有用性が認められている8)。
18. 薬効薬理
18.1 作用機序
本剤は下垂体−性腺系を一過性に刺激し排卵促進などGn-RH様作用の強いGn-RHアゴニストであるが、反復投与によりGn-RH受容体数は減少(ダウンレギュレーション)し、下垂体のGn-RHに対する反応性が低下してLH、FSH分泌が抑制される。その結果、主に卵巣のエストロゲン産生・分泌が抑制されて子宮内膜症組織の退縮又は子宮筋腫の縮小により、治療効果を示す。
18.2 基礎薬理試験
18.2.1 下垂体−性腺機能抑制作用
雌サルを用いた実験で、血中LH量及びFSH量の減少で示される下垂体機能の抑制と、正常な性周期に伴う血中プロゲステロン量増加の抑制で示される卵巣機能の抑制が認められた9)。
雌イヌを用いた実験で、正常な性周期に伴う血中プロゲステロン量増加の抑制、排卵の抑制及び無月経で示される卵巣機能の抑制が認められた10)。
実験的子宮内膜症ラットを用いた実験で、下垂体中のGn-RH受容体量の減少及び血中LH量の減少で示される下垂体機能の抑制と血中エストラジオール量の減少で示される卵巣機能の抑制が認められた11)。
18.2.2 実験的子宮内膜症に対する効果
実験的子宮内膜症ラットの実験で、移植子宮内膜片の体積の減少がみられ、子宮内膜症の治癒効果が認められた11)。
18.3 臨床薬理試験
19. 有効成分に関する理化学的知見
19.1. ナファレリン酢酸塩水和物
22. 包装
1瓶
23. 主要文献
- 小林 拓郎ほか, 臨床医薬, 8 (8), 1835-1851, (1992)
- 小林 拓郎ほか, 臨床医薬, 8 (8), 1853-1875, (1992)
- 小林 拓郎ほか, 臨床医薬, 8 (9), 2193-2214, (1992)
- 小林 拓郎ほか, 臨床医薬, 8 (9), 2215-2226, (1992)
- 小林 拓郎ほか, 臨床医薬, 8 (10), 2357-2374, (1992)
- 水口 弘司ほか, 臨床医薬, 8 (10), 2345-2356, (1992)
- 水口 弘司ほか, 臨床医薬, 13 (1), 25-70, (1997)
- 水口 弘司ほか, 臨床医薬, 13 (6), 1493-1532, (1997)
- 社内資料:成熟雌サルの血中LH、FSH量及び性周期に対する作用
- 社内資料:成熟雌イヌの性腺機能に対する作用
- Mizutani,T.et al., Int J Fertil., 40 (2), 106-111, (1995)
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
製品情報センター
〒151-8589
東京都渋谷区代々木3-22-7
電話:学術情報ダイヤル 0120-664-467
FAX:03-3379-3053
製品情報問い合わせ先
ファイザー株式会社
製品情報センター
〒151-8589
東京都渋谷区代々木3-22-7
電話:学術情報ダイヤル 0120-664-467
FAX:03-3379-3053
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7