医薬品情報
| 総称名 | リスパダールコンスタ |
|---|---|
| 一般名 | リスペリドン |
| 欧文一般名 | risperidone |
| 製剤名 | リスペリドン持効性懸濁注射液 |
| 薬効分類名 | 持効性抗精神病剤 |
| 薬効分類番号 | 1179 |
| ATCコード | N05AX08 |
| KEGG DRUG |
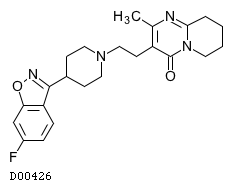
D00426
リスペリドン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年10月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リスパダールコンスタ筋注用25mg | RISPERDAL Consta Intramuscular Injection | ヤンセンファーマ | 1179407G1026 | 13032円/キット | 劇薬, 処方箋医薬品※ |
| リスパダールコンスタ筋注用37.5mg | RISPERDAL Consta Intramuscular Injection | ヤンセンファーマ | 1179407G2022 | 16654円/キット | 劇薬, 処方箋医薬品※ |
| リスパダールコンスタ筋注用50mg | RISPERDAL Consta Intramuscular Injection | ヤンセンファーマ | 1179407G3029 | 19680円/キット | 劇薬, 処方箋医薬品※ |
2. 禁忌
次の患者には投与しないこと
2.1 昏睡状態の患者[昏睡状態を悪化させるおそれがある。]
2.2 バルビツール酸誘導体等の中枢神経抑制剤の強い影響下にある患者[中枢神経抑制作用が増強されることがある。]
2.3 アドレナリン(アドレナリンをアナフィラキシーの救急治療、又は歯科領域における浸潤麻酔もしくは伝達麻酔に使用する場合を除く)、クロザピンを投与中の患者[10.1参照]
2.4 本剤の成分及びパリペリドンに対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人にはリスペリドンとして1回25mgを2週間隔で臀部筋肉内投与する。なお、初回量は25mgとし、その後、症状により適宜増減するが、1回量は50mgを超えないこと。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.1 本剤は持効性製剤であり、直ちに薬物を体外に排除する方法がないため、本剤を投与する場合は、予めその必要性について十分に検討し、副作用の予防、副作用発現時の処置、過量投与等について十分留意すること。[7.1、8.2、11.、13.参照]
8.2 本剤は、投与中止後も4〜6週間は血中濃度が治療域に維持され、消失するまで約8週間かかるため、投与中止後も一定期間は患者の症状を慎重に観察し、副作用等の発現に十分に注意すること。[8.1、16.1.1参照]
8.3 過去にリスペリドンでの治療経験がない場合には、まず、経口リスペリドン製剤を投与し、忍容性があることを確認した後、本剤を投与すること。
8.4 肝障害若しくは腎障害のある患者へ投与する場合には、本剤を投与する前に、少なくとも1日2mgまでの経口リスペリドン製剤により忍容性があることを確認した上で、本剤を投与すること。[9.2、9.3参照]
8.5 本剤投与後の血中濃度は個体間変動が大きく、原因が特定されていない本剤の放出プロファイルから予測できない血中濃度推移を示す症例が認められたとの報告があるため、特に本剤の投与初期及び増量時には、患者の症状を十分観察すること。[16.1.1参照]
8.6 リスペリドンではα交感神経遮断作用に基づく起立性低血圧があらわれることが知られているので、本剤投与にて低血圧があらわれた場合には適切な処置を行うこと。
8.7 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
8.8 興奮、誇大性、敵意等の陽性症状を悪化させる可能性があるので観察を十分に行い、悪化がみられた場合には他の治療法に切り替えるなど適切な処置を行うこと。
8.9 本剤の投与により、高血糖や糖尿病の悪化があらわれ、糖尿病性ケトアシドーシス、糖尿病性昏睡に至ることがあるので、本剤投与中は、口渇、多飲、多尿、頻尿等の症状の発現に注意するとともに、特に糖尿病又はその既往歴あるいはその危険因子を有する患者については、血糖値の測定等の観察を十分に行うこと。[8.11、9.1.6、11.1.9参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心・血管系疾患、低血圧、又はそれらの疑いのある患者
一過性の血圧降下があらわれることがある。
9.1.2 不整脈の既往歴のある患者、先天性QT延長症候群の患者
QTが延長する可能性がある。
9.1.3 パーキンソン病又はレビー小体型認知症のある患者
悪性症候群が起こりやすくなる。また、錐体外路症状の悪化に加えて、錯乱、意識レベルの低下、転倒を伴う体位不安定等の症状が発現するおそれがある。[11.1.1参照]
9.1.4 てんかん等の痙攣性疾患又はこれらの既往歴のある患者
痙攣閾値を低下させるおそれがある。
9.1.5 自殺企図の既往及び自殺念慮を有する患者
症状を悪化させるおそれがある。
9.1.6 糖尿病又はその既往歴のある患者、あるいは糖尿病の家族歴、高血糖、肥満等の糖尿病の危険因子を有する患者
9.1.7 脱水・栄養不良状態等を伴う身体的疲弊のある患者
悪性症候群が起こりやすい。[11.1.1参照]
9.1.8 不動状態、長期臥床、肥満、脱水状態等の患者
抗精神病薬において、肺塞栓症、静脈血栓症等の血栓塞栓症が報告されている。[11.1.12参照]
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠後期に抗精神病薬が投与されている場合、新生児に哺乳障害、傾眠、呼吸障害、振戦、筋緊張低下、易刺激性等の離脱症状や錐体外路症状があらわれたとの報告がある。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。経口リスペリドン製剤においてヒトで乳汁移行が認められている1)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
本剤を高齢者に投与したときの血中濃度は非高齢者の範囲内であったが、一般に高齢者では生理機能が低下していることが多く、副作用があらわれやすいことから、患者の症状を十分観察し慎重に投与すること。
10. 相互作用
相互作用序文
本剤は主としてCYP2D6で代謝される。また、一部CYP3A4の関与も示唆される。
薬物代謝酵素用語
CYP2D6
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
10.2 併用注意
| 中枢神経抑制剤(バルビツール酸誘導体等) | 相互に作用を増強することがあるので、減量するなど慎重に投与すること。 | 本剤及びこれらの薬剤の中枢神経抑制作用による。 |
| ドパミン作動薬 | 相互に作用を減弱することがある。 | 本剤はドパミン遮断作用を有していることから、ドパミン作動性神経において作用が拮抗する可能性がある。 |
| 降圧薬 | 降圧作用が増強することがある。 | 本剤及びこれらの薬剤の降圧作用による。 |
| アルコール | 相互に作用を増強することがある。 | アルコールは中枢神経抑制作用を有する。 |
| CYP2D6を阻害する薬剤(パロキセチン2)等) [16.7.1参照] | 本剤及び活性代謝物の血中濃度が上昇することがある。 | これらの薬剤の薬物代謝酵素阻害作用による。 |
| CYP3A4を誘導する薬剤(カルバマゼピン3)、フェニトイン、リファンピシン4)、フェノバルビタール) [16.7.1参照] | 本剤及び活性代謝物の血中濃度が低下することがある。 | これらの薬剤のCYP3A4誘導作用による。 |
| CYP3A4を阻害する薬剤(イトラコナゾール5)等) [16.7.1参照] | 本剤及び活性代謝物の血中濃度が上昇することがある。 | これらの薬剤のCYP3A4阻害作用による。 |
| QT延長を起こすことが知られている薬剤 | QT延長があらわれるおそれがある。 | QT延長作用が増強するおそれがある。 |
| アドレナリン含有歯科麻酔剤 リドカイン・アドレナリン | 血圧降下を起こすことがある。 | アドレナリンはアドレナリン作動性α、β受容体の刺激剤であり、本剤のα受容体遮断作用によりβ受容体刺激作用が優位となり、血圧降下作用が増強されるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。[8.1参照]
11.1.1 悪性症候群(頻度不明)
11.1.2 遅発性ジスキネジア(0.6%)
長期投与により、口周部等の不随意運動があらわれ、投与中止後も持続することがある。
11.1.3 麻痺性イレウス(頻度不明)
腸管麻痺(食欲不振、悪心・嘔吐、著しい便秘、腹部の膨満あるいは弛緩及び腸内容物のうっ滞等の症状)を来し、麻痺性イレウスに移行することがあるので、腸管麻痺があらわれた場合には、投与を中止するなど適切な処置を行うこと。なお、本剤は動物実験(イヌ)で制吐作用を有することから、悪心・嘔吐を不顕性化する可能性があるので注意すること。[15.2.1参照]
11.1.4 抗利尿ホルモン不適合分泌症候群(SIADH)(頻度不明)
低ナトリウム血症、低浸透圧血症、尿中ナトリウム排泄量の増加、高張尿、痙攣、意識障害等を伴う抗利尿ホルモン不適合分泌症候群(SIADH)があらわれることがある。
11.1.5 肝機能障害、黄疸(頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。[9.3参照]
11.1.6 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがある。また、横紋筋融解症による急性腎障害発症に注意すること。
11.1.7 不整脈(4.6%)
心房細動、心室性期外収縮等があらわれることがある。
11.1.8 脳血管障害(頻度不明)
11.1.9 高血糖、糖尿病性ケトアシドーシス、糖尿病性昏睡(頻度不明)
11.1.10 低血糖(頻度不明)
11.1.11 無顆粒球症、白血球減少(頻度不明)
11.1.12 肺塞栓症、深部静脈血栓症(頻度不明)
肺塞栓症、静脈血栓症等の血栓塞栓症が報告されているので、息切れ、胸痛、四肢の疼痛、浮腫等が認められた場合には、投与を中止するなど適切な処置を行うこと。[9.1.8参照]
11.1.13 持続勃起症(頻度不明)
α交感神経遮断作用に基づく持続勃起症があらわれることがある。
11.1.14 アナフィラキシー(頻度不明)
異常が認められた場合には投与を中止すること。なお、過去に経口リスペリドンで忍容性が確認されている場合でも、アナフィラキシーを起こした症例が報告されている。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 感染症及び寄生虫症 | 胃腸炎、鼻咽頭炎 | 気管支炎、膀胱炎、耳感染、感染、インフルエンザ、注射部位膿瘍、限局性感染、気道感染、咽頭炎、肺炎、鼻炎、副鼻腔炎、皮下組織膿瘍、尿路感染、ウイルス感染、注射部位蜂巣炎、蜂巣炎、扁桃炎、眼感染、中耳炎、爪真菌症、ダニ皮膚炎 | |
| 血液及びリンパ系障害 | 貧血、好中球減少症、血小板減少症 | ||
| 免疫系障害 | 過敏症 | ||
| 内分泌障害 | 高プロラクチン血症 | ||
| 代謝及び栄養障害 | 高尿酸血症、食欲亢進、多飲症、高脂血症 | 食欲不振、水中毒、食欲減退 | |
| 精神障害 | 不眠症、精神症状 | 不安、妄想、幻覚、被害妄想、睡眠障害 | 激越、うつ病、リビドー減退、躁病、神経過敏、自殺企図、緊張、抑うつ症状、リビドー亢進、錯乱状態、気力低下、情動鈍麻、無オルガズム症、悪夢、徘徊、睡眠時遊行症 |
| 神経系障害 | アカシジア | めまい、ふらつき、立ちくらみ、ジスキネジア、ジストニー、錐体外路障害、頭痛、しびれ感、末梢性ニューロパチー、パーキンソニズム、精神運動亢進、傾眠、振戦 | 無動、痙攣、協調運動異常、注意力障害、よだれ、構語障害、構音障害、頭部不快感、過眠症、運動低下、嗜眠、仮面状顔貌、弓なり緊張、錯感覚、鎮静、失神、意識レベルの低下、会話障害(舌のもつれ等)、平衡障害、刺激無反応、運動障害、味覚異常、記憶障害、意識消失、てんかん |
| 眼障害 | 眼脂 | 調節障害、結膜炎、眼球回転発作、網膜動脈閉塞、霧視、視力低下、眼瞼痙攣、眼充血、眼瞼縁痂皮、眼乾燥、流涙増加、羞明、緑内障、術中虹彩緊張低下症候群 | |
| 耳及び迷路障害 | 耳痛、回転性めまい、耳鳴 | ||
| 心臓障害 | 右脚ブロック、洞性頻脈、上室性期外収縮、心室性期外収縮 | 徐脈、左脚ブロック、動悸、洞性徐脈、頻脈、房室ブロック | |
| 血管障害 | 高血圧、起立性低血圧 | 低血圧、末梢循環不全、末梢冷感、潮紅 | |
| 呼吸器、胸郭及び縦隔障害 | 咳嗽、呼吸困難、鼻閉、鼻漏、副鼻腔うっ血、睡眠時無呼吸症候群、口腔咽頭痛、鼻出血、肺うっ血、喘鳴、嚥下性肺炎、発声障害、気道うっ血、ラ音、呼吸障害、過換気 | ||
| 胃腸障害 | 便秘 | 上腹部痛、嚥下障害、胃炎、悪心、流涎過多、胃不快感、嘔吐 | 腹部膨満、腹痛、下痢、口内乾燥、消化不良、腸閉塞、膵炎、歯痛、唾液欠乏、糞塊充塞、便失禁、口唇炎、舌腫脹 |
| 肝胆道系障害 | 肝機能異常 | ||
| 皮膚及び皮下組織障害 | ざ瘡、湿疹、多汗症、そう痒症、発疹、脂漏性皮膚炎 | 脱毛症、血管浮腫、皮膚乾燥、過角化、紅斑、頭部粃糠疹、皮膚変色、皮膚病変、蕁麻疹、水疱 | |
| 筋骨格系及び結合組織障害 | 背部痛、筋固縮、筋肉痛、四肢痛 | 関節痛、筋攣縮、筋力低下、筋骨格痛、頚部痛、姿勢異常、斜頚、筋骨格系胸痛、関節硬直、筋痙縮 | |
| 腎及び尿路障害 | 排尿困難、尿失禁、尿閉、頻尿 | ||
| 生殖系及び乳房障害 | 無月経、射精障害、乳汁漏出症、女性化乳房、月経障害 | 月経遅延、不規則月経、希発月経、性機能不全、乳房不快感、勃起不全、腟分泌物異常、乳房腫大、乳房分泌 | |
| 全身障害及び投与局所様態 | 注射部位疼痛 | 低体温、注射部位紅斑、注射部位硬結、易刺激性、倦怠感、浮腫、発熱、口渇、注射部位腫脹 | 無力症、胸部不快感、胸痛、顔面浮腫、疲労、歩行障害、インフルエンザ様疾患、注射部位嚢胞、注射部位血腫、注射部位壊死、注射部位反応、注射部位潰瘍、末梢性浮腫、疼痛、不活発、注射部位結節、硬結、気分不良、悪寒、薬剤離脱症候群 |
| 臨床検査 | ALT増加、CK増加、血中プロラクチン増加、血中トリグリセリド増加、γ-GTP増加、体重増加 | AST増加、血中クレアチニン増加、血中ブドウ糖増加、LDH増加、血中ナトリウム減少、血中尿酸増加、心電図QT延長、心電図T波逆転、好酸球数増加、グリコヘモグロビン増加、尿中血陽性、血小板数減少、白血球数増加、尿中蛋白陽性、ALP増加、ヘマトクリット減少 | 血圧低下、血中尿素増加、心電図異常、総蛋白減少、体重減少、白血球数減少、肝酵素上昇、尿糖陽性 |
| 傷害、中毒及び処置合併症 | 転倒・転落、引っかき傷 | 処置による疼痛 |
13. 過量投与
13.1 徴候、症状
一般に報告されている徴候、症状は、本剤の作用が過剰に発現したものであり、傾眠、鎮静、頻脈、低血圧、QT延長、錐体外路症状等である。[8.1参照]
13.2 処置
処置に際しては、本剤が持効性製剤であることを考慮し、患者が回復するまで十分観察すること。[8.1参照]
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤の使用にあたっては、取扱い方法を熟読すること。
14.1.2 調製は付属の懸濁液調製器具(アダプター)を用い、薬剤及び専用懸濁用液を常温に戻してから行うこと。本剤を冷蔵庫から取り出した後は25℃以下で保管し、7日以内に調製を行うこと。
14.1.3 懸濁後は25℃以下で取り扱い、6時間以内に投与すること。なお、投与直前に激しく振盪し、再懸濁させること。
14.2 薬剤投与時の注意
14.2.1 専用懸濁用液及び注射針は付属のものを用いること。
14.2.2 本剤は臀部筋肉内のみに投与し、静脈内には絶対に投与しないこと。静脈内に投与された場合、肺等の臓器に微小塞栓を誘発するおそれがある。
14.2.3 炎症部位への投与は行わないこと。また、本剤による治療中に発熱した場合には、患者の状態を十分観察すること。リスペリドンマイクロスフェアからの放出が増加し、血中薬物濃度が増加するおそれがある。
14.2.4 筋肉内注射にあたっては、次の点に注意すること。[7.1参照]
(1)注射部位は、左右臀部の外側上部とし、他の筋には投与しないこと。
(2)注射部位は毎回左右交互とし、同一部位への反復注射は行わないこと。
(3)懸濁後の薬剤は1回の投与でシリンジ内の全量を投与すること。
(4)注射部位をもまないように患者に指示すること。
(5)注射部位に疼痛、硬結をみることがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 国内臨床試験では、他の抗精神病薬持効性注射剤からの切り替えについての有効性及び安全性を裏付けるデータは得られていない。
15.1.2 本剤による治療中、原因不明の突然死が報告されている。
15.1.3 外国で実施された高齢認知症患者を対象とした17の臨床試験において、経口リスペリドン製剤を含む非定型抗精神病薬投与群(本剤は含まない)はプラセボ投与群と比較して死亡率が1.6〜1.7倍高かったとの報告がある。また、外国での疫学調査において、定型抗精神病薬も非定型抗精神病薬と同様に死亡率の上昇に関与するとの報告がある。
15.1.4 本剤を含むα1アドレナリン拮抗作用のある薬剤を投与された患者において、白内障手術中に術中虹彩緊張低下症候群が報告されている。術中・術後に、眼合併症を生じる可能性があるので、術前に眼科医に本剤投与歴について伝えるよう指導すること。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
未変化体リスペリドンと主代謝物9-ヒドロキシリスペリドン(パリペリドン)は同程度の薬理作用を有することから、本剤の薬物動態については、両成分を合算した「活性成分」として検討された。
16.1.1 単回投与
統合失調症患者に本剤を単回筋肉内投与したときの血漿中薬物濃度は、極めて低い濃度を投与後3週間維持した(ラグタイム)後、投与後3〜4週で上昇し、4〜6週でCmaxに到達した(メイン・ピーク)。その後、投与7週以降から低下し、約8週後には定量下限未満となる推移を示した。(外国人データ)[8.2参照]
統合失調症患者に単回筋肉内投与したときの血漿中薬物濃度推移(平均値+S.D.)
※:活性成分(リスペリドン+9-ヒドロキシリスペリドン)
本剤単回投与時の個体間変動は活性成分のCmax及びAUCで24〜48%(変動係数)であった。また、本剤の放出プロファイルから予測できない血中濃度推移(ラグタイムにおける一過性の高値又はメイン・ピーク後の上昇)を示す症例が認められた。7)[8.5参照]
| 薬物動態パラメータ | 25mg(n=14) | 50mg(n=26) |
| Cmax(ng/mL) | 16.1±7.12 | 39.8±15.7 |
| tmax(day) | 34.7±4.0 | 32.8±7.1 |
| AUC(0→t)(ng・hr/mL) | 5644±2513 | 11978±4469 |
| AUC(ng・hr/mL) | 5766±2485 | 11654±4129a) |
| t1/2(hr) | 130.81±118.57 | 95.12±75.74a) |
16.1.2 反復投与
統合失調症患者に本剤を反復筋肉内投与したときの血漿中薬物濃度は、初回投与後6週(投与4回目)に定常状態に達した。定常状態における血漿中薬物濃度は25〜50mgの範囲で用量相関性が認められた。8)
統合失調症患者に反復筋肉内投与(2週間隔で6回)したときの血漿中薬物濃度推移(平均値+S.D.)
※:活性成分(リスペリドン+9-ヒドロキシリスペリドン)
本剤投与前及び初回投与後3週間の平均血漿中活性成分濃度は、経口リスペリドン製剤又はリスペリドン以外の他の経口抗精神病薬を併用投与された症例をあわせて算出
| 薬物動態パラメータ | 25mg(n=8) | 37.5mg(n=9) | 50mg(n=9) |
| Cmax(ng/mL) | 22.47±7.47 | 34.15±11.68 | 43.58±15.37 |
| tmax(day) | 9.45±4.76 | 6.59±4.31 | 9.41±4.46 |
| AUCτ(ng・hr/mL) | 5898.19±2010.51 | 9104.88±3169.44 | 10673.61±3698.31 |
| Cav(ng/mL) | 17.60±5.96 | 27.21±9.40 | 31.87±11.11 |
| t1/2(hr) | 94.34±25.97 | 99.33±40.37 | 95.85±36.87 |
16.3 分布
16.3.1 体組織への分布(参考:イヌでのデータ)
イヌに本剤を反復筋肉内投与したとき、最終投与後の組織内活性成分濃度は、投与部位の筋肉を除いて最も高かったのは肺で、次いで肝臓、腎臓、リンパ節及び脳の順で高かった9)。
16.3.2 血液−脳関門通過性
健康成人にリスペリドン1mg錠を単回経口投与し、脳内におけるドパミンD2及びセロトニン5-HT2受容体占拠率について検討した結果、各受容体に結合親和性を有することが確認された。
したがって、リスペリドンは血液−脳関門を通過することが示唆された。10)
したがって、リスペリドンは血液−脳関門を通過することが示唆された。10)
16.3.3 血漿蛋白結合率
リスペリドン:約90.0%(in vitro、平衡透析法、10ng/mL)
9-ヒドロキシリスペリドン:約77.4%(in vitro、平衡透析法、50ng/mL)11)
16.4 代謝
リスペリドンはCYP2D6及び一部CYP3A4により、活性代謝物9-ヒドロキシリスペリドンに代謝される12)。
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者における経口リスペリドン製剤の薬物動態
16.7 薬物相互作用
健康成人、健康高齢者又は患者(統合失調症、統合失調感情障害、双極性障害、精神病)を対象とした薬物相互作用の検討結果を以下に示す(外国人データ、経口リスペリドン製剤での成績)。
16.7.1 リスペリドンの薬物動態に対する他剤の影響[10.2参照]
(1)カルバマゼピン
統合失調症患者11例にCYP3A4誘導作用を有するカルバマゼピン(400〜1000mg/日反復投与)とリスペリドン(6mg/日反復投与)を21日間併用したときの活性成分(リスペリドン+9-ヒドロキシリスペリドン)のCmax及びAUCτは約50%減少した17)。
(2)シメチジン及びラニチジン
健康成人12例にCYP3A4及びCYP2D6阻害作用を有するシメチジン(800mg/日反復投与)とリスペリドン(1mg単回投与)を併用したときの活性成分のCmax及びAUCはそれぞれ25%及び8%増加した。また、ラニチジン(300mg/日反復投与)と併用したとき、それぞれ36%及び20%増加した。18)
(3)パロキセチン
統合失調症患者12例にCYP2D6阻害作用を有するパロキセチン(10、20及び40mg/日反復投与)とリスペリドン(4mg/日反復投与)を併用したとき、活性成分の定常状態におけるトラフ値がそれぞれ1.3、1.6及び1.8倍上昇した2)。
(4)セルトラリン
統合失調症又は統合失調感情障害患者11例にCYP2D6阻害作用を有するセルトラリン(50mg/日反復投与)とリスペリドン(4〜6mg/日反復投与)を併用したとき、活性成分の血漿中濃度に併用薬は影響を及ぼさなかった。また、セルトラリンを100mg/日に増量した患者では、活性成分の定常状態におけるトラフ値が15%上昇し、150mg/日に増量した2例では、それぞれ36%及び52%上昇した。19)
(5)フルボキサミン
統合失調症患者11例にCYP3A4及びCYP2D6阻害作用を有するフルボキサミン(100mg/日反復投与)とリスペリドン(3〜6mg/日反復投与)を併用したとき、活性成分の血漿中濃度に併用薬は影響を及ぼさなかった。また、フルボキサミンを200mg/日に増量した患者では、リスペリドンの定常状態におけるトラフ値が86%上昇したが、9-ヒドロキシリスペリドンの血漿中濃度に影響を及ぼさなかった。20)
(6)イトラコナゾール
統合失調症患者19例にCYP3A4阻害作用を有するイトラコナゾール(200mg/日反復投与)とリスペリドン(2〜8mg/日反復投与)を併用したときの活性成分の定常状態におけるトラフ値は65%上昇した5)。
(7)ベラパミル
健康男性成人12例にP糖蛋白阻害作用を有するベラパミル(240mg反復投与)とリスペリドン(1mg単回投与)を併用したときの活性成分のCmax及びAUC∞はそれぞれ1.3倍及び1.4倍増加した21)。
(8)その他
統合失調症患者12例にCYP2D6の基質であるアミトリプチリン(50〜100mg/日反復投与)とリスペリドン(6mg/日反復投与)を7日間併用したとき、健康成人18例にCYP3A4阻害作用を有するエリスロマイシン(2000mg/日反復投与)とリスペリドン(1mg単回投与)を併用したとき、双極性障害患者19例にCYP3A4の基質であるトピラマート(100〜400mg/日反復投与)とリスペリドン(1〜6mg/日反復投与)を39日間併用したとき、健康高齢者16例にCYP2D6及びCYP3A4の基質であるガランタミン(8〜24mg/日反復投与)とリスペリドン(1mg/日反復投与)を7日間併用したとき、健康成人24例にCYP2D6及びCYP3A4の基質であるドネペジル(5mg/日反復投与)とリスペリドン(1mg/日反復投与)を14日間併用したとき、それぞれ活性成分の薬物動態に併用薬の影響は認められなかった22)23)24)25)26)。
16.7.2 他剤の薬物動態に対するリスペリドンの影響
健康高齢者18例にジゴキシン(0.125mg/日)とリスペリドン(0.5mg/日)を10日間併用したとき、双極I型障害患者10例にバルプロ酸(1000mg/日)とリスペリドン(2〜4mg/日)を14日間併用したとき、それぞれの薬剤の薬物動態に併用の影響は認められなかった。精神病患者13例にリチウム(炭酸リチウムとして443〜1330mg/日)を反復投与したときのリチウムの薬物動態に、リスペリドン以外の他の抗精神病薬併用からリスペリドン(6mg/日反復投与)併用へ変更しても影響はみられなかった。また、16.7.1での同時検討で、リスペリドンはカルバマゼピン、エリスロマイシン、トピラマート、ガランタミン及びドネペジルの血漿中濃度に影響を及ぼさなかった。17)23)24)25)26)27)28)29)
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
統合失調症患者198例を対象に国内で実施したリスペリドン錠に対する非盲検非劣性試験において、本剤又はリスペリドン錠を24週間投与したときの最終評価時におけるPANSS総スコアのベースラインからの変化量は、表に示すとおり両投与群とも同様の減少を示した。また、CGI改善度評価における「軽度改善」以上の改善率も表に示すとおりであった。30)
| 本剤群 | リスペリドン錠群 | |
| PANSS総スコア変化量a)(解析対象例数) | −6.7±1.31(147) | −6.4±2.22(51) |
| 投与群間差及び95%信頼区間 | −0.3[−5.35;4.82] | |
| CGI改善度評価(「軽度改善」以上) | 53.7%(79/147) | 45.1%(23/51) |
安全性評価対象例147例において、副作用は116例(78.9%)に認められた。その主なものは、血中プロラクチン増加47例(32.0%)、不眠症34例(23.1%)、体重増加18例(12.2%)、注射部位疼痛14例(9.5%)、精神症状13例(8.8%)、ALT増加12例(8.2%)、便秘10例(6.8%)、トリグリセリド増加9例(6.1%)及びγ-GTP増加9例(6.1%)であった。
17.1.2 海外第III相試験
統合失調症患者370例を対象に本剤又はプラセボ注射剤投与による12週間の二重盲検比較試験において、最終評価時におけるPANSS総スコアのベースラインからの変化量(最小二乗平均値)は、プラセボ注射剤群:2.6(n=92)に対し、本剤25mg群:−6.2(n=93)、50mg群:−8.5(n=98)及び75mg群注):−7.4(n=87)であり、本剤群で有意な改善が認められた(p<0.01、Dunnettの多重比較)。なお、錐体外路症状関連の有害事象の発現率は、プラセボ注射剤群で18.4%、25mg群で14.1%、50mg群で26.2%、75mg群注)で31.0%であった。31)
注)本剤の成人の承認用量は、1回25〜50mgである。
18. 薬効薬理
18.1 作用機序
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. リスペリドン
20. 取扱い上の注意
本剤は遮光保存する必要があるため、使用直前に外箱から取り出すこと。
22. 包装
<リスパダールコンスタ筋注用25mg>
1バイアル[専用懸濁用液2mL(シリンジ)、アダプター注1)1個及び注射針注2)1本添付]
<リスパダールコンスタ筋注用37.5mg>
1バイアル[専用懸濁用液2mL(シリンジ)、アダプター注1)1個及び注射針注2)1本添付]
<リスパダールコンスタ筋注用50mg>
1バイアル[専用懸濁用液2mL(シリンジ)、アダプター注1)1個及び注射針注2)1本添付]
注1)バイアルアダプター(医療機器届出番号:11B1X10017000008)
注2)シュアガードIII(医療機器認証番号:223ABBZX00136000)
・針管
ステンレス鋼、太さ0.9mm(20G)、長さ51mm
・針もと及び廃棄用カバー
ポリプロピレン製
23. 主要文献
- Hill RC,et al., J Clin Psychopharmacol., 20, 285-286, (2000) »PubMed »DOI
- Saito M,et al., J Clin Psychopharmacol., 25, 527-532, (2005) »PubMed »DOI
- Spina E,et al., Ther Drug Monit., 22, 481-485, (2000) »PubMed »DOI
- Mahatthanatrakul W,et al., J Clin Pharm Ther., 32, 161-167, (2007) »PubMed »DOI
- Jung SM,et al., Clin Pharmacol Ther., 78, 520-528, (2005) »PubMed »DOI
- 社内資料:リスパダールコンスタのがん原性試験(2009年4月22日承認、CTD2.6.6.5.(2).1))
- 社内資料:リスパダールコンスタの単回投与時の薬物動態の検討(2009年4月22日承認、CTD2.7.6.5)
- 社内資料:リスパダールコンスタの反復投与時の薬物動態の検討(2009年4月22日承認、CTD2.7.6.4)
- 社内資料:リスパダールコンスタの体組織への分布の検討(2009年4月22日承認、CTD2.6.4.4.(1).2))
- Nyberg S,et al., Psychopharmacol., 110, 265-272, (1993) »PubMed »DOI
- Mannens G,et al., Psychopharmacol., 114, 566-572, (1994) »PubMed
- Mannens G,et al., Drug Metab Dispos., 21, 1134-1141, (1993) »PubMed
- Schotte A,et al., Jpn J Pharmacol., 69, 399-412, (1995) »PubMed »DOI
- 社内資料:リスペリドンの代謝物の活性の検討
- 石郷岡純,他, 臨床評価, 19, 93-163, (1991)
- Snoeck E,et al., Psychopharmacol., 122, 223-229, (1995) »PubMed »DOI
- 社内資料:経口リスペリドン製剤とカルバマゼピンとの相互作用の検討
- 社内資料:経口リスペリドン製剤とシメチジン及びラニチジンとの相互作用の検討
- Spina E,et al., Ther Drug Monit., 26, 386-390, (2004) »PubMed »DOI
- D'Arrigo C,et al., Pharmacol Res., 52, 497-501, (2005) »PubMed »DOI
- Nakagami T,et al., Clin Pharmacol Ther., 78, 43-51, (2005) »PubMed »DOI
- 社内資料:経口リスペリドン製剤とアミトリプチリンとの相互作用の検討
- 社内資料:経口リスペリドン製剤とエリスロマイシンとの相互作用の検討
- 社内資料:経口リスペリドン製剤とトピラマートとの相互作用の検討
- 社内資料:経口リスペリドン製剤とガランタミンとの相互作用の検討
- 社内資料:経口リスペリドン製剤とドネペジルとの相互作用の検討
- 社内資料:経口リスペリドン製剤とジゴキシンとの相互作用の検討
- 社内資料:経口リスペリドン製剤とバルプロ酸との相互作用の検討
- 社内資料:経口リスペリドン製剤とリチウムとの相互作用の検討
- 社内資料:リスパダールコンスタの国内第III相臨床試験成績(2009年4月22日承認、CTD2.7.6.7)
- 社内資料:リスパダールコンスタの外国第III相臨床試験成績(2009年4月22日承認、CTD2.7.6.8)
- Janssen PAJ,et al., J Pharmacol Exp Ther., 244, 685-693, (1988)
- Leysen JE,et al., Mol Pharmacol., 41, 494-508, (1992) »PubMed
- Megens A,et al., J Pharmacol Exp Ther., 260, 146-159, (1992) »PubMed
- 菊本修,他, 薬物・精神・行動, 13, 39-42, (1993)
24. 文献請求先及び問い合わせ先
文献請求先
ヤンセンファーマ株式会社
メディカルインフォメーションセンター
〒101-0065
東京都千代田区西神田3-5-2
電話:フリーダイヤル 0120-183-275
製品情報問い合わせ先
ヤンセンファーマ株式会社
メディカルインフォメーションセンター
〒101-0065
東京都千代田区西神田3-5-2
電話:フリーダイヤル 0120-183-275
26. 製造販売業者等
26.1 製造販売元(輸入)
ヤンセンファーマ株式会社
〒101-0065
東京都千代田区西神田3-5-2