医薬品情報
| 総称名 | デキサート |
|---|---|
| 一般名 | デキサメタゾンリン酸エステルナトリウム |
| 欧文一般名 | Dexamethasone sodium phosphate |
| 製剤名 | デキサメタゾンリン酸エステルナトリウム注射液 |
| 薬効分類名 | 副腎皮質ホルモン製剤 |
| 薬効分類番号 | 2454 |
| ATCコード | A01AC02 C05AA09 D07AB19 D07XB05 D10AA03 H02AB02 R01AD03 S01BA01 S01CB01 S02BA06 S03BA01 |
| KEGG DRUG |
D00975
デキサメタゾンリン酸エステルナトリウム
|
| KEGG DGROUP |
DG00011
デキサメタゾン
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| デキサート注射液1.65mg (後発品) | DEXART injection | 富士製薬工業 | 2454405H1032 | 108円/管 | 処方箋医薬品注) |
| デキサート注射液3.3mg (後発品) | DEXART injection | 富士製薬工業 | 2454405H3035 | 173円/管 | 処方箋医薬品注) |
| デキサート注射液6.6mg (後発品) | DEXART injection | 富士製薬工業 | 2454405H5038 | 197円/瓶 | 処方箋医薬品注) |
1. 警告
本剤を含むがん化学療法は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本療法が適切と判断される症例についてのみ実施すること。適応患者の選択にあたっては、各併用薬剤の添付文書を参照して十分注意すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 感染症のある関節腔内、滑液嚢内、腱鞘内又は腱周囲[免疫抑制作用により、感染症が増悪するおそれがある。]
2.3 動揺関節の関節腔内[関節症状が増悪するおそれがある。]
2.4 次の薬剤を投与中の患者
デスモプレシン酢酸塩水和物(男性における夜間多尿による夜間頻尿)
<本剤全身投与の患者>
ダクラタスビル塩酸塩、アスナプレビル
<本剤全身投与の患者(ただし単回投与の場合を除く)>
リルピビリン塩酸塩、リルピビリン塩酸塩・テノホビル アラフェナミドフマル酸塩・エムトリシタビン、ドルテグラビルナトリウム・リルピビリン塩酸塩[10.1参照]
4. 効能または効果
○内分泌疾患
慢性副腎皮質機能不全(原発性、続発性、下垂体性、医原性)[筋肉内注射]
急性副腎皮質機能不全(副腎クリーゼ)[静脈内注射、点滴静脈内注射、筋肉内注射]
副腎性器症候群[※筋肉内注射]
亜急性甲状腺炎[※筋肉内注射]
甲状腺中毒症〔甲状腺(中毒性)クリーゼ〕[静脈内注射、点滴静脈内注射、※筋肉内注射]
甲状腺疾患に伴う悪性眼球突出症[※筋肉内注射]
特発性低血糖症[静脈内注射、点滴静脈内注射、※筋肉内注射]
○リウマチ性疾患、結合織炎及び関節炎
関節リウマチ[筋肉内注射、関節腔内注射]
リウマチ熱(リウマチ性心炎を含む)[※静脈内注射、※点滴静脈内注射、筋肉内注射]
リウマチ性多発筋痛[筋肉内注射]
強直性脊椎炎(リウマチ性脊椎炎)[筋肉内注射]
強直性脊椎炎(リウマチ性脊椎炎)に伴う四肢関節炎[関節腔内注射]
関節周囲炎(非感染性のものに限る)[軟組織内注射、腱鞘内注射、滑液嚢内注入]
腱炎(非感染性のものに限る)[軟組織内注射、腱鞘内注射]
腱鞘炎(非感染性のものに限る)[腱鞘内注射]
腱周囲炎(非感染性のものに限る)[軟組織内注射、腱鞘内注射、滑液嚢内注入]
滑液包炎(非感染性のものに限る)[滑液嚢内注入]
変形性関節症(炎症症状がはっきり認められる場合)[関節腔内注射]
非感染性慢性関節炎[関節腔内注射]
痛風性関節炎[関節腔内注射]
○膠原病
○腎疾患
ネフローゼ及びネフローゼ症候群[※静脈内注射、※点滴静脈内注射、※筋肉内注射]
○心疾患
うっ血性心不全[※静脈内注射、※点滴静脈内注射、※筋肉内注射]
○アレルギー性疾患
気管支喘息[静脈内注射、点滴静脈内注射、筋肉内注射(但し、筋肉内注射以外の投与法では不適当な場合に限る)、ネブライザー]
喘息発作重積状態[静脈内注射、点滴静脈内注射]
薬剤その他の化学物質によるアレルギー・中毒(薬疹、中毒疹を含む)[※静脈内注射、※点滴静脈内注射、※筋肉内注射]
血清病[静脈内注射、点滴静脈内注射、※筋肉内注射]
アナフィラキシーショック[静脈内注射、点滴静脈内注射]
○血液疾患
紫斑病(血小板減少性及び血小板非減少性)[静脈内注射、点滴静脈内注射、※筋肉内注射]
溶血性貧血(免疫性又は免疫性機序の疑われるもの)[静脈内注射、点滴静脈内注射、※筋肉内注射]
白血病(急性白血病、慢性骨髄性白血病の急性転化、慢性リンパ性白血病)(皮膚白血病を含む)[静脈内注射、点滴静脈内注射、※筋肉内注射]
上記疾患のうち髄膜白血病[脊髄腔内注入]
再生不良性貧血[静脈内注射、点滴静脈内注射、※筋肉内注射]
凝固因子の障害による出血性素因[静脈内注射、点滴静脈内注射、※筋肉内注射]
顆粒球減少症(本態性、続発性)[静脈内注射、点滴静脈内注射、※筋肉内注射]
○消化器疾患
潰瘍性大腸炎[※静脈内注射、※点滴静脈内注射、※筋肉内注射、注腸]
限局性腸炎[※静脈内注射、※点滴静脈内注射、※筋肉内注射、注腸]
重症消耗性疾患の全身状態の改善(癌末期、スプルーを含む)[※静脈内注射、※点滴静脈内注射、※筋肉内注射]
○肝疾患
劇症肝炎(臨床的に重症とみなされるものを含む)[静脈内注射、※点滴静脈内注射、※筋肉内注射]
肝硬変(活動型、難治性腹水を伴うもの、胆汁うっ滞を伴うもの)[※筋肉内注射]
○肺疾患
びまん性間質性肺炎(肺線維症)(放射線肺臓炎を含む)[※静脈内注射、点滴静脈内注射、ネブライザー]
○重症感染症
重症感染症(化学療法と併用する)[静脈内注射、点滴静脈内注射、※筋肉内注射]
○結核性疾患
結核性髄膜炎(抗結核剤と併用する)[脊髄腔内注入]
結核性胸膜炎(抗結核剤と併用する)[胸腔内注入]
○神経疾患
脳脊髄炎(脳炎、脊髄炎を含む)(但し、一次性脳炎の場合は頭蓋内圧亢進症状がみられ、かつ他剤で効果が不十分なときに短期間用いること)[静脈内注射、点滴静脈内注射、※筋肉内注射、脊髄腔内注入]
末梢神経炎(ギランバレー症候群を含む)[※静脈内注射、※点滴静脈内注射、※筋肉内注射、脊髄腔内注入]
重症筋無力症[静脈内注射、点滴静脈内注射、※筋肉内注射、脊髄腔内注入]
多発性硬化症(視束脊髄炎を含む)[静脈内注射、点滴静脈内注射、※筋肉内注射、脊髄腔内注入]
小舞踏病[※筋肉内注射]
顔面神経麻痺[※筋肉内注射]
脊髄蜘網膜炎[※筋肉内注射]
○悪性腫瘍
好酸性肉芽腫[静脈内注射、点滴静脈内注射、※筋肉内注射]
乳癌の再発転移[※筋肉内注射]
○以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
多発性骨髄腫[点滴静脈内注射]
○抗悪性腫瘍剤(シスプラチンなど)投与に伴う消化器症状(悪心・嘔吐)[静脈内注射、点滴静脈内注射]
○外科疾患
副腎摘除[静脈内注射、点滴静脈内注射、筋肉内注射]
臓器・組織移植[※筋肉内注射]
侵襲後肺水腫[静脈内注射、ネブライザー]
副腎皮質機能不全患者に対する外科的侵襲[※筋肉内注射]
外科的ショック及び外科的ショック様状態[静脈内注射]
脳浮腫[静脈内注射]
輸血による副作用[静脈内注射]
気管支痙攣(術中)[静脈内注射]
蛇毒・昆虫毒(重症の虫さされを含む)[※筋肉内注射]
手術後の腹膜癒着防止[腹腔内注入]
○整形外科疾患
椎間板ヘルニアにおける神経根炎(根性坐骨神経痛を含む)[硬膜外注射]
脊髄浮腫[静脈内注射、硬膜外注射]
○産婦人科疾患
卵管整形術後の癒着防止[※筋肉内注射、卵管腔内注入]
○泌尿器科疾患
前立腺癌(他の療法が無効な場合)[※筋肉内注射]
陰茎硬結[※筋肉内注射、局所皮内注射]
○皮膚科疾患
★湿疹・皮膚炎群(急性湿疹、亜急性湿疹、慢性湿疹、接触皮膚炎、貨幣状湿疹、自家感作性皮膚炎、アトピー皮膚炎、乳・幼・小児湿疹、ビダール苔癬、その他の神経皮膚炎、脂漏性皮膚炎、進行性指掌角皮症、その他の手指の皮膚炎、陰部あるいは肛門湿疹、耳介及び外耳道の湿疹・皮膚炎、鼻前庭及び鼻翼周辺の湿疹・皮膚炎など)(但し、重症例以外は極力投与しないこと。局注は浸潤、苔癬化の著しい場合のみとする)[※筋肉内注射、局所皮内注射]
★痒疹群(小児ストロフルス、蕁麻疹様苔癬、固定蕁麻疹を含む)(但し、重症例に限る。また、固定蕁麻疹は局注が望ましい)[※筋肉内注射、局所皮内注射]
蕁麻疹(慢性例を除く)(重症例に限る)[※点滴静脈内注射、※筋肉内注射]
★乾癬及び類症〔尋常性乾癬(重症例)、乾癬性関節炎、乾癬性紅皮症、膿疱性乾癬、稽留性肢端皮膚炎、疱疹状膿痂疹、ライター症候群〕[※点滴静脈内注射、※筋肉内注射]
上記疾患のうち★尋常性乾癬[局所皮内注射]
★掌蹠膿疱症(重症例に限る)[※筋肉内注射]
★扁平苔癬(重症例に限る)[※筋肉内注射、局所皮内注射]
成年性浮腫性硬化症[※筋肉内注射]
紅斑症(★多形滲出性紅斑、結節性紅斑)(但し、多形滲出性紅斑の場合は重症例に限る)[※筋肉内注射]
粘膜皮膚眼症候群〔開口部びらん性外皮症、スチブンス・ジョンソン病、皮膚口内炎、フックス症候群、ベーチェット病(眼症状のない場合)、リップシュッツ急性陰門潰瘍〕
[※点滴静脈内注射、※筋肉内注射]
★円形脱毛症(悪性型に限る)[局所皮内注射]
デューリング疱疹状皮膚炎(類天疱瘡、妊娠性疱疹を含む)[※点滴静脈内注射、※筋肉内注射]
帯状疱疹(重症例に限る)[※筋肉内注射]
★紅皮症(ヘブラ紅色粃糠疹を含む)[※点滴静脈内注射、※筋肉内注射]
★早期ケロイド及びケロイド防止[局所皮内注射]
新生児スクレレーマ[※筋肉内注射]
○眼科疾患
内眼・視神経・眼窩・眼筋の炎症性疾患の対症療法(ブドウ膜炎、網脈絡膜炎、網膜血管炎、視神経炎、眼窩炎性偽腫瘍、眼窩漏斗尖端部症候群、眼筋麻痺)[※静脈内注射、※筋肉内注射、結膜下注射、球後注射、点眼]
外眼部及び前眼部の炎症性疾患の対症療法で点眼が不適当又は不十分な場合(眼瞼炎、結膜炎、角膜炎、強膜炎、虹彩毛様体炎)[※静脈内注射、※筋肉内注射、結膜下注射、球後注射]
眼科領域の術後炎症[※静脈内注射、※筋肉内注射、結膜下注射、点眼]
○耳鼻咽喉科疾患
急性・慢性中耳炎[※静脈内注射、※点滴静脈内注射、※筋肉内注射、中耳腔内注入]
滲出性中耳炎・耳管狭窄症[※静脈内注射、※点滴静脈内注射、※筋肉内注射、中耳腔内注入、耳管内注入]
メニエル病及びメニエル症候群[静脈内注射、点滴静脈内注射、筋肉内注射]
急性感音性難聴[静脈内注射、点滴静脈内注射、筋肉内注射]
血管運動(神経)性鼻炎[筋肉内注射、ネブライザー、鼻腔内注入、鼻甲介内注射]
アレルギー性鼻炎[筋肉内注射、ネブライザー、鼻腔内注入、鼻甲介内注射]
花粉症(枯草熱)[筋肉内注射、ネブライザー、鼻腔内注入、鼻甲介内注射]
副鼻腔炎・鼻茸[筋肉内注射、ネブライザー、鼻腔内注入、副鼻腔内注入、鼻茸内注射]
進行性壊疽性鼻炎[静脈内注射、点滴静脈内注射、筋肉内注射、ネブライザー、鼻腔内注入、副鼻腔内注入、喉頭・気管注入]
喉頭炎・喉頭浮腫[静脈内注射、点滴静脈内注射、筋肉内注射、ネブライザー、喉頭・気管注入]
喉頭ポリープ・結節[※静脈内注射、※点滴静脈内注射、※筋肉内注射、ネブライザー、喉頭・気管注入]
食道の炎症(腐蝕性食道炎、直達鏡使用後)及び食道拡張術後[静脈内注射、点滴静脈内注射、筋肉内注射、ネブライザー、食道注入]
耳鼻咽喉科領域の手術後の後療法[静脈内注射、点滴静脈内注射、筋肉内注射、軟組織内注射、局所皮内注射、ネブライザー、鼻腔内注入、副鼻腔内注入、鼻甲介内注射、喉頭・気管注入、中耳腔内注入、食道注入]
○歯科・口腔外科疾患
難治性口内炎及び舌炎(局所療法で治癒しないもの)[軟組織内注射]
※印 下記の場合にのみ用いること
1)静脈内注射及び点滴静脈内注射
経口投与不能時、緊急時及び筋肉内注射不適時
2)筋肉内注射
経口投与不能時
★印 外用剤を用いても効果が不十分な場合あるいは十分な効果を期待し得ないと推定される場合のみに用いること
6. 用法及び用量
通常、成人に対する用法・用量は下表の通りである。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
| 投与方法 | 投与量・投与回数 (デキサメタゾンとして) |
| 静脈内注射 | 1回1.65〜6.6mg、3〜6時間毎 |
| 点滴静脈内注射 | 1回1.65〜8.3mg、1日1〜2回 |
| 筋肉内注射 | 1回1.65〜6.6mg、3〜6時間毎 |
| 関節腔内注射 | 1回0.66〜4.1mg、原則として投与間隔を2週間以上とすること |
| 軟組織内注射 | 1回1.65〜5.0mg、原則として投与間隔を2週間以上とすること |
| 腱鞘内注射 | 1回0.66〜2.1mg、原則として投与間隔を2週間以上とすること |
| 滑液嚢内注入 | 1回0.66〜4.1mg、原則として投与間隔を2週間以上とすること |
| 硬膜外注射 | 1回1.65〜8.3mg、原則として投与間隔を2週間以上とすること |
| 脊髄腔内注入 | 1回0.83〜4.1mg、週1〜3回 |
| 胸腔内注入 | 1回0.83〜4.1mg、週1〜3回 |
| 腹腔内注入 | 1回1.65mg |
| 局所皮内注射 | 1回0.04〜0.08mg宛0.83mgまで、週1回 |
| 卵管腔内注入 | 1回0.33〜0.83mg |
| 注腸 | 1回0.33〜5.0mg |
| 結膜下注射 | 1回0.33〜2.1mg、その際の液量は0.2〜0.5mLとする |
| 球後注射 | 1回0.83〜4.1mg、その際の液量は0.5〜1.0mLとする |
| 点眼 | 1回0.21〜0.83mg/mL溶液1〜2滴、1日3〜8回 |
| ネブライザー | 1回0.08〜1.65mg、1日1〜3回 |
| 鼻腔内注入 | 1回0.08〜1.65mg、1日1〜3回 |
| 副鼻腔内注入 | 1回0.08〜1.65mg、1日1〜3回 |
| 鼻甲介内注射 | 1回0.66〜4.1mg |
| 鼻茸内注射 | 1回0.66〜4.1mg |
| 喉頭・気管注入 | 1回0.08〜1.65mg、1日1〜3回 |
| 中耳腔内注入 | 1回0.08〜1.65mg、1日1〜3回 |
| 耳管内注入 | 1回0.08〜1.65mg、1日1〜3回 |
| 食道注入 | 1回0.83〜1.65mg |
<多発性骨髄腫に対する他の抗悪性腫瘍剤との併用療法>
| 投与方法 | 投与量・投与回数 (デキサメタゾンとして) |
| 点滴静脈内注射 | ビンクリスチン硫酸塩、ドキソルビシン塩酸塩との併用において、デキサメタゾンの投与量及び投与法は、通常1日量デキサメタゾンを33mgとし、21日から28日を1クールとして、第1日目から第4日目、第9日目から第12日目、第17日目から第20日目に、投与する。 なお、投与量及び投与日数は、年齢、患者の状態により適宜減ずる。 |
<抗悪性腫瘍剤(シスプラチンなど)投与に伴う消化器症状(悪心・嘔吐)>
| 投与方法 | 投与量・投与回数 (デキサメタゾンとして) |
| 静脈内注射 点滴静脈内注射 | 通常、成人には1日3.3〜16.5mgを、1日1回又は2回に分割して投与する。 ただし、1日最大16.5mgまでとする。 |
7. 用法及び用量に関連する注意
悪性リンパ腫に対する他の抗腫瘍剤との併用療法においては、併用薬剤の添付文書も参照すること。
8. 重要な基本的注意
<効能共通>
8.1 本剤の投与により、誘発感染症、続発性副腎皮質機能不全、消化性潰瘍、糖尿病、精神障害等の重篤な副作用があらわれることがあるので、本剤の投与にあたっては、次の注意が必要である。
8.1.1 投与に際しては特に適応、症状を考慮し、他の治療法によって十分に治療効果が期待できる場合には、本剤を投与しないこと。また、局所的投与で十分な場合には、局所療法を行うこと。
8.1.2 投与中は副作用の出現に対し、常に十分な配慮と観察を行い、また、患者をストレスから避けるようにし、事故、手術等の場合には増量するなど適切な処置を行うこと。
8.1.3 連用後、投与を急に中止すると、ときに発熱、頭痛、食欲不振、脱力感、筋肉痛、関節痛、ショック等の離脱症状があらわれることがあるので、投与を中止する場合には、徐々に減量するなど慎重に行うこと。離脱症状があらわれた場合には、直ちに再投与又は増量すること。
8.1.4 眼科用に用いる場合には原則として2週間以上の長期投与は避けること。
8.2 本剤の長期あるいは大量投与中の患者、又は投与中止後6ヵ月以内の患者では、免疫機能が低下していることがあり、生ワクチンの接種により、ワクチン由来の感染を増強又は持続させるおそれがあるので、これらの患者には生ワクチンを接種しないこと。[11.1.2参照]
8.3 特に、本剤投与中に水痘又は麻疹に感染すると、致命的な経過をたどることがあるので、次の注意が必要である。[11.1.2参照]
8.3.1 本剤投与前に水痘又は麻疹の既往や予防接種の有無を確認すること。
8.3.2 水痘又は麻疹の既往のない患者においては、水痘又は麻疹への感染を極力防ぐよう常に十分な配慮と観察を行うこと。感染が疑われる場合や感染した場合には、直ちに受診するよう指導し、適切な処置を講ずること。
8.3.3 水痘又は麻疹の既往や予防接種を受けたことがある患者であっても、本剤投与中は、水痘又は麻疹を発症する可能性があるので留意すること。
8.5 褐色細胞腫の合併を認識していなかった状態でデキサメタゾン製剤(経口剤及び注射剤)を投与した際に褐色細胞腫クリーゼを発現したとの報告がある。本剤投与後に著明な血圧上昇、頭痛、動悸等が認められた場合は、褐色細胞腫クリーゼの発現を考慮した上で適切な処置を行うこと。[9.1.12参照]
8.6 リンパ系腫瘍を有する患者に投与した場合に腫瘍崩壊症候群があらわれることがあるので、血清中電解質濃度及び腎機能検査を行うなど、患者の状態を十分に観察すること。[11.1.10参照]
<多発性骨髄腫に対する他の抗悪性腫瘍剤との併用療法>
8.7 本療法は、中心静脈カテーテルを留置して行う必要がある。本療法を行う際には、感染症の合併に注意すること。
8.8 本療法を行う多発性骨髄腫の患者のうち、高齢者、特に全身状態不良例では感染症の合併に注意すること。
<強皮症>
8.9 強皮症患者における強皮症腎クリーゼの発現率は、副腎皮質ホルモン剤投与患者で高いとの報告がある。本剤を強皮症患者に投与する場合は、血圧及び腎機能を慎重にモニターし、強皮症腎クリーゼの徴候や症状の出現に注意すること。また、異常が認められた場合には適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 以下の患者には治療上やむを得ないと判断される場合を除き投与しないこと。
(1)有効な抗菌剤の存在しない感染症、全身の真菌症の患者
免疫抑制作用により、感染症が増悪するおそれがある。[11.1.2参照]
(2)消化性潰瘍の患者
粘膜防御能の低下等により、消化性潰瘍が増悪するおそれがある。[11.1.4参照]
(3)精神病の患者
中枢神経系に影響し、精神病が増悪するおそれがある。[11.1.5参照]
(4)結核性疾患の患者
免疫抑制作用により、結核性疾患が増悪するおそれがある。[11.1.2参照]
(5)単純疱疹性角膜炎の患者
免疫抑制作用により、単純疱疹性角膜炎が増悪するおそれがある。[11.1.2参照]
(6)後嚢白内障の患者
(7)緑内障の患者
(8)高血圧症の患者
ナトリウム・水貯留作用等により、高血圧症が増悪するおそれがある。
(9)電解質異常のある患者
ナトリウム・水貯留作用により、電解質異常が増悪するおそれがある。
(10)血栓症の患者
血液凝固能が亢進し、血栓症が増悪するおそれがある。[11.1.8参照]
(11)最近行った内臓の手術創のある患者
創傷治癒を遅延するおそれがある。
(12)急性心筋梗塞を起こした患者
心破裂を起こしたとの報告がある。
(13)コントロール不良の糖尿病の患者
糖新生促進作用(血糖値上昇)等により、糖尿病が増悪するおそれがある。
9.1.2 ウイルス性結膜・角膜疾患、結核性眼疾患、真菌性眼疾患及び急性化膿性眼疾患の患者
治療上やむを得ないと判断される場合を除き、眼科的投与は避けること。免疫抑制作用により、これらの症状が増悪するおそれがある。
9.1.3 感染症の患者(有効な抗菌剤の存在しない感染症、全身の真菌症の患者を除く)
免疫抑制作用により、感染症が増悪するおそれがある。[11.1.2参照]
9.1.4 糖尿病の患者
糖新生促進作用(血糖値上昇)等により、糖尿病が増悪するおそれがある。[11.1.3参照]
9.1.5 骨粗鬆症の患者
骨形成抑制作用及びカルシウム代謝の障害を起こすことにより、骨粗鬆症が増悪するおそれがある。[11.1.6参照]
9.1.6 甲状腺機能低下のある患者
血中半減期の延長がみられ、副作用が起こりやすい。
9.1.7 脂肪肝の患者
脂質代謝に影響し、脂肪肝が増悪するおそれがある。
9.1.8 脂肪塞栓症の患者
脂質代謝に影響し、脂肪塞栓症が増悪するおそれがある。
9.1.9 重症筋無力症の患者
使用当初、一時症状が増悪することがある。
9.1.10 B型肝炎ウイルスキャリアの患者
本剤の投与期間中及び投与終了後は継続して肝機能検査値や肝炎ウイルスマーカーのモニタリングを行うなど、B型肝炎ウイルス増殖の徴候や症状の発現に注意すること。異常が認められた場合には、本剤の減量を考慮し、抗ウイルス剤を投与するなど適切な処置を行うこと。副腎皮質ホルモン剤を投与されたB型肝炎ウイルスキャリアの患者において、B型肝炎ウイルスの増殖による肝炎があらわれることがある。なお、投与開始前にHBs抗原陰性の患者において、B型肝炎ウイルスによる肝炎を発症した症例が報告されている。[11.1.2参照]
9.1.11 薬物、食物、添加物等に過敏な喘息患者
副腎皮質ホルモン剤の投与により、気管支喘息患者の喘息発作を増悪させたとの報告がある。[11.1.9参照]
9.1.12 褐色細胞腫又はパラガングリオーマのある患者及びその疑いのある患者
褐色細胞腫クリーゼがあらわれることがある。[8.5参照]
9.2 腎機能障害患者
9.2.1 腎不全の患者
症状が増悪するおそれがある。
9.3 肝機能障害患者
9.3.1 肝硬変の患者
慢性肝疾患患者では、血中半減期の延長がみられ、副作用が起こりやすい。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。新生児に副腎不全を起こすことがある。また、血圧上昇、心筋壁の肥厚を起こすとの報告がある。動物実験で催奇形作用が報告されている。
本剤(デキサメタゾンとして1日0.15mg)をマウスの妊娠11日から14日まで4日間にわたり筋肉内注射した試験において、口蓋裂の発生が認められている1)。
本剤(デキサメタゾンとして1日0.15mg)をマウスの妊娠11日から14日まで4日間にわたり筋肉内注射した試験において、口蓋裂の発生が認められている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中へ移行することがある。
9.7 小児等
9.7.1 観察を十分に行うこと。小児等の発育抑制があらわれることがある。
9.7.2 長期投与した場合、頭蓋内圧亢進症状があらわれることがある。
9.7.3 筋肉内又は皮内投与はなるべく避けること。小児等では、特に投与部位の組織の萎縮(陥没)を起こしやすい。
9.7.4 低出生体重児で、脳性麻痺、一過性の肥大型心筋症が起こることが報告されている。
9.8 高齢者
長期投与した場合、感染症の誘発、糖尿病、骨粗鬆症、高血圧症、後嚢白内障、緑内障等の副作用があらわれやすい。
10. 相互作用
相互作用序文
本剤は、主に肝代謝酵素チトクロームP450 3A4(CYP3A4)により代謝される。また、CYP3A4の誘導作用をもつ。
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
10.2 併用注意
| バルビツール酸誘導体 フェノバルビタール リファンピシン カルバマゼピン | 本剤の作用が減弱することが報告されている。 | これらの薬剤がチトクロームP450を誘導し、本剤の代謝が促進される。 |
| フェニトイン | 本剤の作用が減弱することが報告されている。 | フェニトインがチトクロームP450を誘導し、本剤の代謝が促進される。 |
| フェニトイン | 併用により、フェニトインの血中濃度が上昇又は低下するとの報告がある。 | 機序不明 |
| サリチル酸誘導体 アスピリン等 | 併用時に本剤を減量すると、血清中のサリチル酸誘導体の濃度が増加し、サリチル酸中毒を起こすことが報告されている。 | 本剤はサリチル酸誘導体の腎排泄と肝代謝を促進し、血清中のサリチル酸誘導体の濃度が低下する。 |
| 抗凝血剤 ワルファリンカリウム | 抗凝血剤の作用を減弱させることが報告されている。 | 本剤は血液凝固促進作用がある。 |
| 糖尿病用薬 ビグアナイド系薬剤 スルホニルウレア剤 速効型インスリン分泌促進剤 α-グルコシダーゼ阻害剤 チアゾリジン系薬剤 DPP-4阻害剤 GLP-1受容体作動薬 SGLT2阻害剤 インスリン製剤等 | これらの薬剤の作用を減弱させることが報告されている。 | 本剤は肝臓での糖新生を促進し、末梢組織での糖利用を阻害する。 |
| 血圧降下剤 | これらの薬剤の作用を減弱させるおそれがある。 | 機序不明 |
| 利尿剤 | これらの薬剤の作用を減弱させるおそれがある。 | 機序不明 |
| 利尿剤(カリウム保持性利尿剤を除く) トリクロルメチアジド フロセミド | 併用により、低カリウム血症があらわれることがある。 | 本剤は尿細管でのカリウム排泄促進作用がある。 |
| シクロスポリン | 副腎皮質ホルモン剤の大量投与により、併用したシクロスポリンの血中濃度が上昇するとの報告がある。 | シクロスポリンの代謝を阻害する。 |
| マクロライド系抗生物質 エリスロマイシン アゾール系抗真菌剤 イトラコナゾール | 副腎皮質ホルモン剤の作用が増強されるとの報告がある。 | 本剤の代謝が阻害されるおそれがある。 |
| HIVプロテアーゼ阻害剤 サキナビルリトナビル等 | 本剤のAUCの上昇あるいはこれらの薬剤のAUCが低下するおそれがある。 | チトクロームP450に対して競合する可能性がある。また、本剤がチトクロームP450を誘導することより、これらの薬剤の代謝が促進される可能性がある。 |
| エフェドリン | 副腎皮質ホルモン剤の代謝が促進され、血中濃度が低下するとの報告がある。 | 機序不明 |
| サリドマイド | 海外において、多発性骨髄腫における本剤との併用により、中毒性表皮壊死症(Lyell症候群)が発現したとの報告がある。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)
失神、意識喪失、呼吸困難、顔面蒼白、血圧低下等の症状があらわれることがあるので観察を十分に行うこと。
11.1.2 誘発感染症(頻度不明)、感染症の増悪(頻度不明)[9.1.1参照]
11.1.3 続発性副腎皮質機能不全(頻度不明)、糖尿病(頻度不明)[9.1.4参照]
11.1.4 消化性潰瘍(頻度不明)、消化管穿孔(頻度不明)、膵炎(頻度不明)[9.1.1参照]
11.1.5 精神変調(頻度不明)、うつ状態(頻度不明)、痙攣(頻度不明)[9.1.1参照]
11.1.6 骨粗鬆症(頻度不明)、大腿骨及び上腕骨等の骨頭無菌性壊死(頻度不明)、ミオパシー(頻度不明)、脊椎圧迫骨折(頻度不明)、長骨の病的骨折(頻度不明)[9.1.5参照]
11.1.8 血栓塞栓症(頻度不明)[9.1.1参照]
11.1.9 喘息発作(頻度不明)[9.1.11参照]
11.1.10 腫瘍崩壊症候群(頻度不明)
リンパ系腫瘍を有する患者に投与した場合、腫瘍崩壊症候群があらわれることがある。異常が認められた場合には、適切な処置(生理食塩液、高尿酸血症治療剤等の投与、透析等)を行うとともに、症状が回復するまで患者の状態を十分に観察すること。[8.6参照]
11.2 その他の副作用
| 頻度不明 | |
| 内分泌 | 月経異常 |
| 消化器 | 下痢、悪心・嘔吐、胃痛、胸やけ、腹部膨満感、口渇、食欲不振、食欲亢進 |
| 精神神経系 | 多幸症、不眠、頭痛、めまい |
| 筋・骨格 | 筋肉痛、関節痛 |
| 投与部位 | <関節腔内投与> 関節の不安定化注1)、疼痛・腫脹・圧痛の増悪 <筋肉内又は皮内投与> 組織の萎縮による陥没(局所) |
| 脂質・蛋白質代謝 | 満月様顔貌、野牛肩、窒素負平衡、脂肪肝 |
| 体液・電解質 | 浮腫、血圧上昇、低カリウム性アルカローシス |
| 眼 | 中心性漿液性網脈絡膜症等による網膜障害、眼球突出 |
| 血液 | 白血球増多 |
| 皮膚 | ざ瘡、多毛、脱毛、色素沈着、皮下溢血、紫斑、線条、そう痒、発汗異常、顔面紅斑、紅斑、創傷治癒障害、皮膚菲薄化・脆弱化、脂肪織炎 |
| その他 | 発熱、疲労感、ステロイド腎症、体重増加、精子数及びその運動性の増減、しゃっくり、刺激感(ピリピリした痛み、しびれ、ひきつり感等)注2) |
12. 臨床検査結果に及ぼす影響
12.1 インドメタシン投与中の患者にデキサメタゾン抑制試験を実施すると、試験結果が偽陰性になるとの報告がある。
12.2 副腎皮質ホルモン剤は、細菌感染症に対するニトロブルー・テトラゾリウム試験に影響を及ぼし、試験結果が偽陰性を示すことがある。
14. 適用上の注意
14.1 薬剤投与時の注意
<静脈内投与>
14.1.1 血管痛、静脈炎を起こすことがあるので、これを予防するため、注射部位、注射方法等について十分注意し、その注射速度はできるだけ遅くすること。
<筋肉内投与>
14.1.2 下記の点に注意すること。
・筋肉内投与は、やむを得ない場合にのみ必要最小限に行うこと。
・同一部位への反復注射は行わないこと。
・神経走行部位を避けること。
・注射針を刺入したとき、激痛を訴えたり、血液の逆流をみた場合は直ちに針を抜き、部位をかえて注射すること。
・注射部位に疼痛、硬結をみることがある。
15. その他の注意
15.1 臨床使用に基づく情報
副腎皮質ホルモン剤を投与中の患者にワクチンを接種して神経障害、抗体反応の欠如が起きたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 静脈内投与
健康成人10例にデキサメタゾンリン酸エステルナトリウム(デキサメタゾンとして20mg)を静注した場合、速やかに水解されて遊離型デキサメタゾンに変換され、血漿中遊離型デキサメタゾン濃度は、投与後約5分で最高値(58.1±6.2μg/dL)を示し、半減期は4.74±0.43時間であった2)。
16.1.2 生物学的同等性試験
デキサート注射液3.3mgとデカドロン注射液3.3mgを、クロスオーバー法によりそれぞれ1mL(デキサメタゾンとして3.3mg)健康成人男子に筋肉内投与して血漿中デキサメタゾン濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→inf (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
| デキサート注射液3.3mg | 169.83±47.46 | 23.61±3.40 | 1.22±0.55 | 5.08±0.89 |
| デカドロン注射液3.3mg | 184.69±48.70 | 24.62±3.03 | 1.13±0.22 | 4.99±0.94 |
※血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.5 排泄
健康成人10例にデキサメタゾンリン酸エステルナトリウム(デキサメタゾンとして20mg)を静注した場合、主として尿中に排泄され、静注後24時間までの遊離型デキサメタゾン排泄率は5.98±0.93%を示した2)。
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
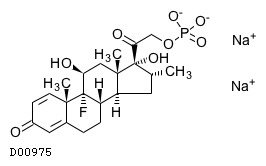
19.1. デキサメタゾンリン酸エステルナトリウム
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
<デキサート注射液1.65mg>
0.5mL
10アンプル、50アンプル
<デキサート注射液3.3mg>
1mL
10アンプル、50アンプル
<デキサート注射液6.6mg>
2mL
10バイアル、50バイアル
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
富士製薬工業株式会社
くすり相談室
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
製品情報問い合わせ先
富士製薬工業株式会社
くすり相談室
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
26. 製造販売業者等
26.1 製造販売元
富士製薬工業株式会社
富山県富山市水橋辻ヶ堂1515番地