医薬品情報
| 総称名 | セレスタミン |
|---|---|
| 一般名 | ベタメタゾン d-クロルフェニラミンマレイン酸塩 |
| 欧文一般名 | Betamethasone d-Chlorpheniramine Maleate |
| 製剤名 | ベタメタゾン・d-クロルフェニラミンマレイン酸塩配合剤 |
| 薬効分類名 | 副腎皮質ホルモン・抗ヒスタミン配合剤 |
| 薬効分類番号 | 2459 |
| ATCコード | R06AB54 |
| KEGG DRUG |
D04447
ベタメタゾン・d-クロルフェニラミンマレイン酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| セレスタミン配合錠 | CELESTAMINE Combination Tablets | 高田製薬 | 2459100F1162 | 8円/錠 | 処方箋医薬品 |
| セレスタミン配合シロップ | CELESTAMINE Combination Syrup | 高田製薬 | 2459100Q1031 | 5.3円/mL | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 適応、症状を考慮し、他の治療法によって十分に治療効果が期待できる場合には、本剤を投与しないこと。また、局所的投与で十分な場合には、局所療法を行うこと。
2.2 本剤の成分に対し過敏症の既往歴のある患者
2.3 閉塞隅角緑内障の患者[抗コリン作用により眼圧が上昇し、症状を悪化させることがある。]
2.4 前立腺肥大等下部尿路に閉塞性疾患のある患者[抗コリン作用により排尿困難、尿閉等があらわれ、症状が増悪することがある。]
2.5 デスモプレシン酢酸塩水和物(男性における夜間多尿による夜間頻尿)を投与中の患者[10.1参照]
4. 効能または効果
6. 用法及び用量
セレスタミン配合錠
<錠剤>
通常、成人には1回1〜2錠を1日1〜4回経口投与する。
なお、年齢、症状により適宜増減する。
ただし、本剤を漫然と使用するべきではない。
なお、年齢、症状により適宜増減する。
ただし、本剤を漫然と使用するべきではない。
セレスタミン配合シロップ
<シロップ剤>
通常、成人には1回5〜10mLを1日1〜4回経口投与する。
小児には1回5mLを1日1〜4回経口投与する。
なお、年齢、症状により適宜増減する。
ただし、本剤を漫然と使用するべきではない。
小児には1回5mLを1日1〜4回経口投与する。
なお、年齢、症状により適宜増減する。
ただし、本剤を漫然と使用するべきではない。
7. 用法及び用量に関連する注意
セレスタミン配合錠
本剤は副腎皮質ホルモンをプレドニゾロン換算で、錠剤として1錠中2.5mg相当量を含有するので、症状改善後は漫然として使用することのないよう注意すること。
セレスタミン配合シロップ
本剤は副腎皮質ホルモンをプレドニゾロン換算で、シロップ剤として1mL中0.5mg相当量を含有するので、症状改善後は漫然として使用することのないよう注意すること。
8. 重要な基本的注意
8.1 眠気を催すことがあるので、本剤投与中の患者には、自動車の運転等危険を伴う機械の操作には従事させないよう十分注意すること。
8.2 本剤の投与により、誘発感染症、続発性副腎皮質機能不全、消化性潰瘍、糖尿病、精神障害等の重篤な副作用があらわれることがある。特に、本剤投与中に水痘又は麻疹に感染すると、致命的な経過をたどることがある。このため、本剤の投与にあたっては次の注意が必要である。
・本剤投与前に水痘又は麻疹の既往や予防接種の有無を確認すること。
・水痘又は麻疹の既往のない患者においては、水痘又は麻疹への感染を極力防ぐよう常に十分な配慮と観察を行うこと。感染が疑われる場合や感染した場合には、直ちに受診するよう指導し、適切な処置を講ずること。
・水痘又は麻疹の既往や予防接種を受けたことがある患者であっても、本剤投与中は、水痘又は麻疹を発症する可能性があるので留意すること。
・投与中は副作用の出現に対し、常に十分な配慮と観察を行い、また、患者をストレスから避けるようにし、事故、手術等の場合には増量するなど適切な処置を行うこと。
・連用後、投与を急に中止すると、ときに発熱、頭痛、食欲不振、脱力感、筋肉痛、関節痛、ショック等の離脱症状があらわれることがあるので、投与を中止する場合には、徐々に減量するなど慎重に行うこと。離脱症状があらわれた場合には、直ちに再投与又は増量すること。
8.4 褐色細胞腫の合併を認識していなかった状態でベタメタゾン製剤(注射剤)を投与した際に褐色細胞腫クリーゼを発現したとの報告がある。本剤投与後に著明な血圧上昇、頭痛、動悸等が認められた場合は、褐色細胞腫クリーゼの発現を考慮した上で適切な処置を行うこと。[9.1.10参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 以下の患者には治療上やむを得ないと判断される場合を除き投与しないこと。
(1)開放隅角緑内障の患者
(2)有効な抗菌剤の存在しない感染症、全身の真菌症の患者
(3)結核性疾患の患者
免疫機能抑制作用により、結核性疾患が増悪することがある。[11.1.1参照]
(4)消化性潰瘍の患者
胃酸分泌の亢進、肉芽組織増殖抑制作用により、潰瘍が増悪又は治癒が遅れることがある。[11.1.3参照]
(5)精神病の患者
中枢神経系に影響し、精神病が増悪することがある。[11.1.4参照]
(6)単純疱疹性角膜炎の患者
免疫機能抑制作用により、単純疱疹性角膜炎が増悪することがある。[11.1.1参照]
(7)後嚢白内障の患者
(8)高血圧症の患者
水及び電解質代謝作用により、高血圧症が増悪することがある。
(9)電解質異常のある患者
電解質代謝作用により、電解質異常が増悪することがある。
(10)血栓症の患者
血液凝固促進作用により、血栓症が増悪することがある。[11.1.7参照]
(11)最近行った内臓の手術創のある患者
創傷治癒(組織修復)が障害されることがある。
(12)急性心筋梗塞を起こした患者
副腎皮質ホルモン剤で心破裂を起こしたとの報告がある。
9.1.2 感染症の患者(有効な抗菌剤の存在しない感染症、全身の真菌症の患者を除く)
9.1.3 糖尿病の患者
糖新生促進作用(血糖値上昇)等により、糖尿病が増悪するおそれがある。
9.1.4 骨粗鬆症の患者
骨形成の抑制、骨からのカルシウム排泄の増加により、骨粗鬆症が増悪するおそれがある。[11.1.5参照]
9.1.5 甲状腺機能低下のある患者
副腎皮質ホルモン剤の血中からの半減時間が長くなるとの報告があり、副作用があらわれるおそれがある。
9.1.6 脂肪肝の患者
脂肪分解・再分布作用により、肝臓への脂肪沈着を増大させ、脂肪肝が増悪するおそれがある。
9.1.7 脂肪塞栓症の患者
副腎皮質ホルモン剤の大量投与により、脂肪塞栓症が起こるとの報告があり、症状が増悪するおそれがある。
9.1.8 重症筋無力症の患者
蛋白異化作用により、使用当初、一時症状が増悪するおそれがある。
9.1.9 B型肝炎ウイルスキャリアの患者又は既往感染者
9.1.10 褐色細胞腫又はパラガングリオーマのある患者及びその疑いのある患者
褐色細胞腫クリーゼがあらわれることがある。[8.4参照]
9.2 腎機能障害患者
9.2.1 腎不全の患者
薬物の排泄が遅延するため、体内蓄積により副作用があらわれるおそれがある。
9.3 肝機能障害患者
9.3.1 肝硬変の患者
代謝酵素の活性低下等により、副作用があらわれるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(マウス)で催奇形作用が報告されており、また、新生仔に副腎不全を起こすことがある。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中へ移行することがある。
9.7 小児等
9.7.1 観察を十分に行い、異常が認められた場合には、減量又は投与を中止するなど適切な処置を行うこと。幼児・小児の発育抑制があらわれることがある。[11.1.9参照]
9.7.2 長期投与した場合、頭蓋内圧亢進症状があらわれることがある。[11.1.9参照]
9.8 高齢者
長期投与した場合、感染症の誘発、糖尿病、骨粗鬆症、高血圧症、後嚢白内障、緑内障等の副作用があらわれやすい。
10. 相互作用
相互作用序文
ベタメタゾンは、主としてCYP3A4で代謝される。
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| デスモプレシン酢酸塩水和物 ミニリンメルト(男性における夜間多尿による夜間頻尿) [2.5参照] | 低ナトリウム血症が発現するおそれがある。 | 機序不明。 |
10.2 併用注意
| 中枢神経抑制剤、 アルコール、 MAO阻害剤、 抗コリン作用を有する薬剤 | 相互に作用を増強することがあるので、併用する場合は、減量するなど慎重に投与すること。 | 中枢神経抑制剤、アルコール:d-クロルフェニラミンマレイン酸塩の中枢抑制作用により、作用が増強される。 MAO阻害剤:d-クロルフェニラミンマレイン酸塩の解毒機構に干渉し、作用を遷延化(増強)する。 |
| ドロキシドパ、 ノルアドレナリン | 併用により血圧の異常上昇を来すおそれがある。 | d-クロルフェニラミンマレイン酸塩がヒスタミンによる毛細血管拡張を抑制する。 |
| バルビツール酸誘導体 フェノバルビタール フェニトイン、 リファンピシン、 エフェドリン | 副腎皮質ホルモン剤の作用が減弱することが報告されているので、併用する場合には、用量について注意すること。 | バルビツール酸誘導体、フェニトイン、リファンピシンはP-450を誘導し、副腎皮質ホルモン剤の代謝が促進される。 |
| サリチル酸誘導体 アスピリン、 アスピリンダイアルミネート、 サザピリン | 併用時に副腎皮質ホルモン剤を減量すると、血清中のサリチル酸濃度が上昇し、サリチル酸中毒を起こすことが報告されているので、併用する場合には、用量について注意すること。 | 副腎皮質ホルモン剤は、サリチル酸誘導体の腎排泄と肝代謝を促進し、血清中のサリチル酸誘導体の濃度を低下させる作用を持っているので減量するとその血中濃度が上昇する。 |
| 抗凝血剤 ワルファリンカリウム | 副腎皮質ホルモン剤が、抗凝血剤の作用を減弱させることが報告されているので、併用する場合には、用量について注意すること。 | 副腎皮質ホルモン剤は血液凝固促進作用がある。 |
| 糖尿病用薬 ビグアナイド系薬剤 スルホニルウレア剤 速効型インスリン分泌促進剤 α-グルコシダーゼ阻害剤 チアゾリジン系薬剤 DPP-4阻害剤 GLP-1受容体作動薬 SGLT2阻害剤 インスリン製剤等 | 副腎皮質ホルモン剤が糖尿病用薬の作用を減弱させることが報告されているので、併用する場合には、用量について注意するとともに、血糖値その他患者の状況を十分観察しながら投与すること。 | 副腎皮質ホルモン剤は、肝臓での糖新生を促進し、末梢組織での糖利用を阻害することによる血糖上昇作用がある。 |
| 利尿剤(カリウム保持性利尿剤を除く) トリクロルメチアジド、 アセタゾラミド、 フロセミド | 副腎皮質ホルモン剤との併用により低カリウム血症があらわれる場合があるので、併用する場合には、用量について注意すること。カリウム排泄型利尿剤との併用時には、血清カリウム濃度と心機能のモニタリングが推奨される。 | 副腎皮質ホルモン剤は、尿細管でのカリウム排泄促進作用がある。 |
| ソマトロピン | 併用により、ソマトロピンの効果が減弱することがある。 | 副腎皮質ホルモン剤がソマトロピンの効果を減弱させる。機序不明。 |
| シクロスポリン | シクロスポリンの血中濃度が上昇するとの報告があるので、併用する場合には、用量について注意すること。 | 本剤はシクロスポリンの代謝を阻害する。 |
| 非脱分極性筋弛緩剤 パンクロニウム臭化物、 ベクロニウム臭化物 | 筋弛緩作用が減弱又は増強するとの報告があるので、併用する場合には、用量について注意すること。 | 機序不明。 |
| リトドリン塩酸塩 | ベタメタゾンの注射剤との併用により肺水腫があらわれたとの報告がある。 | 体内の水分貯留傾向が促進される。 |
| エリスロマイシン | ベタメタゾンの作用が増強されるとの報告があるので、併用する場合には本剤の用量に注意すること。 | エリスロマイシンのCYP3A4に対する阻害作用により、ベタメタゾンの代謝が抑制される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 誘発感染症、感染症の増悪(0.1〜5%未満)
11.1.2 続発性副腎皮質機能不全、糖尿病(頻度不明)、急性副腎不全(0.1〜5%未満)
11.1.3 消化性潰瘍(0.1〜5%未満)、膵炎(頻度不明)
胃潰瘍等の消化性潰瘍があらわれることがある。[9.1.1参照]
11.1.4 精神変調(0.1〜5%未満)、うつ状態、痙攣、錯乱(頻度不明)[9.1.1参照]
11.1.5 骨粗鬆症、ミオパシー(0.1〜5%未満)、大腿骨及び上腕骨等の骨頭無菌性壊死(頻度不明)[9.1.4参照]
11.1.7 血栓症(0.1%未満)[9.1.1参照]
11.2 その他の副作用
| 5%以上又は頻度不明 | 0.1〜5%未満 | 0.1%未満 | |
| 過敏症 | 発疹、光線過敏症等 | ||
| 精神神経系 | 鎮静、神経過敏、焦燥感、多幸症、複視、頭痛、めまい、耳鳴、前庭障害、情緒不安、振戦、感覚異常、ヒステリー、神経炎、協調異常 | 不眠、眠気、頭重感 | |
| 消化器 | 口渇、胸やけ、腹部膨満感、食欲不振、便秘 | 腹痛、悪心・嘔吐、食欲亢進、下痢等 | |
| 泌尿器 | 頻尿、排尿困難、尿閉、ステロイド腎症等 | ||
| 循環器 | 低血圧、心悸亢進、頻脈、期外収縮 | ||
| 呼吸器 | 鼻及び気道の乾燥、気管分泌液の粘性化、喘鳴、鼻閉 | ||
| 血液 | 溶血性貧血、白血球増多 | 血小板減少 | |
| 肝臓 | 肝機能障害(ASTの上昇、ALTの上昇、ALPの上昇等) | ||
| 内分泌 | 月経異常、糖尿等 | ||
| 筋・骨格 | 筋肉痛、関節痛等 | ||
| 脂質・蛋白質代謝 | 満月様顔貌、野牛肩、窒素負平衡、脂肪肝等 | ||
| 体液・電解質 | 浮腫、低カリウム性アルカローシス | 血圧上昇等 | |
| 眼 | 中心性漿液性網脈絡膜症等による網膜障害、眼球突出等 | ||
| 皮膚 | 多毛、脱毛、ざ瘡、色素沈着、皮下溢血、紫斑、線条、そう痒感、発汗異常、顔面紅斑、創傷治癒障害、皮膚菲薄化・脆弱化、脂肪織炎 | ||
| その他 | 発熱、疲労感、精子数及びその運動性の増減、胸痛 | 倦怠感、体重増加 |
14. 適用上の注意
14.1 薬剤交付時の注意
<錠>
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
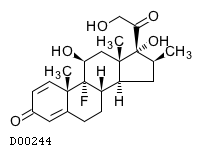
19.1. ベタメタゾン
19.2. d-クロルフェニラミンマレイン酸塩
| 一般的名称 | d-クロルフェニラミンマレイン酸塩 |
|---|---|
| 一般的名称(欧名) | d-Chlorpheniramine Maleate |
| 化学名 | (3S)-3-(4-Chlorophenyl)-N,N-dimethyl-3-pyridin-2-ylpropylamine monomaleate |
| 分子式 | C16H19ClN2・C4H4O4 |
| 分子量 | 390.86 |
| 融点 | 111〜115℃ |
| 物理化学的性状 | 白色の結晶性の粉末である。 水、メタノール又は酢酸(100)に極めて溶けやすく、N,N-ジメチルホルムアミド又はエタノール(99.5)に溶けやすい。 希塩酸に溶ける。 |
| 旋光度 | 〔α〕20D:+39.5〜+43.0°(乾燥後、0.5g、N,N-ジメチルホルムアミド、10mL、100mm) |
| 理化学知見その他 | 1.0gを新たに煮沸して冷却した水100mLに溶かした液のpHは4.0〜5.0である。 19.2 d-クロルフェニラミンマレイン酸塩 |
20. 取扱い上の注意
開封後、光を避けて保存すること。
22. 包装
<セレスタミン配合錠>
500錠[10錠(PTP)×50]
100錠[プラスチック瓶、バラ]
<セレスタミン配合シロップ>
500mL[プラスチック瓶]
23. 主要文献
- Deringer,P.M.,et al., Lancet., I, 432, (1976)
- Kanoh,T.,et al., Lancet., I, 546-547, (1977)
- 日本薬局方解説書編集委員会編, 第十八改正 日本薬局方解説書, C-5181-5188, (2021)
- 日本薬局方解説書編集委員会編, 第十八改正 日本薬局方解説書, C-1832-1838, (2021)
- 日本薬局方解説書編集委員会編, 第十八改正 日本薬局方解説書, C-1846-1849, (2021)
24. 文献請求先及び問い合わせ先
文献請求先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-816-4183
製品情報問い合わせ先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-816-4183
26. 製造販売業者等
26.1 製造販売元
高田製薬株式会社
さいたま市西区宮前町203番地1