医薬品情報
| 総称名 | ユーエフティ |
|---|---|
| 一般名 | テガフール ウラシル |
| 欧文一般名 | Tegafur Uracil |
| 製剤名 | テガフール・ウラシル配合カプセル剤、テガフール(腸溶)・ウラシル配合顆粒剤 |
| 薬効分類名 | 代謝拮抗剤 |
| 薬効分類番号 | 4229 |
| ATCコード | L01BC53 |
| KEGG DRUG |
D02131
テガフール・ウラシル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年1月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ユーエフティ配合カプセルT100 | UFT combination capsules | 大鵬薬品工業 | 4229100M2035 | 102.8円/カプセル | 劇薬, 処方箋医薬品 |
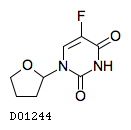
| ユーエフティE配合顆粒T100 | UFT E combination granules | 大鵬薬品工業 | 4229100D3023 | 128.6円/包 | 劇薬, 処方箋医薬品 |
| ユーエフティE配合顆粒T150 | UFT E combination granules | 大鵬薬品工業 | 4229100D4020 | 193.1円/包 | 劇薬, 処方箋医薬品 |
| ユーエフティE配合顆粒T200 | UFT E combination granules | 大鵬薬品工業 | 4229100D5026 | 240.9円/包 | 劇薬, 処方箋医薬品 |
1. 警告
<効能共通>
<テガフール・ウラシル通常療法>
<ホリナート・テガフール・ウラシル療法>
1.3 本療法は、テガフール・ウラシル配合剤の細胞毒性を増強する療法であり、本療法に関連したと考えられる死亡例が認められているので、緊急時に十分に措置できる医療施設及び癌化学療法に十分な経験を有する医師のもとで、「2.禁忌」、「9.特定の背景を有する患者に関する注意」の項を参照して適応患者の選択を慎重に行い実施すること。
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
<テガフール・ウラシル通常療法>
<ホリナート・テガフール・ウラシル療法>
5. 効能または効果に関連する注意
<ホリナート・テガフール・ウラシル療法>
術後補助療法における有効性及び安全性は確立していない。
6. 用法及び用量
ユーエフティ配合カプセルT100
<テガフール・ウラシル通常療法>
通常、1日量として、テガフール300〜600mg相当量を1日2〜3回に分割経口投与する。
子宮頸癌については通常、1日量として、テガフール600mg相当量を1日2〜3回に分割経口投与する。
他の抗悪性腫瘍剤との併用の場合は上記に準じて投与する。
子宮頸癌については通常、1日量として、テガフール600mg相当量を1日2〜3回に分割経口投与する。
他の抗悪性腫瘍剤との併用の場合は上記に準じて投与する。
| 販売名 | 1日量(通常) | |
| テガフール300〜600mg相当量 | (子宮頸癌の場合) テガフール600mg相当量 | |
| ユーエフティ配合カプセルT100 | 3〜6カプセル | 6カプセル |
<ホリナート・テガフール・ウラシル療法>
結腸・直腸癌に対して通常、1日量として、テガフール300〜600mg相当量(300mg/m2を基準)を1日3回に分けて(約8時間ごとに)、食事の前後1時間を避けて経口投与する。
ホリナートの投与量は通常、成人にはホリナートとして75mgを、1日3回に分けて(約8時間ごとに)、テガフール・ウラシル配合剤と同時に経口投与する。
以上を28日間連日経口投与し、その後7日間休薬する。これを1クールとして投与を繰り返す。
ホリナートの投与量は通常、成人にはホリナートとして75mgを、1日3回に分けて(約8時間ごとに)、テガフール・ウラシル配合剤と同時に経口投与する。
以上を28日間連日経口投与し、その後7日間休薬する。これを1クールとして投与を繰り返す。
ユーエフティE配合顆粒T100
<テガフール・ウラシル通常療法>
通常、1日量として、テガフール300〜600mg相当量を1日2〜3回に分割経口投与する。
子宮頸癌については通常、1日量として、テガフール600mg相当量を1日2〜3回に分割経口投与する。
他の抗悪性腫瘍剤との併用の場合は上記に準じて投与する。
子宮頸癌については通常、1日量として、テガフール600mg相当量を1日2〜3回に分割経口投与する。
他の抗悪性腫瘍剤との併用の場合は上記に準じて投与する。
| 販売名 | 1日量(通常) | ||
| テガフール300〜600mg相当量 | (子宮頸癌の場合) テガフール600mg相当量 | ||
| ユーエフティE配合顆粒T100 | 0.5g分包 | 1.5〜3.0g | 3.0g |
<ホリナート・テガフール・ウラシル療法>
結腸・直腸癌に対して通常、1日量として、テガフール300〜600mg相当量(300mg/m2を基準)を1日3回に分けて(約8時間ごとに)、食事の前後1時間を避けて経口投与する。
ホリナートの投与量は通常、成人にはホリナートとして75mgを、1日3回に分けて(約8時間ごとに)、テガフール・ウラシル配合剤と同時に経口投与する。
以上を28日間連日経口投与し、その後7日間休薬する。これを1クールとして投与を繰り返す。
ホリナートの投与量は通常、成人にはホリナートとして75mgを、1日3回に分けて(約8時間ごとに)、テガフール・ウラシル配合剤と同時に経口投与する。
以上を28日間連日経口投与し、その後7日間休薬する。これを1クールとして投与を繰り返す。
ユーエフティE配合顆粒T150
<テガフール・ウラシル通常療法>
通常、1日量として、テガフール300〜600mg相当量を1日2〜3回に分割経口投与する。
子宮頸癌については通常、1日量として、テガフール600mg相当量を1日2〜3回に分割経口投与する。
他の抗悪性腫瘍剤との併用の場合は上記に準じて投与する。
子宮頸癌については通常、1日量として、テガフール600mg相当量を1日2〜3回に分割経口投与する。
他の抗悪性腫瘍剤との併用の場合は上記に準じて投与する。
| 販売名 | 1日量(通常) | ||
| テガフール300〜600mg相当量 | (子宮頸癌の場合) テガフール600mg相当量 | ||
| ユーエフティE配合顆粒T150 | 0.75g分包 | 1.5〜3.0g | 3.0g |
<ホリナート・テガフール・ウラシル療法>
結腸・直腸癌に対して通常、1日量として、テガフール300〜600mg相当量(300mg/m2を基準)を1日3回に分けて(約8時間ごとに)、食事の前後1時間を避けて経口投与する。
ホリナートの投与量は通常、成人にはホリナートとして75mgを、1日3回に分けて(約8時間ごとに)、テガフール・ウラシル配合剤と同時に経口投与する。
以上を28日間連日経口投与し、その後7日間休薬する。これを1クールとして投与を繰り返す。
ホリナートの投与量は通常、成人にはホリナートとして75mgを、1日3回に分けて(約8時間ごとに)、テガフール・ウラシル配合剤と同時に経口投与する。
以上を28日間連日経口投与し、その後7日間休薬する。これを1クールとして投与を繰り返す。
ユーエフティE配合顆粒T200
<テガフール・ウラシル通常療法>
通常、1日量として、テガフール300〜600mg相当量を1日2〜3回に分割経口投与する。
子宮頸癌については通常、1日量として、テガフール600mg相当量を1日2〜3回に分割経口投与する。
他の抗悪性腫瘍剤との併用の場合は上記に準じて投与する。
子宮頸癌については通常、1日量として、テガフール600mg相当量を1日2〜3回に分割経口投与する。
他の抗悪性腫瘍剤との併用の場合は上記に準じて投与する。
| 販売名 | 1日量(通常) | ||
| テガフール300〜600mg相当量 | (子宮頸癌の場合) テガフール600mg相当量 | ||
| ユーエフティE配合顆粒T200 | 1.0g分包 | 1.5〜3.0g | 3.0g |
<ホリナート・テガフール・ウラシル療法>
結腸・直腸癌に対して通常、1日量として、テガフール300〜600mg相当量(300mg/m2を基準)を1日3回に分けて(約8時間ごとに)、食事の前後1時間を避けて経口投与する。
ホリナートの投与量は通常、成人にはホリナートとして75mgを、1日3回に分けて(約8時間ごとに)、テガフール・ウラシル配合剤と同時に経口投与する。
以上を28日間連日経口投与し、その後7日間休薬する。これを1クールとして投与を繰り返す。
ホリナートの投与量は通常、成人にはホリナートとして75mgを、1日3回に分けて(約8時間ごとに)、テガフール・ウラシル配合剤と同時に経口投与する。
以上を28日間連日経口投与し、その後7日間休薬する。これを1クールとして投与を繰り返す。
7. 用法及び用量に関連する注意
<ホリナート・テガフール・ウラシル療法>
7.1 食事の影響を受けるので、食事の前後1時間を避けて投与すること。[16.2.1参照]
7.2 1日の投与スケジュールは以下を参考とする。
| 体表面積(m2) | UFT(mg/日) | 1日の投与スケジュール(mg) | ||
| 午前 | 午後 | 夜間 | ||
| <1.17 | 300 | 100 | 100 | 100 |
| 1.17-1.49 | 400 | 200 | 100 | 100 |
| 1.50-1.83 | 500 | 200 | 200 | 100 |
| >1.83 | 600 | 200 | 200 | 200 |
8. 重要な基本的注意
<効能共通>
<テガフール・ウラシル通常療法>
<ホリナート・テガフール・ウラシル療法>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄抑制のある患者(重篤な骨髄抑制を除く)
9.1.2 感染症を合併している患者(重篤な感染症を除く)
9.1.3 心疾患又はその既往歴のある患者
症状が悪化するおそれがある。[11.1.7参照]
9.1.4 消化管潰瘍又は出血のある患者
症状が悪化するおそれがある。[11.1.12参照]
9.1.5 耐糖能異常のある患者
耐糖能異常が悪化するおそれがある1)。
9.1.6 水痘患者
致命的な全身障害があらわれるおそれがある。
9.1.7 前化学療法を受けていた患者
下痢、骨髄抑制等の副作用が増強されるおそれがある。
9.2 腎機能障害患者
副作用が強くあらわれるおそれがある。
9.3 肝機能障害患者
9.3.1 肝障害又はその既往歴のある患者
肝障害が悪化するおそれがある。
9.4 生殖能を有する者
9.4.1 小児及び生殖可能な年齢の患者に投与する必要がある場合には性腺に対する影響を考慮すること。
9.4.3 男性には、本剤投与中及び最終投与後3カ月間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。[15.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。本剤を投与された女性において奇形を有する児を出産したとの報告がある。また、動物実験で催奇形作用の報告(妊娠ラットで胎児の骨格変異、化骨遅延等が認められている)がある2)。[2.6、9.4.2参照]
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中への移行が報告されている3)。
9.7 小児等
副作用の発現に特に注意し、慎重に投与すること。小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下しているので、特に消化器障害(下痢、口内炎等)、骨髄抑制があらわれやすい。
10. 相互作用
10.1 併用禁忌
10.2 併用注意
| フェニトイン4) | フェニトイン中毒(嘔気・嘔吐、眼振、運動障害等)が発現することがある。必要に応じてフェニトインの血中濃度を測定し、フェニトインの用量調節を行い、注意して投与すること。異常が認められた場合には本剤の投与を中止するなど適切な処置を行うこと。 | テガフールによってフェニトインの代謝が抑制され、フェニトインの血中濃度が上昇する。 |
| ワルファリンカリウム | テガフールがワルファリンカリウムの作用を増強することがあるので、凝固能の変動に注意すること。 | 機序は不明である。 |
| トリフルリジン・チピラシル塩酸塩配合剤 | 重篤な骨髄抑制等の副作用が発現するおそれがある。 | 本剤との併用により、トリフルリジンのDNA取り込みが増加する可能性がある。チピラシル塩酸塩がチミジンホスホリラーゼを阻害することにより、本剤の代謝に影響を及ぼす可能性がある。 |
| 他の抗悪性腫瘍剤、放射線照射 | 血液障害、消化管障害等の副作用が増強することがあるので、患者の状態を十分に観察すること。異常が認められた場合には減量、休薬等の適切な処置を行うこと。 | 副作用が相互に増強される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制、溶血性貧血等の血液障害
11.1.3 肝硬変(頻度不明)
長期投与においてAST、ALTの明らかな上昇を伴わずに肝硬変があらわれることがあるので、プロトロンビン時間延長、アルブミン低下、コリンエステラーゼ低下、血小板減少等が認められた場合には投与を中止すること。
11.1.4 脱水症状(頻度不明)
11.1.5 重篤な腸炎
11.1.6 白質脳症等を含む精神神経障害
白質脳症(意識障害、小脳失調、認知症様症状等を主症状とする)7)(頻度不明)や意識障害(頻度不明)、失見当識(0.1%未満)、傾眠(0.1%未満)、記憶力低下(0.1%未満)、錐体外路症状(0.1%未満)、言語障害(0.1%未満)、四肢麻痺(頻度不明)、歩行障害(0.1%未満)、尿失禁(頻度不明)、知覚障害(0.1%未満)等があらわれることがある。
11.1.7 狭心症、心筋梗塞、不整脈
11.1.8 急性腎障害(0.1%未満)、ネフローゼ症候群(0.1%未満)
11.1.9 嗅覚脱失
嗅覚障害(0.1%未満)(長期投与症例に多い)があらわれ、嗅覚脱失(頻度不明)まで至ることがある。
11.1.10 間質性肺炎
間質性肺炎(0.1%未満)(初期症状:咳嗽、息切れ、呼吸困難、発熱等)があらわれることがあるので、異常が認められた場合には投与を中止し、胸部X線等の検査を行い、副腎皮質ホルモン剤の投与など適切な処置を行うこと。
11.1.11 急性膵炎(頻度不明)
腹痛、血清アミラーゼ値の上昇等が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.12 重篤な口内炎(頻度不明)、消化管潰瘍(0.1%)、消化管出血(0.1%未満)[9.1.4参照]
11.1.13 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 血液 | 赤血球減少、血色素減少、ヘマトクリット値減少、好中球減少、好酸球増多、リンパ球減少、好塩基球増多、平均赤血球容積(MCV)増加 | ||
| 肝臓注1) | 肝機能障害(AST、ALTの上昇等)、黄疸 | 脂肪肝、Al-P上昇 | 総ビリルビン上昇 |
| 腎臓 | 腎機能障害(BUN、クレアチニンの上昇等) | 蛋白尿、血尿 | |
| 消化器 | 食欲不振、悪心、嘔吐、下痢、口内炎、腹痛、味覚異常、心窩部痛、胸やけ | 便秘、腹部膨満感、舌炎、口角炎、口渇、胃炎、嚥下困難、腹鳴 | 胃不快感、胃重感、口唇炎 |
| 精神神経系 | 倦怠感、眩暈、しびれ | 頭痛、耳鳴 | 興奮、頭重感、末梢性ニューロパチー |
| 皮膚注2) | 色素沈着、爪の異常、脱毛、浮腫 | び爛・皮膚炎、角化、紅潮、光線過敏症10)、水疱 | DLE様皮疹11)12)、皮膚の乾燥、手足症候群 |
| 過敏症 | 発疹、そう痒 | 蕁麻疹 | 発赤 |
| 循環器 | 動悸、胸痛、胸内苦悶感、心電図異常(ST上昇等) | ||
| その他 | LDH上昇、発熱 | 関節痛、糖尿、血糖値上昇、灼熱感、結膜充血、咳・痰、血清尿酸値上昇、女性型乳房、筋肉痛 | 血痰、高トリグリセリド血症、高コレステロール血症、無月経、CK上昇、総蛋白低下、血清ナトリウム低下、血清カルシウム上昇、血清カルシウム低下、血清カリウム上昇、血清カリウム低下、血清クロール上昇、血清クロール低下 |
14. 適用上の注意
14.1 薬剤調製時の注意
<顆粒剤>
原則としてヒートシール包装のまま調剤すること。ヒートシール包装を開封して調剤すると、2種類(テガフールとウラシル)顆粒が不均一となり、配合比率が変化することがあるので注意すること。
14.2 薬剤交付時の注意
<カプセル剤>
14.2.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
<顆粒剤>
14.2.2 テガフール顆粒が腸溶性なので、かまずに服用するように注意すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤を投与した患者に、急性白血病(前白血病相を伴う場合もある)、骨髄異形成症候群(MDS)が発生したとの報告がある。
15.1.2 フルオロウラシルの異化代謝酵素であるジヒドロピリミジンデヒドロゲナーゼ(DPD)欠損等の患者がごくまれに存在し、このような患者にフルオロウラシル系薬剤を投与した場合、投与初期に重篤な副作用(口内炎、下痢、血液障害、神経障害等)が発現するとの報告がある。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
癌患者12例にユーエフティ(テガフール300mg相当量)を単回経口投与し、血中テガフール、5-FU及びウラシル濃度を測定した結果、テガフール濃度は投与後2時間で最高値13.7±1.1μg/mLを示し、以後漸次減少し、24時間後では3.6±0.8μg/mLであった。5-FU及びウラシル濃度はいずれも投与後30分にそれぞれ0.21±0.094μg/mL、3.0±1.8μg/mLの最高値を示し、以後低下して5-FUは3時間後で0.05±0.019μg/mL、ウラシルは6時間後で0.30±0.23μg/mLの値を示した20)。
一方、ユーエフティ投与後における5-FUの血中、腫瘍周辺正常組織及び腫瘍内濃度を比較すると、腫瘍内濃度が高値を示した21)22)23)24)25)26)27)。
一方、ユーエフティ投与後における5-FUの血中、腫瘍周辺正常組織及び腫瘍内濃度を比較すると、腫瘍内濃度が高値を示した21)22)23)24)25)26)27)。
16.2 吸収
<ホリナート・テガフール・ウラシル療法>
16.4 代謝
テガフールから5-FUへの代謝に関与するヒト肝チトクロームP-450分子種としてCYP2A6が主であるとの報告がある29)(in vitro)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<テガフール・ウラシル通常療法>
17.1.1 国内臨床試験
ユーエフティ(テガフール300〜600mg相当量)、1日2〜3回分割経口投与による臨床成績を集計した結果、効果判定可能例数は699例であり、奏効率は23.3%(163/699例)であった15)16)17)20)25)30)31)32)33)34)35)36)37)38)39)。
癌種別奏効率は次のとおりであった。
癌種別奏効率は次のとおりであった。
| 癌種 | 奏効率 |
| 頭頸部癌 | 31.0%(22/71) |
| 胃癌 | 25.4%(58/228) |
| 結腸・直腸癌 | 18.3%(15/82) |
| 肝臓癌 | 16.7%(6/36) |
| 胆のう・胆管癌 | 18.8%(3/16) |
| 膵臓癌 | 17.4%(4/23) |
| 肺癌 | 8.7%(4/46) |
| 乳癌 | 30.2%(29/96) |
| 膀胱癌 | 30.6%(11/36) |
| 前立腺癌 | 14.7%(5/34) |
| 子宮頸癌 | 19.4%(6/31) |
| 合計 | 23.3%(163/699) |
<非小細胞肺癌>
17.1.2 術後補助化学療法の大規模比較試験
I期の原発性肺腺癌(完全切除例)を対象とし、ユーエフティ(テガフール250mg/m2相当量)の2年間経口投与による術後補助化学療法群と手術単独の経過観察群を比較(評価対象症例:それぞれ491例及び488例、追跡期間の中央値:それぞれ72ヵ月及び73ヵ月)した結果、生存期間のハザード比は0.71(95%信頼区間0.52-0.98、層別ログランク検定P=0.04)で、特にpT2(ユーエフティ群129例、経過観察群134例)において、生存期間のハザード比0.48(95%信頼区間0.29-0.81、ログランク検定P=0.005)と、ユーエフティは死亡リスクを低下させた40)。
<ホリナート・テガフール・ウラシル療法>
本療法は国内外のブリッジング試験(国内:44例、外国:45例)及び外国臨床試験で検討されたものである。
17.1.3 国内第II相試験(ブリッジング試験)
結腸・直腸癌患者44例を対象に本療法※1を実施した結果、奏効率は36.4%(16/44例)であった41)。
副作用評価可能症例数は44例であり、副作用発現率は95.5%(42/44例)であった。主な副作用は次のとおりであった。
副作用評価可能症例数は44例であり、副作用発現率は95.5%(42/44例)であった。主な副作用は次のとおりであった。
| 副作用 | 発現率 | 副作用 | 発現率 |
| 下痢 (グレード3)注1) | 38.6% (9.1%) | 口内炎 (グレード3) | 34.1% (4.5%) |
| 食欲不振 | 31.8% | 悪心 | 29.5% |
| 倦怠感 | 29.5% | 色素沈着 | 18.2% |
| 白血球減少 | 25.0% | 好中球減少 | 27.3% |
| 赤血球減少 (グレード3) | 50.0% (4.5%) | ヘマトクリット値減少 | 40.9% |
| 血小板減少 (グレード3) | 4.5% (2.3%) | AST上昇 (グレード3以上) | 29.5% (2.3%) |
| ALT上昇 (グレード3以上) | 36.4% (2.3%) | 総ビリルビン上昇 (グレード3) | 47.7% (2.3%) |
※1:LV:75mg/日とUFT:300mg/m2/日(テガフール相当量)を併用連日28日間経口投与し、その後7日間休薬を1クールとする
17.1.4 海外第II相試験(ブリッジング試験)
結腸・直腸癌患者45例を対象に本療法※1を実施した結果、奏効率は34.1%(15/44例)であった41)。
副作用評価可能症例数は45例であり、副作用発現率は100%(45/45例)であった。主な副作用は、下痢68.9%(31/45例)、倦怠感66.7%(30/45例)、悪心64.4%(29/45例)、嘔吐31.1%(14/45例)、腹痛26.7%(12/45例)であった。このうちグレード3以上の副作用は、下痢22.2%(10/45例)、腹痛6.7%(3/45例)、悪心及び嘔吐4.4%(2/45例)であった。
副作用評価可能症例数は45例であり、副作用発現率は100%(45/45例)であった。主な副作用は、下痢68.9%(31/45例)、倦怠感66.7%(30/45例)、悪心64.4%(29/45例)、嘔吐31.1%(14/45例)、腹痛26.7%(12/45例)であった。このうちグレード3以上の副作用は、下痢22.2%(10/45例)、腹痛6.7%(3/45例)、悪心及び嘔吐4.4%(2/45例)であった。
※1:LV:75mg/日とUFT:300mg/m2/日(テガフール相当量)を併用連日28日間経口投与し、その後7日間休薬を1クールとする
17.1.5 海外第III相試験
結腸・直腸癌を対象にホリナート・フルオロウラシル療法(ホリナート注射剤とフルオロウラシル注射剤の併用療法、5-FU/LV)と本療法(ホリナート・テガフール・ウラシル療法、UFT/LV)との生存期間の同等性検証を主目的とした非盲検デザインの比較試験を実施した。結果は以下のとおりで、生存期間はUFT/LVと5-FU/LVで同等であった42)。
| 生存期間 | 病勢進行までの期間 | |||
| UFT/LV※1 | 5-FU/LV※2 | UFT/LV | 5-FU/LV | |
| 例数 | 409 | 407 | 409 | 407 |
| 中央値(月)[95%信頼区間] | 12.4[11.2,13.6] | 13.4[11.6,15.4] | 3.5[3.0,4.4] | 3.8[3.6,5.0] |
| ハザード比※3[95%信頼区間] | 0.964[0.826,1.125]※4 | 0.823[0.708,0.958]※5 | ||
| 層併合ログランク検定※6 | p=0.630 | p=0.011 | ||
生存曲線
無増悪生存曲線
17.1.6 海外第III相試験
結腸・直腸癌を対象にホリナート・フルオロウラシル療法(ホリナート注射剤とフルオロウラシル注射剤の併用療法、5-FU/LV)と本療法(ホリナート・テガフール・ウラシル療法、UFT/LV)との病勢進行までの期間の優越性検証を主目的とした非盲検デザインの比較試験を実施した。結果は以下のとおりで、病勢進行までの期間はUFT/LVと5-FU/LVで有意差は認められなかった43)。
| 生存期間 | 病勢進行までの期間 | |||
| UFT/LV※1 | 5-FU/LV※2 | UFT/LV | 5-FU/LV | |
| 例数 | 190 | 190 | 190 | 190 |
| 中央値(月)[95%信頼区間] | 12.2[10.4,13.8] | 10.3[8.2,13.0] | 3.4[2.6,3.8] | 3.3[2.5,3.7] |
| ハザード比※3[95%信頼区間] | 1.144[0.920,1.424] | 0.941[0.753,1.175] | ||
| 層併合ログランク検定※4 | p=0.227 | p=0.591 | ||
生存曲線
無増悪生存曲線
18. 薬効薬理
18.1 作用機序
ユーエフティの抗腫瘍効果は体内でテガフールから徐々に変換される5-FUに基づいている。
5-FUの作用機序は活性代謝物であるFdUMPがdUMPと拮抗し、thymidylate synthaseを抑制することによるDNAの合成阻害と、FUTPがRNAに取込まれることによるRNAの機能障害に起因するものと考えられている(in vitro)。
ユーエフティに含有されるウラシルによるテガフールの抗腫瘍効果の増強はリン酸化及び分解酵素に対する5-FUとウラシルの酵素親和性の差により5-FUの分解が抑制されることに起因し、特に腫瘍内において5-FUとそのリン酸化活性代謝物が高濃度に維持されることによるものと考えられている44)45)46)47)48)49)50)51)(in vitro)。
5-FUの作用機序は活性代謝物であるFdUMPがdUMPと拮抗し、thymidylate synthaseを抑制することによるDNAの合成阻害と、FUTPがRNAに取込まれることによるRNAの機能障害に起因するものと考えられている(in vitro)。
ユーエフティに含有されるウラシルによるテガフールの抗腫瘍効果の増強はリン酸化及び分解酵素に対する5-FUとウラシルの酵素親和性の差により5-FUの分解が抑制されることに起因し、特に腫瘍内において5-FUとそのリン酸化活性代謝物が高濃度に維持されることによるものと考えられている44)45)46)47)48)49)50)51)(in vitro)。
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
19.1. テガフール
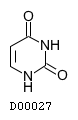
19.2. ウラシル
22. 包装
<ユーエフティ配合カプセルT100>
PTP包装
60カプセル(10カプセル×6)、120カプセル(10カプセル×12)、840カプセル(21カプセル×40)
バラ包装
120カプセル(プラスチックボトル)
<ユーエフティE配合顆粒T100>
ヒートシール
0.5g×105包
<ユーエフティE配合顆粒T150>
ヒートシール
0.75g×105包
<ユーエフティE配合顆粒T200>
ヒートシール
1.0g×105包
23. 主要文献
- 高橋達雄 他, 外科, 45 (9), 955-959, (1983)
- 淺野間光治 他, 応用薬理, 22 (1), 85-107, (1981)
- 川口安郎 他, 応用薬理, 21 (3), 389-403, (1981)
- 原富英 他, 九州神経精神医学, 38 (1), 36-41, (1992)
- 大元謙治 他, 臨牀消化器内科, 10 (5), 705-709, (1995)
- 向井正哉 他, 日本癌治療学会誌, 28 (6), 942-948, (1993)
- 長沼睦雄 他, 臨床神経学, 28 (9), 1058-1064, (1988) »PubMed
- 河田典子 他, 心臓, 22 (12), 1401-1405, (1990) »DOI
- 中川義久 他, 呼吸と循環, 36 (11), 1265-1268, (1988)
- Horio,T.et al., Arch.Dermatol., 114 (10), 1498-1500, (1978) »PubMed
- 田中信 他, 皮膚科の臨床, 25 (4), 383-386, (1983)
- 荒瀬誠治 他, 皮膚科の臨床, 29 (10), 951-957, (1987)
- 野口勇 他, ユーエフティ・ユーエフティ細粒の使用成績調査−副作用に関する集計−,社内資料,研究報告書No.52
- 広岡禎 他, 新薬と臨牀, 46 (6), 733-759, (1997)
- 田口鐵男 他, 癌と化学療法, 17 (7), 1295-1301, (1990) »PubMed
- 高橋秀夫 他, 癌と化学療法, 17 (10), 2043-2049, (1990) »PubMed
- 菊地金男 他, 癌と化学療法, 17 (11), 2183-2190, (1990) »PubMed
- 大山勝 他, 癌と化学療法, 17 (6), 1211-1216, (1990) »PubMed
- 都留紀子 他, 皮膚科の臨床, 19 (13), 1157-1166, (1977)
- 中島修 他, 癌と化学療法, 7 (9), 1558-1568, (1980)
- 木村禧代二 他, 癌と化学療法, 6 (2), 237-243, (1979)
- Kimura,K.et al., Gastroenterol.Jpn., 15 (4), 324-329, (1980) »PubMed
- 前田迪郎 他, 医学のあゆみ, 116 (2), 97-100, (1981)
- 秋谷清 他, 日本産科婦人科学会雑誌, 33 (9), 1328-1335, (1981)
- 朝日俊彦 他, 癌と化学療法, 9 (3), 503-507, (1982) »PubMed
- 末益公人 他, 癌と化学療法, 9 (4), 667-671, (1982) »PubMed
- 辻本俊弥 他, 癌と化学療法, 10 (1), 78-83, (1983)
- Damle,B.et al., Clin.Cancer.Res., 7 (3), 517-523, (2001) »PubMed
- Ikeda,K.et al., Clin.Cancer.Res., 6 (11), 4409-4415, (2000) »PubMed
- 太田和雄 他, 癌と化学療法, 14 (9), 2749-2757, (1987) »PubMed
- 志田圭三 他, 癌と化学療法, 11 (6), 1307-1314, (1984) »PubMed
- 野代忠宏 他, 基礎と臨床, 18 (7), 3433-3438, (1984)
- 波多江正紀 他, 癌と化学療法, 11 (11), 2386-2392, (1984) »PubMed
- 犬山征夫 他, 癌と化学療法, 12 (3I), 479-484, (1985)
- 野田起一郎 他, 癌と化学療法, 12 (4), 900-906, (1985) »PubMed
- 内藤克輔 他, 癌と化学療法, 12 (7), 1440-1444, (1985) »PubMed
- 向井洋 他, 臨牀と研究, 62 (11), 3717-3721, (1985)
- 田口鐵男 他, 癌と化学療法, 14 (10), 2936-2943, (1987) »PubMed
- 二ッ木浩一 他, 癌と化学療法, 14 (5I), 1274-1280, (1987)
- Kato,H.et al., N.Engl.J.Med., 350 (17), 1713-1721, (2004) »PubMed
- Shirao,K.et al., J.Clin.Oncol., 22 (17), 3466-3474, (2004) »PubMed
- Douillard,J.-Y.et al., J.Clin.Oncol., 20 (17), 3605-3616, (2002) »PubMed
- Carmichael,J.et al., J.Clin.Oncol., 20 (17), 3617-3627, (2002) »PubMed
- Heidelberger,C.et al., Cancer Res., 20 (6), 903-909, (1960)
- Hartmann,K-U.et al., J.Biol.Chem., 236 (11), 3006-3013, (1961)
- Heidelberger,C.et al., Cancer Res., 23 (8I), 1226-1243, (1963)
- Wilkinson,D.S.et al., J.Biol.Chem., 248 (1), 63-68, (1973) »PubMed
- Wilkinson,D.S.et al., Cancer Res., 35 (11), 3014-3020, (1975)
- 中村秀次 他, 癌と化学療法, 11 (5), 1049-1055, (1984) »PubMed
- Ikenaka,K.et al., Gann., 70 (3), 353-359, (1979) »PubMed
- Unemi,N.et al., Chemotherapy., 29 (2), 176-184, (1981) »DOI
- Fujii,S.et al., Gann., 69 (6), 763-772, (1978) »PubMed
- Fujii,S.et al., Gann., 70 (2), 209-214, (1979) »PubMed
- 田口鐵男 他, 癌と化学療法, 5 (6), 1161-1165, (1978)
- Unemi,N.et al., Chemotherapy., 29 (2), 164-175, (1981) »DOI
- 大山公三 他, 癌と化学療法, 9 (12), 2168-2174, (1982) »PubMed
- 藤田昌英, 癌と化学療法, 7 (6), 949-956, (1980)
24. 文献請求先及び問い合わせ先
文献請求先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
製品情報問い合わせ先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
26. 製造販売業者等
26.1 製造販売元
大鵬薬品工業株式会社
東京都千代田区神田錦町1-27