医薬品情報
| 総称名 | アンジュ |
|---|---|
| 一般名 | レボノルゲストレル エチニルエストラジオール |
| 欧文一般名 | Levonorgestrel Ethinylestradiol |
| 製剤名 | レボノルゲストレル・エチニルエストラジオール錠 |
| 薬効分類名 | 経口避妊剤 |
| 薬効分類番号 | 2549 |
| ATCコード | G03AA07 G03AB03 |
| KEGG DRUG |
D04482
エチニルエストラジオール・レボノルゲストレル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年6月 改訂(第2版)
経口避妊剤は、HIV感染(エイズ)及び他の性感染症(例えば梅毒、性器ヘルペス、淋病、クラミジア感染症、尖圭コンジローマ、腟トリコモナス症、B型肝炎等)を防止するものではないこと、これらの感染防止には、コンドームの使用が有効であることを服用者に十分説明すること。
なお、必要に応じ、性感染症検査の実施を考慮すること。
なお、必要に応じ、性感染症検査の実施を考慮すること。
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アンジュ21錠 | ANGE21 TABLETS | あすか製薬 | 254910BF3058 | 処方箋医薬品 | |
| アンジュ28錠 | ANGE28 TABLETS | あすか製薬 | 254910BF4054 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏性素因のある女性
2.4 血栓性静脈炎、肺塞栓症、脳血管障害、冠動脈疾患又はその既往歴のある患者[血液凝固能が亢進され、これらの症状が増悪することがある。][11.1.1参照]
2.6 前兆(閃輝暗点、星型閃光等)を伴う片頭痛の患者[前兆を伴う片頭痛の患者は前兆を伴わない患者に比べ脳血管障害(脳卒中等)が発生しやすくなるとの報告がある。][11.1.1参照]
2.7 肺高血圧症又は心房細動を合併する心臓弁膜症の患者、亜急性細菌性心内膜炎の既往歴のある心臓弁膜症の患者[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。][9.1.9、11.1.1参照]
2.8 血管病変を伴う糖尿病患者(糖尿病性腎症、糖尿病性網膜症等)[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。][11.1.1参照]
2.9 血栓性素因のある女性[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。][11.1.1参照]
2.10 抗リン脂質抗体症候群の患者[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。][11.1.1参照]
2.12 重篤な肝障害のある患者[9.3.1参照]
2.13 肝腫瘍のある患者[症状が増悪することがある。]
2.14 脂質代謝異常のある患者[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。また、脂質代謝に影響を及ぼす可能性があるため、症状が増悪することがある。][11.1.1参照]
2.16 耳硬化症の患者[症状が増悪することがある。]
2.17 妊娠中に黄疸、持続性そう痒症又は妊娠ヘルペスの既往歴のある患者[症状が再発するおそれがある。]
2.19 授乳婦[9.6参照]
2.20 骨成長が終了していない可能性がある女性[骨端の早期閉鎖を来すおそれがある。]
4. 効能または効果
避妊
5. 効能または効果に関連する注意
経口避妊剤使用開始1年間ののみ忘れを含めた一般的使用における失敗率は9%との報告がある。[17.3参照]
6. 用法及び用量
<アンジュ21錠>
1周期目は1日1錠を毎日一定の時刻に赤褐色錠から開始し、指定された順番に従い21日間連続経口投与し、7日間休薬する。
2周期目は、1周期服用開始29日目より1周期目と同様に赤褐色錠から1日1錠を21日間連続投与し、7日間休薬する。
3周期目以降は2周期目と同様に投与する。
<アンジュ28錠>
1周期目は1日1錠を毎日一定の時刻に赤褐色錠から開始し、指定された順番に従い28日間連続経口投与する。
2周期目は、1周期服用開始29日目より1周期目と同様に赤褐色錠から1日1錠を28日間連続投与し、3周期目以降は2周期目と同様に投与する。
7. 用法及び用量に関連する注意
7.1 毎日一定の時刻に服用させること。
7.2 服用開始日
経口避妊剤を初めて服用させる場合、月経第1日目から服用を開始させる。服用開始日が月経第1日目から遅れた場合、のみはじめの最初の1週間は他の避妊法を併用させること。
7.3 本剤の投与にあたってはのみ忘れ等がないよう服用方法を十分指導すること。万一のみ忘れがあった場合(28錠製剤の赤色錠を除く)、翌日までに気づいたならば直ちにのみ忘れた錠剤を服用し、その日の錠剤も通常どおりに服用させる。
2日以上連続してのみ忘れがあった場合は服用を中止させ、次の月経を待ち投与を再開させること。なお、のみ忘れにより妊娠する可能性が高くなるので、その周期は他の避妊法を使用させること。
2日以上連続してのみ忘れがあった場合は服用を中止させ、次の月経を待ち投与を再開させること。なお、のみ忘れにより妊娠する可能性が高くなるので、その周期は他の避妊法を使用させること。
7.4 他の経口避妊剤から本剤に切り替える場合
7.4.1 21錠タイプの経口避妊剤から切り替える場合
前に服用していた薬剤をすべて服用し7日間の休薬の後、続けて本剤の服用を開始させる。服用開始が遅れた場合、妊娠の可能性がある。
7.4.2 28錠タイプの経口避妊剤から切り替える場合
前に服用していた薬剤をすべて服用後、続けて本剤の服用を開始させる。服用開始が遅れた場合、妊娠の可能性がある。
8. 重要な基本的注意
8.1 本剤の服用により、年齢、喫煙、肥満、家族歴等のリスク因子の有無にかかわらず血栓症があらわれることがあるので、次のような症状があらわれた場合は直ちに投与を中止し、適切な処置を行うこと。
緊急対応を要する血栓症の主な症状
下肢の急激な疼痛・腫脹、突然の息切れ、胸痛、激しい頭痛、四肢の脱力・麻痺、構語障害、急性視力障害等
本剤服用者に対しても、このような症状があらわれた場合は、直ちに服用を中止し、救急医療機関を受診するよう説明すること。[11.1.1参照]
8.2 本剤の服用中に、血栓症が疑われる症状があらわれた場合は、投与を中止するなど適切な処置を行うこと。[11.1.1参照]
血栓症が疑われる症状
下肢の疼痛・腫脹・しびれ・発赤・熱感、頭痛、嘔気・嘔吐等
8.3 血栓症のリスクが高まる状態(体を動かせない状態、顕著な血圧上昇、脱水等)が認められる場合は、投与を中止するなど適切な処置を行うこと。[11.1.1参照]
8.4 本剤服用者には、投与開始時及び継続時に以下について説明すること。[11.1.1参照]
・血栓症は生命に関わる経過をたどることがあること。
・血栓症が疑われる症状があらわれた場合や、血栓症のリスクが高まる状態になった場合は、症状・状態が軽度であっても直ちに服用を中止し医師等に相談すること。
・血栓症を疑って他の医療機関を受診する際は、本剤の使用を医師に告知し、本剤による血栓症を念頭においた診察を受けられるようにすること。
8.7 本剤の投与にあたっては服用者の病歴調査及び検診が必要である。この検診には、血圧測定、乳房・腹部の検査及び臨床検査が含まれる。また、投与中は6カ月毎の検診を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 40歳以上の女性(ただし、1日15本以上の喫煙者には投与しないこと)
9.1.2 子宮筋腫のある患者
子宮筋腫の発育を促進するおそれがある。[8.8参照]
9.1.3 乳癌の既往歴のある女性
乳癌が再発するおそれがある。[8.9参照]
9.1.4 乳癌の家族歴又は乳房に結節のある女性
定期的に乳房検診を行うなど慎重に投与すること。エストロゲン投与と乳癌発生との因果関係についてその関連性を示唆する報告もある。[8.9参照]
9.1.5 喫煙者(ただし、35歳以上で1日15本以上の喫煙者には投与しないこと)
9.1.6 肥満の女性
血栓症等の心血管系の障害が発生しやすくなるとの報告がある。[11.1.1参照]
9.1.7 血栓症の家族歴を持つ女性
血栓症等の心血管系の障害が発生しやすくなるとの報告がある。[11.1.1参照]
9.1.8 前兆を伴わない片頭痛の患者
脳血管障害(脳卒中等)が発生しやすくなるとの報告がある。[11.1.1参照]
9.1.9 心臓弁膜症の患者(ただし、肺高血圧症又は心房細動を合併する心臓弁膜症の患者、亜急性細菌性心内膜炎の既往歴のある心臓弁膜症の患者には投与しないこと)
9.1.10 軽度の高血圧(妊娠中の高血圧の既往も含む)のある患者
9.1.11 耐糖能の低下している女性(糖尿病患者及び耐糖能異常の女性)
十分コントロールを行いながら投与すること。耐糖能が低下することがある。
9.1.12 ポルフィリン症の患者
症状が増悪することがある。
9.1.13 心疾患又はその既往歴のある患者
ナトリウム又は体液の貯留により症状が増悪することがある。
9.1.14 てんかん患者
症状が増悪することがある。
9.1.15 テタニーのある患者
症状が増悪することがある。
9.2 腎機能障害患者
9.2.1 腎疾患又はその既往歴のある患者
ナトリウム又は体液の貯留により症状が増悪することがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。[2.12参照]
9.3.2 肝障害のある患者(重篤な肝障害のある患者を除く)
代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。
9.4 生殖能を有する者
9.4.2 服用中に激しい下痢、嘔吐が続いた場合には本剤の吸収不良を来すことがあり、その場合には妊娠する可能性が高くなるので、その周期は他の避妊法を併用させること。
9.4.4 本剤の服用を中止して妊娠を希望する場合には、月経周期が回復するまで避妊させることが望ましい。
9.5 妊婦
9.5.2 卵胞ホルモン剤を妊娠動物(マウス)に投与した場合、児の成長後腟上皮及び子宮内膜の悪性変性を示唆する結果が報告されている。また、新生児(マウス)に投与した場合、児の成長後腟上皮の悪性変性を認めたとの報告がある。
9.6 授乳婦
投与しないこと。他の避妊法をすすめるなど適切な指導をすること。母乳の量的質的低下が起こることがある。また、母乳中への移行、児において黄疸、乳房腫大が報告されている。[2.19参照]
10. 相互作用
10.2 併用注意
| 副腎皮質ホルモン プレドニゾロン等 三環系抗うつ剤 イミプラミン等 セレギリン塩酸塩 シクロスポリン オメプラゾール | これらの薬剤の作用が増強するおそれがある。 | 本剤はこれらの薬剤の代謝を抑制すると考えられる。 |
| テオフィリン チザニジン塩酸塩 | これらの薬剤の血中濃度が上昇するおそれがある。 | 本剤がこれらの薬剤の代謝酵素(CYP1A2)を阻害すると考えられる。 |
| リファンピシン バルビツール酸系製剤 フェノバルビタール等 ヒダントイン系製剤 フェニトインナトリウム等 カルバマゼピン ボセンタン モダフィニル トピラマート | 本剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがある。 | これらの薬剤は薬物代謝酵素を誘導し、本剤の代謝を促進すると考えられる。 |
| テトラサイクリン系抗生物質 テトラサイクリン等 ペニシリン系抗生物質 アンピシリン水和物等 | 本剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがある。 | これらの薬剤は腸内細菌叢を変化させ、本剤の腸肝循環による再吸収を抑制すると考えられる。 |
| テルビナフィン塩酸塩 | 黄体ホルモン・卵胞ホルモン配合剤との併用で、月経異常があらわれたとの報告がある。 | 機序不明 |
| Gn-RH誘導体 ブセレリン酢酸塩等 | これらの薬剤の作用を減弱するおそれがある。 | これらの薬剤は性ホルモンの分泌を低下することにより薬効を示すため、性ホルモンである本剤の投与によってこれらの薬剤の効果を減弱する可能性が考えられる。 |
| 血糖降下剤 インスリン製剤、 スルフォニル尿素系製剤、 スルフォンアミド系製剤、 ビグアナイド系製剤等 | 血糖降下剤の作用が減弱するおそれがある。血糖値その他患者の状態を十分観察し、血糖降下剤の用量を調節するなど注意する。 | 本剤は耐糖能を低下させ、血糖降下剤の作用を減弱させると考えられる。 |
| ラモトリギン モルヒネ サリチル酸 | これらの薬剤の血中濃度が低下するおそれがある。 | 本剤はこれらの薬剤のグルクロン酸抱合を促進すると考えられる。 |
| HIVプロテアーゼ阻害剤 ネルフィナビルメシル酸塩、 リトナビル、 ダルナビル、 ホスアンプレナビル(リトナビル併用時)、 ロピナビル・リトナビル配合剤等 非ヌクレオシド系逆転写酵素阻害剤 ネビラピン | 本剤の作用が減弱するおそれがある。 | エチニルエストラジオールのAUCが減少する。 |
| HIVプロテアーゼ阻害剤 アタザナビル | 本剤の血中濃度が上昇するおそれがある。 | アタザナビルは本剤の代謝酵素(CYP3A4)を阻害すると考えられる。 |
| 非ヌクレオシド系逆転写酵素阻害剤 エトラビリン | 本剤の血中濃度が上昇するおそれがある。 | エトラビリンは本剤の代謝酵素(CYP2C9)を阻害すると考えられる。 |
| フルコナゾール | 本剤の血中濃度が上昇するおそれがある。 | フルコナゾールは本剤の代謝酵素(CYP3A4)を阻害すると考えられる。 |
| ボリコナゾール | 本剤の血中濃度が上昇するおそれがある。 ボリコナゾールの血中濃度が上昇するおそれがある。 | ボリコナゾールは本剤の代謝酵素(CYP3A4)を阻害すると考えられる。 本剤がボリコナゾールの代謝酵素(CYP2C19)を阻害すると考えられる。 |
| アセトアミノフェン | 本剤の血中濃度が上昇するおそれがある。 アセトアミノフェンの血中濃度が低下するおそれがある。 | アセトアミノフェンはエチニルエストラジオールの硫酸抱合を阻害すると考えられる。 本剤が肝におけるアセトアミノフェンのグルクロン酸抱合を促進すると考えられる。 |
| セイヨウオトギリソウ(St. John’s Wort、セント・ジョーンズ・ワート)含有食品 | 本剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | この食品は薬物代謝酵素を誘導し、本剤の代謝を促進すると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 血栓症(四肢、肺、心、脳、網膜等)(0.1%未満)
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹 | ||
| 眼 | 網膜血流障害による視力障害 | ||
| 肝臓 | 肝機能異常 | 黄疸等 | |
| 電解質代謝 | 浮腫、体重増加 | ||
| 子宮 | 不正性器出血(破綻出血、点状出血)、白帯下、下腹部痛 | 経血量変化、カンジダ腟炎 | |
| 乳房 | 乳汁分泌、乳房痛、乳房緊満感、乳房萎縮、乳房腫大 | ||
| 循環器 | 血圧上昇、動悸 | ||
| 消化器 | 悪心、嘔吐 | 下痢、食欲不振、胃痛、便秘 | 口渇、口内炎、腹痛、食欲亢進 |
| 精神神経系 | 頭痛 | 眠気、神経過敏、めまい | 抑うつ |
| 皮膚 | ざ瘡 | 色素沈着注) | |
| その他 | 肩こり、腰痛、倦怠感 | 冷感、しびれ、代償性鼻出血、熱感、総コレステロール上昇、トリグリセリド上昇 |
12. 臨床検査結果に及ぼす影響
含有するエチニルエストラジオールの作用による血清蛋白(コルチコイド結合性グロブリン、サイロキシン結合性グロブリン等)の増加により、総コルチゾール、総T3、総T4の上昇がみられることがある。また、これらの遊離型は変化しないとされている。これら検査値の判定に際しては注意すること。
14. 適用上の注意
14.1 薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 外国の疫学調査の結果、静脈血栓症のリスクは、経口避妊剤を服用している女性は服用していない女性に比し、3.25〜4.0倍高くなるとの報告がある。また、静脈血栓症のリスクは経口避妊剤服用開始の最初の1年間において最も高くなるとの報告がある。さらに、外国での大規模市販後調査の結果、初めて経口避妊剤の服用を開始した時だけでなく、4週間以上の中断後に服用を再開した時又は4週間以上の中断後に別の経口避妊剤へ切り替えた時にも静脈血栓症のリスクが上昇し、そのリスクは服用開始後3カ月間が特に高いとの報告がある。
15.1.2 外国での疫学調査の結果、経口避妊剤の服用により乳癌及び子宮頸癌になる可能性が高くなるとの報告がある。
15.1.3 外国で、経口避妊剤を2年以上服用した場合、良性肝腫瘍が10万人当たり3.4人発生するとの報告がある。また、腫瘍の破裂により腹腔内出血を起こす可能性がある。一方、悪性肝腫瘍(肝癌)の発生率は極めて低く、100万人当たり1人に満たない。
15.1.4 外国で、経口避妊剤の服用により全身性エリテマトーデス(SLE)の悪化、アナフィラキシー、溶血性尿毒症症候群(HUS)があらわれたとの報告がある。
15.1.5 外国で、経口避妊剤の服用による角膜厚の変化等によりコンタクトレンズがうまく調整されないため、視力・視野の変化、装用時の不快感等がみられたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人女性に本剤を単回投与したとき、血漿中レボノルゲストレル、エチニルエストラジオールは速やかに吸収され各用量とも1〜1.5時間で最高血中濃度に達し、以後2相性の消失パターンを示し減少した。血漿中からの最終相消失半減期はレボノルゲストレルで10〜26時間、エチニルエストラジオールで4〜8時間であった。レボノルゲストレル/エチニルエストラジオールの配合比率にかかわらず、Cmax、AUCともほぼ用量依存性を示した。
| 錠剤 | 組成 | Tmax | Cmax | T1/2 | AUC0-∞ | |
| 赤褐色錠 | LNG | 0.050mg | 1.0±0.4hr | 1.5±0.9ng/mL | 9.8±6.4hr | 10.7±9.3ng・hr/mL |
| EE | 0.030mg | 1.4±0.5hr | 91±48pg/mL | 7.6±4.1hr | 616±159pg・hr/mL | |
| 白色錠 | LNG | 0.075mg | 1.3±0.4hr | 1.6±0.6ng/mL | 26.3±22.1hr | 20.1±15.3ng・hr/mL |
| EE | 0.040mg | 1.5±0.3hr | 104±33pg/mL | 6.2±2.9hr | 633±63pg・hr/mL | |
| 黄色錠 | LNG | 0.125mg | 1.1±0.4hr | 3.0±1.0ng/mL | 18.8±3.2hr | 30.1±14.5ng・hr/mL |
| EE | 0.030mg | 1.3±0.4hr | 77±23pg/mL | 3.7±1.7hr | 324±45pg・hr/mL | |
16.1.2 連続投与
健康成人女性に1周期(21日間)連続投与したとき、レボノルゲストレル血漿中濃度は単回投与時より推測した濃度を大きく上回った。これはエチニルエストラジオール投与により誘導された性ホルモン結合性グロブリンによる影響と思われた。エチニルエストラジオール血漿中濃度については連続投与による薬物動態の変化は認められず、単回投与時と同様に推移した1)。
| Tmax | Cmax | T1/2 | AUC0-∞ | ||
| 最終投与時 | LNG | 1.1±0.4hr | 7.2±1.4ng/mL | 27.6±4.6hr | 194.6±69.6ng・hr/mL |
| EE | 1.6±0.5hr | 102±33pg/mL | 7.1±5.0hr | 808±243pg・hr/mL |
16.2 吸収
16.2.1 バイオアベイラビリティ
健康成人女性5例に投与した結果、バイオアベイラビリティは、レボノルゲストレルで89〜99%、エチニルエストラジオールで42〜45%であった2)(外国人データ)。
16.3 分布
16.3.1 蛋白結合率
レボノルゲストレル及びエチニルエストラジオールともに90%以上3)(外国人データ)。
16.4 代謝
16.4.1 レボノルゲストレル
健康成人女性3例に14C-レボノルゲストレルを経口投与し、尿中代謝物を検討した結果、主な代謝物はグルクロン酸抱合体であった4)(外国人データ)。
16.4.2 エチニルエストラジオール
卵巣又は子宮摘除女性13例に3H-エチニルエストラジオールを経口又は静脈内投与し、尿中代謝物を検討した結果、エチニル化合物及び脱エチニル体が認められた5)(外国人データ)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
17.3 その他
各種避妊法使用開始1年間の失敗率(妊娠率)は以下のとおりである9)。[5.参照]
| 方法 | 理想的な使用※(%) | 一般的な使用※※(%) |
| 経口避妊剤 | 0.3 | 9 |
| レボノルゲストレル放出IUS | 0.2 | 0.2 |
| 銅付加IUD | 0.6 | 0.8 |
| コンドーム | 2 | 18 |
| リズム法 | 0.4〜5 | 24 |
| 女性避妊手術 | 0.5 | 0.5 |
| 男性避妊手術 | 0.10 | 0.15 |
| 避妊せず | 85 | 85 |
18. 薬効薬理
18.1 作用機序
18.2 排卵抑制作用
健康成人女性7例に本剤を連続21日間投与し、血漿中LH、FSH濃度を投与開始時及び排卵相当期の前後に測定した。また、血漿中プロゲステロン濃度を投与開始時及び黄体期後期に相当する時期に測定した。その結果、排卵相当期の血漿中LH、FSH濃度は投与開始時と同程度に抑制されており、黄体期後期に相当する時期のプロゲステロン濃度も低値を示したことから、本剤は排卵を抑制することが確認された1)。
18.3 子宮内膜の性状変化による着床阻害作用
健康成人女性28例に本剤と同一の製剤を連続21日間投与し、投与2〜21日目の間に子宮内膜の形態を観察した結果、子宮内膜の形態は正常月経周期と比較し、より早期の分泌期様変化と腺上皮の形成不全を示すなど、受精卵の着床に適さない変化が認められた14)(外国人データ)。
18.4 子宮頸管粘液の変化による精子通過阻害作用
健康成人女性6例に本剤と同一の製剤を連続21日間投与し、周期各時点における頸管粘液の性状及び粘液中の精子移動速度を非投与例と比較した。その結果、投与例の頸管粘液は密度の高い線維状構造で、非投与例の黄体期の所見に類似していた。また、投与例の精子移動速度は周期を通じて低値であった12)(外国人データ)。
19. 有効成分に関する理化学的知見
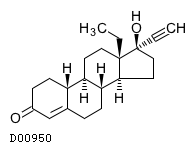
19.1. レボノルゲストレル
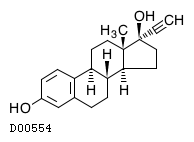
19.2. エチニルエストラジオール
22. 包装
<アンジュ21錠>
252錠[21錠(PTP)×12]
1,260錠[21錠(PTP)×60]
<アンジュ28錠>
84錠[28錠(PTP)×3]
336錠[28錠(PTP)×12]
1,680錠[28錠(PTP)×60]
23. 主要文献
- 落合和徳他, 臨床医薬, 6 (12), 2553-2572, (1990)
- 水野正彦他, 臨床医薬, 7 (3), 579-616, (1991)
- Back,D.J.et al., Contraception., 23 (3), 229-239, (1983)
- Orme,M.L'E.et al., Clin.Pharmacokinet., 8 (2), 95-136, (1983) »PubMed
- Sisenwine,S.F.et al., Drug Metab.Dispos., 3 (3), 180-188, (1975) »PubMed
- Williams,M.C.et al., Steroids., 25 (2), 229-246, (1975) »PubMed
- Humpel,M.et al., Contraception., 19 (4), 421-432, (1979) »PubMed
- 水野正彦他, 臨床医薬, 8 (5), 1033-1048, (1992)
- Hatcher,RA et al., Contraceptive Technology, (Twentieth Revised Edition.New York.Ardent Media.2011(改変))
- 社内資料:Levonorgestrelの各種ホルモン作用およびラット生殖機能に及ぼす影響
- 社内資料:経口活性型プロゲスターゲン、レボノルゲストレルの前臨床的生殖薬理学
- Ulstein,M.et al., Acta Obstet.Gynecol.Scand.Suppl., 105, 45-49, (1982) »PubMed
- Edgren,R.A.et al., J.Reprod.Fertil.Suppl., 5 (Suppl.5), 13-45, (1968)
- Brosens,I.et al., New Considerations in Oral Contraception., p.181-188, (1996), (Ed.Brosens,I.Biomedical Information Corporation,New York.)
24. 文献請求先及び問い合わせ先
文献請求先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
製品情報問い合わせ先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
25. 保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
26. 製造販売業者等
26.1 製造販売元
あすか製薬株式会社
東京都港区芝浦二丁目5番1号
26.2 販売元
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号
その他の説明
23.主要文献
15)安全性に関する参考資料 腫瘍に関する事項
・Collaborative Group on Hormonal Factors in Breast Cancer:Lancet.1996;347:1713-1727
・WHO:Int.J.Cancer.1993;55:228-236
・Ursin,G.et al.:Lancet.1994;344:1390-1394
・Ye,Z.et al.:Int.J.Epidemiol.1995;24:19-26
・Thomas,DB et al.:Am.J.Epidemiol.1996;144:281-289
・小川重男ら:必修産婦人科学 改訂第4版(南江堂).1996:p.390,p.395-396
・Edmondson,HA et al.:N.Engl.J.Med.1976;294:470-472
・Neuberger,J.et al.:Br.Med.J.1986;292:1355-1357
・プリンシプル産科婦人科学婦人科編(メジカルビュー社).1987:p.618-623
・乳癌検診(日本対ガン協会編、社会保険出版社).1984
・乳癌集団検診の手引き(乳癌研究会編、篠原出版).1987
・乳癌の診断と治療(医薬ジャーナル).1995
・Zondervan,KT et al.:Br.J.Cancer.1996;73:1291-1297
・Rooks,JB et al.:JAMA.1979;242:644-648
・Corfman,PA:Contraception.1988;37:433-455
・Mays,ET et al.:Semin.Liver Dis.1984;4:147-157
・Becker,TM et al.:Int.J.Epidemiol.1994;23:913-922
・Parazzini,F.et al.:Br.J.Cancer.1998;77:838-841
・永井宣隆:臨婦産.1997;51:429-436
・Chie,W-C et al.:Int.J.Cancer.1998;77:219-223
・Forman,D.et al.:Br.Med.J.1986;292:1357-1361
・WHO:Int.J.Cancer.1989;43:254-259
・The Collaborative MILTS(Multi-centre International Liver Tumor Study):Contraception.1997;56:275-284
16)安全性に関する参考資料 心血管系に関する事項
・WHO:Lancet.1995;346:1575-1582
・Spitzer,WO et al.:Br.Med.J.1996;312:83-88
・WHO:Lancet.1996;348:498-505
・WHO:Lancet,1996;348:505-510
・Petitti,DB et al.:N.Engl.J.Med.1996;335:8-15
・WHO:Lancet.1997;349:1202-1209
・Lewis,MA et al.:Contraception.1997;56:129-140
・WHO Special Program of Research:Br.J.Obstet.Gynecol.1991;98:1117-1128
・Jespersen,J.et al.:Am.J.Obstet.Gynecol.1990;163:396-403
・Layde,PM et al.:Lancet.1981;1:541-546
・Stadel,BV:N.Engl.J.Med.1981;305:672-677
・風間睦美:Biomedical Perspectives.1997;6:85-89
・Bloemenkamp,KWM et al.:Lancet.1995;346:1593-1596
・丸山征郎:血栓と循環.1996;4:21-23
・野島順三ら:臨床病理.1998;46:1181-1187
・Robinson,GE et al.:Br.Med.J.1991;302:269-271
・Vessey,MP et al.:Br.Med.J.1970;3:123-126
・篠木信敏ら:medicina.1996;33:1308-1310
・Gibbs,NM:Br.J.Surg.1957;45:209-236
・Kawasaki,T.et al.:Thrombosis Res.1995;79:147-151
・高木繁夫ら:綜合臨床.1985;34:1115-1119
・Jain,AK et al.:Studies in Family Planning.1977;8:50-54
・櫻川信男ら:臨床血栓止血学(医歯薬出版).1994:p.231
・脇坂行一ら:病態血液学(南江堂).1978:p.477
・Farley,TMM et al.:Contraception.1998;57:211-230
・Heinemann,LAJ et al.:Br.Med.J.1997;315:1502-1504
17)安全性に関する参考資料 次世代への影響に関する事項
・安田佳子ら:医学のあゆみ.1976;98:537-538
・安田佳子ら:医学のあゆみ.1976;99:611-612
・Takasugi,N.et al.:J.Nat.Cancer Inst.1964;33:855-865
・守 隆夫:医学のあゆみ.1975;95:599-602
・Huggins,GR et al.:Fertility&Sterility.1990;54:559-573
・Corfman,PA:Contraception.1988;37:433-455
・Heinonen,OP et al.:N.Engl.J.Med.1977;296:67-70
・Harlap,S.et al.:Obstet.Gynecol.1980;55:447-452
・Savolainen,E.et al.:Am.J.Obstet.Gynecol.1981;140:521-524
・Ferencz,C.et al.:Teratology.1980;21:225-239
・Rothman,KJ et al.:Am.J.Epidemiol.1979;109:433-439
・常見那順ら:基礎と臨床.1990;24:117-136
・原田滋雄ら:薬理と治療.1991;19:197-231
・Kwarta,Jr.RF et al.:応用薬理.1991;42:327-340
・影山明彦ら:日獨医報.1991;36:284-299
・先天異常調査20年のあゆみ(日本母性保護医協会).1993
・東京都立病産院における先天異常出産モニタリング調査
・Li,DK et al.:Teratology.1995;51:30-36
・Kim,MR et al.:Am.J.Obstet.Gynecol.1995;172:1042-1043
・石塚直隆:日本内分泌学会雑誌.1962;38:443-449
・Carr,DH et al.:Can.Med.Assoc.J.1970;103:343-348
・Lauritsen,JG:Acta Obstet.Gynecol.Scand.1975;54:261-264
・Dhadial,RK et al.:Lancet.1970;II:20-21
・Boue,J.et al.:Teratology.1975;12:11-26
・松永 英:産婦人科治療.1976;32:88-93
・Harlap,S.et al.:Teratology.1985;31:381-387
・Depue,RH et al.:J.Natl.Cancer Inst.1983;71:1151-1155
・Henderson,BE et al.:Int.J.Cancer.1979;23:598-602
・Brown,LM et al.:Cancer Res.1986;46:4812-4816
・Moss,AR et al.:Am.J.Epidemiol.1986;124:39-52
18)安全性に関する参考資料 妊娠機能に関する事項
・Woutersz,TB:J.Reprod.Med.1981;26:615-620
・Royal College of General Practitioners:Oral contraceptives and health.London.Pitman Medical.1974:p.71-77
・Mosher,WD et al.:Fertility&Sterility.1991;56:192-193
・Chasan-Taber,L.et al.:Am.J.Epidemiol.1997;146:258-265
19)安全性に関する参考資料 その他
・厚生省医薬品副作用情報.1977;No.28:33-352
・Crook,D.et al.:Am.J.Obstet.Gynecol.1988;158:1612-1620
・Schwartzman,JA et al.:Rev.Bras.Oto-Rino-Laringol.1975;41:46-50
・Drill,VA:Am.J.Obstet.Gynecol.1974;119:165-174
・Orellana-Alcalde,JM et al.:Lancet.1966;2:1278-1280
・Koide,SS et al.:J.Reprod.Med.1975;15:214-224
・Nilsson,S.:Contraception.1978;17:131-139
・吉本雅昭ら:ホルモンと臨床.1996;44:597-605
・Godsland,IF et al.:J.Clin.Endocrinol.Metab.1992;74:64-70
・二宮涼子ら:臨皮.1994;48:281-283
・降旗謙一ら:最新医学.1980;35:2522-2527
・Harrison's Principles of Internal Medicine,Eighth Edition.1977:p.176,p.1450
・岡田弘二:ステロイド療法のあり方 産婦人科領域(金芳堂).1982:p.171
・Zimmerman,AW:Neurol.Clin.1986;4:853-861
・Burckhardt,P.:Hormone Res.1975;6:321-328
・Frey,BM et al.:Eur.J.Clin.Pharmacol.1984;26:505-511
・Abernethy,DR et al.:Clin.Pharmacol.Ther.1984;35:792-797
・セレギリン塩酸塩添付文書
・シクロスポリン添付文書
・Reimers,D.et al.:Prax.Pneumol.1971;25:255-262
・Back,DJ et al.:Contraception.1980;21:135-143
・Back,DJ et al.:Br.J.Pharmacol.1980;69:441-452
・Back,DJ et al.:Br.J.Clin.Pharmacol.1988;25:527-532
・Crawford,P.et al.:Br.J.Clin.Pharmacol.1990;30:892-896
・Back,DJ et al.:J.Steroid.Biochem.1982;16:407-413
・テルビナフィン塩酸塩添付文書
・ブセレリン酢酸塩添付文書
・Steele,JM:J.Fam.Plan.Doctors.1978;3:77
・ネルフィナビルメシル酸塩添付文書
・Ouellet,D.et al.:Br.J.Clin.Pharmacol.1998;46:111-116
・ネビラピン添付文書
・檜垣祐子:今日の治療指針(医学書院).1999:p.713
・Van Vange,N.et al.:Contraception.1990;41:345-352
・野口 實:日産婦誌.1988;40:14-20
・Schatz,DL et al.:Can.Med.Assoc.J.1968;99:882-886
・今釜秀一ら:臨床眼科.1987;41:751-753
・Chasan-Taber,L.et al.:Circulation.1996;94:483-489
・Beral,V.et al.:Br.Med.J.1999;318:96-100
・Mostad,SB et al.:Lancet.1997;350:922-927
・Royal College of General Practitioners:Oral contraceptives and health.London.Pitman Medical.1974:p.22-30
・Bray,RS:Contraception.1976;13:417-425
・Keller,AJ et al.:Obstet.Gynecol.1977;49:83-91
・Gerretsen,G.et al.:Contraception.1980;22:25-29
・Baker,DA et al.:Contraception.1985;32:377-382
・Bisset,LR et al.:Contraception.1988;38:573-578
・Baker,DA et al.:Contraception.1989;39:119-124
・Scanlan,JM et al.:Psychoneuroendocrinology.1995;20:281-287
20)有効性に関する参考資料 避妊効果に関する事項
・Hatcher,RA et al.:Contraceptive Technology:Twentieth Revised Edition.New York.Ardent Media.2011:p.779-861
・Morris,SE et al.:Contraception.1979;20:61-69
・Chowdhury,V.et al.:Contraception.1980;22:241-247
・Sparrow,MJ:NZ.Med.J.1987;100:102-105
21)有効性に関する参考資料 人工妊娠中絶に関する資料
・平成9年母体保護統計報告(厚生省大臣官房統計情報部人口動態統計課)
・毎日新聞人口問題調査会(第23回全国家族計画世論調査報告書より改編)
・Determinants of contraceptive use
・United Nations:Demographic Yearbook 1996版.1998
22)有効性に関する参考資料 副効用に関する資料
・The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development:N.Engl.J.Med.1987;316:650-655
・Narod,SA et al.:N.Engl.J.Med.1998;339:424-428
・The Centers for Disease Control Cancer and Steroid Hormone Study:JAMA.1983;249:1596-1599
・The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development:JAMA.1987;257:796-800
・Schlesselman,JJ:Human Reproduction.1997;12:1851-1863
・Royal College of General Practitioners:Oral contraceptives and health.London.Pitman Medical.1974:p.22,p.61
・Connel,EB et al.:J.Reprod.Med.1984;29:513-523
・Lanes,SF et al.:Am.J.Obstet.Gynecol.1992;166:956-961
・Vessey,M.et al.:J.Biosoc.Sci.1976;8:373-427
・Westrom,L.:Am.J.Obstet.Gynecol.1980;138:880-892
・Rubin,GL et al.:Am.J.Obstet.Gynecol.1982;144:630-635
・Brinton,LA et al.:Am.J.Epidemiol.1981;113:203-214