医薬品情報
| 総称名 | ワンアルファ |
|---|---|
| 一般名 | アルファカルシドール |
| 欧文一般名 | Alfacalcidol |
| 製剤名 | アルファカルシドール製剤 |
| 薬効分類名 | 活性型ビタミンD3製剤 |
| 薬効分類番号 | 3112 |
| ATCコード | A11CC03 |
| KEGG DRUG |
D01518
アルファカルシドール
|
| KEGG DGROUP |
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第2版)

|
4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ワンアルファ錠0.25μg | Onealfa Tablets 0.25μg | 帝人ファーマ | 3112001F1055 | 8.3円/錠 | 劇薬 |
| ワンアルファ錠0.5μg | Onealfa Tablets 0.5μg | 帝人ファーマ | 3112001F2051 | 8.5円/錠 | 劇薬 |
| ワンアルファ錠1.0μg | Onealfa Tablets 1.0μg | 帝人ファーマ | 3112001F3058 | 11.4円/錠 | 劇薬 |
4. 効能または効果
6. 用法及び用量
<効能共通>
本剤は、患者の血清カルシウム濃度の十分な管理のもとに、投与量を調整する。
<慢性腎不全、骨粗鬆症>
通常、成人1日1回アルファカルシドールとして0.5〜1.0μgを経口投与する。ただし、年齢、症状により適宜増減する。
<副甲状腺機能低下症、その他のビタミンD代謝異常に伴う疾患>
通常、成人1日1回アルファカルシドールとして1.0〜4.0μgを経口投与する。ただし、疾患、年齢、症状、病型により適宜増減する。
(小児用量)
通常、小児に対しては骨粗鬆症の場合には1日1回アルファカルシドールとして0.01〜0.03μg/kgを、その他の疾患の場合には1日1回アルファカルシドールとして0.05〜0.1μg/kgを経口投与する。ただし、疾患、症状により適宜増減する。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 高リン血症のある患者
リン酸結合剤を併用し、血清リン値を下げること。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で授乳による新生児への移行率は、母動物投与量の1/20に相当する4)。
9.7 小児等
9.8 高齢者
用量に注意すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| マグネシウムを含有する製剤 酸化マグネシウム、 炭酸マグネシウム等 | 高マグネシウム血症があらわれるおそれがある。 | 他のビタミンD誘導体と同様に腸管でのマグネシウムの吸収を促進させると考えられる。 |
| マグネシウムを含有する製剤 酸化マグネシウム、 炭酸マグネシウム等 | ミルク・アルカリ症候群(高カルシウム血症、高窒素血症、アルカローシス等)があらわれるおそれがある。 | 血中マグネシウムの増加により代謝性アルカローシスが持続するため、尿細管でのカルシウム再吸収が増加する。 |
| ジギタリス製剤 ジゴキシン等 [8.1-8.3参照] | 不整脈があらわれるおそれがある。 | 本剤により高カルシウム血症が発症した場合、ジギタリス製剤の作用が増強される。 |
| カルシウム製剤 乳酸カルシウム水和物、 炭酸カルシウム等 [8.1-8.3参照] | 高カルシウム血症があらわれるおそれがある。 | 本剤は腸管でのカルシウムの吸収を促進させる。 |
| ビタミンD及びその誘導体 カルシトリオール等 [8.1-8.3参照] | 高カルシウム血症があらわれるおそれがある。 | 相加作用による。 |
| PTH製剤 テリパラチド等 PTHrP製剤 アバロパラチド酢酸塩 [8.1-8.3参照] | 高カルシウム血症があらわれるおそれがある。 | 相加作用による。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 急性腎障害(頻度不明)
11.1.2 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、Al-Pの上昇等を伴う肝機能障害、黄疸があらわれることがある。
注)副作用の発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | |
| 消化器 | 食欲不振、悪心・嘔気、下痢、便秘、胃痛 | 嘔吐、腹部膨満感、胃部不快感、消化不良、口内異和感、口渇等 |
| 精神神経系 | 頭痛・頭重、不眠・いらいら感、脱力・倦怠感、めまい、しびれ感、眠気、記憶力・記銘力の減退、耳鳴り、老人性難聴、背部痛、肩こり、下肢のつっぱり感、胸痛等 | |
| 循環器 | 軽度の血圧上昇、動悸 | |
| 肝臓 | AST、ALTの上昇 | LDH、γ-GTPの上昇 |
| 腎臓 | BUN、クレアチニンの上昇(腎機能の低下) | 腎結石 |
| 皮膚 | そう痒感 | 発疹、熱感 |
| 眼 | 結膜充血 | |
| 骨 | 関節周囲の石灰化(化骨形成) | |
| その他 | 嗄声、浮腫 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
健康成人14例に対してワンアルファ錠4.0μg(1.0μg×4錠)を経口投与した場合、血中1α,25-(OH)2D濃度は投与後4〜24時間(平均11.0時間)で最高値(平均94.6pg/mL)に達し、48〜72時間でほぼ投与前値に復した6)。
16.2 吸収
本剤は小腸で吸収される7)。
16.3 分布
ラットに14日間連続投与した実験では、主要臓器への蓄積傾向は認められていない8)。
16.4 代謝
本剤は肝臓ですみやかに代謝されて1α,25-(OH)2D3となる7)。
16.5 排泄
ラットに0.4μg/kg経口投与した場合、尿糞あわせて48時間以内に約72%が排泄され、7日間でほぼ100%が排泄された9)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
本剤は、経口投与後腸管からすみやかに血中に吸収され肝ミクロゾームの25-hydroxylaseによって側鎖の25位が水酸化されて活性発現物質1α,25-(OH)2D3となり、腸管及び骨等の標的組織に分布するレセプターに結合し腸管からのCa吸収促進作用、骨塩溶解作用及び骨形成作用等一連の生理活性を発現する。
18.2 腸管からのCa吸収ならびに血清Ca上昇作用
18.3 骨形成促進作用
18.3.1 骨組織培養
9日鶏卵からとりだした胎児の組織培養の研究により、正常な骨形成には1α,25-(OH)2D3が必須であることが証明された19)。
18.3.2 腎摘ラット
腎亜全摘により、多数の骨吸収腔と類骨層、低石灰化層が著明に増加したラットに、アルファカルシドールを30日間投与した実験において、骨新生が認められている20)。
18.3.3 骨粗鬆症モデルラット(卵巣摘出ラット)
卵巣摘出長期飼育により血中1α,25-(OH)2D3値の低下や海綿骨梁及び石灰沈着率の減少がおこるが、これらの変化はアルファカルシドール0.1μg/kg/日、6ヵ月間投与により改善した21)。
18.3.4 骨粗鬆症モデルラット(ハイドロコーチゾン投与ラット)
ハイドロコーチゾン長期間投与により海綿骨梁、骨皮質幅、骨成分の減少がおこるが、これらの変化はアルファカルシドール0.02μg/kg/日〜0.1μg/kg/日、12週間投与により改善した22)。
18.3.5 老人性骨粗鬆症(ヒト、電顕的・光顕的観察)
ワンアルファカプセル投与前後で腸骨骨生検を実施し、電顕的・光顕的観察を行ったところ、活動性骨芽細胞・骨細胞・石灰化骨小腔の増加等、骨組織学的な改善が認められた23)。
18.3.6 Ca摂取量と骨吸収・骨形成作用
ビタミンD欠乏ラットの飼料中のCa含量を変え、アルファカルシドールを投与した実験において、Ca含量が少ない場合には骨吸収があらわれ、Ca含量が十分である場合には骨形成が顕著にあらわれた17)。
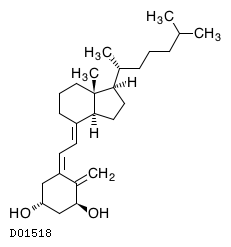
19. 有効成分に関する理化学的知見
19.1. アルファカルシドール
20. 取扱い上の注意
20.1 光により変色することがあるので、開封後は遮光して保存すること。
20.2 開封後は湿気を避けて保存すること。
22. 包装
<ワンアルファ錠0.25μg>
PTP(乾燥剤入り)
100錠(10錠×10)、500錠(10錠×50)、1,000錠(10錠×100)
<ワンアルファ錠0.5μg>
PTP(乾燥剤入り)
100錠(10錠×10)、500錠(10錠×50)、1,000錠(10錠×100)
<ワンアルファ錠1.0μg>
PTP(乾燥剤入り)
100錠(10錠×10)、500錠(10錠×50)、1,000錠(10錠×100)
23. 主要文献
- 加藤正夫ほか, 基礎と臨床, 12 (1), 32-45, (1978)
- 加藤正夫ほか, 基礎と臨床, 12 (2), 203-13, (1978)
- 加藤正夫ほか, 基礎と臨床, 12 (4), 716-30, (1978)
- 大沼規男ほか, 応用薬理, 15 (3), 459-67, (1978)
- 社内報告:急性毒性(幼若ラット), (1985)
- 社内報告:薬物動態(健康成人), (1986)
- 社内報告:代謝(ラット肝ホモジェネート、肝還流), (1978)
- 清木 護ほか, 応用薬理, 16 (6), 1137-44, (1978)
- 大沼規男ほか, 応用薬理, 16 (6), 1123-36, (1978)
- 越川昭三ほか, 臨床水電解質, 5 (6), 645-52, (1986)
- 清野佳紀ほか, 小児科臨床, 39 (7), 1691-7, (1986)
- 西山宗六ほか, 小児科臨床, 39 (8), 2029-35, (1986)
- 井上哲郎ほか, 新薬と臨牀, 35 (6), 1234-42, (1986)
- 白旗敏克ほか, 新薬と臨牀, 35 (6), 1243-9, (1986)
- 上田 泰ほか, 臨床評価, 7 (1), 137-56, (1979)
- 伊丹康人ほか, 医学のあゆみ, 123 (10), 958-73, (1982)
- 川島博行ほか, 日本薬理学雑誌, 74 (2), 267-83, (1978) »PubMed
- 川島博行ほか, 応用薬理, 16 (5), 845-52, (1978)
- 清木 護ほか, 組織培養, 8 (3), 79-84, (1982)
- Ueno K,et al., Vitamin D Basic Research and its Clinical Application., 901-5, (1979)
- 伊沢義弘ほか, Prog Med., 2 (7), 1071-9, (1982)
- 伊沢義弘ほか, Prog Med., 2 (7), 1080-8, (1982)
- 須田昭男ほか, Prog Med., 2 (7), 1098-104, (1982)
24. 文献請求先及び問い合わせ先
文献請求先
帝人ファーマ株式会社
メディカル情報グループ
〒100-8585
東京都千代田区霞が関3丁目2番1号
電話:フリーダイヤル 0120-189-315
製品情報問い合わせ先
帝人ファーマ株式会社
メディカル情報グループ
〒100-8585
東京都千代田区霞が関3丁目2番1号
電話:フリーダイヤル 0120-189-315
26. 製造販売業者等
26.1 製造販売元
帝人ファーマ株式会社
東京都千代田区霞が関3丁目2番1号