医薬品情報
| 総称名 | ジクロフェナクナトリウム |
|---|---|
| 一般名 | ジクロフェナクナトリウム |
| 欧文一般名 | Diclofenac Sodium |
| 製剤名 | ジクロフェナクナトリウムテープ剤 |
| 薬効分類名 | 経皮鎮痛消炎剤 |
| 薬効分類番号 | 2649 |
| ATCコード | D11AX18 |
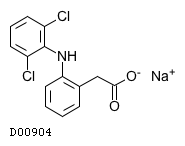
| KEGG DRUG |
D00904
ジクロフェナクナトリウム
|
| KEGG DGROUP |
DG01504
非ステロイド性抗炎症薬 (NSAID)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年10月 改訂(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ジクロフェナクナトリウムテープ15mg「NP」 (後発品) | DICLOFENAC SODIUM TAPES | ニプロファーマ | 2649734S1147 | 11.5円/枚 | |
| ジクロフェナクナトリウムテープ30mg「NP」 | DICLOFENAC SODIUM TAPES | ニプロファーマ | 2649734S2143 | 17.6円/枚 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 アスピリン喘息(非ステロイド性消炎鎮痛剤等により誘発される喘息発作)又はその既往歴のある患者[重症喘息発作を誘発するおそれがある。][9.1.1参照]
4. 効能または効果
下記疾患並びに症状の鎮痛・消炎
変形性関節症、肩関節周囲炎、腱・腱鞘炎、腱周囲炎、上腕骨上顆炎(テニス肘等)、筋肉痛(筋・筋膜性腰痛症等)、外傷後の腫脹・疼痛
6. 用法及び用量
1日1回患部に貼付する。
8. 重要な基本的注意
8.1 消炎鎮痛剤による治療は原因療法ではなく対症療法であることに留意すること。
8.2 慢性疾患(変形性関節症等)に対し本剤を用いる場合には、薬物療法以外の療法も考慮すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 気管支喘息のある患者(アスピリン喘息又はその既往歴のある患者を除く)
アスピリン喘息ではないことを十分に確認すること。気管支喘息の患者の中にはアスピリン喘息患者も含まれている可能性があり、それらの患者では重症喘息発作を誘発するおそれがある。[2.2参照]
9.1.2 皮膚感染症のある患者
感染を伴う炎症に対して用いる場合には適切な抗菌剤又は抗真菌剤を併用し、観察を十分行い慎重に使用すること。皮膚の感染症を不顕性化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性に対しては治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。
シクロオキシゲナーゼ阻害剤を妊娠中期以降の妊婦に使用し、胎児動脈管収縮が起きたとの報告がある。また、シクロオキシゲナーゼ阻害剤(経口剤、坐剤)を妊婦に使用し、胎児の腎機能障害及び尿量減少、それに伴う羊水過少症が起きたとの報告がある。
シクロオキシゲナーゼ阻害剤を妊娠中期以降の妊婦に使用し、胎児動脈管収縮が起きたとの報告がある。また、シクロオキシゲナーゼ阻害剤(経口剤、坐剤)を妊婦に使用し、胎児の腎機能障害及び尿量減少、それに伴う羊水過少症が起きたとの報告がある。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| ニューキノロン系抗菌剤 レボフロキサシン等 | 痙攣を起こすおそれがある。痙攣が発現した場合には、気道を確保し、ジアゼパムの静注等を行う。 | ニューキノロン系抗菌剤が脳内の抑制性神経伝達物質であるGABAの受容体結合を濃度依存的に阻害し、ある種の非ステロイド性抗炎症剤との共存下ではその阻害作用が増強されることが動物で報告されている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には使用を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(蕁麻疹、血管浮腫、呼吸困難等)があらわれることがある。
11.1.2 接触皮膚炎(頻度不明)
使用部位に発赤、紅斑、発疹、そう痒感、疼痛の皮膚症状があらわれ、腫脹、浮腫、水疱・びらん等に悪化し、さらに全身に拡大し重篤化することがある。
注)1%ジクロフェナクナトリウム軟膏における発現頻度
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 皮膚 | 皮膚炎、そう痒感、発赤、皮膚のあれ、刺激感 | 水疱、色素沈着 | 光線過敏症、浮腫、腫脹、皮膚剥脱 |
14. 適用上の注意
14.1 薬剤使用時の注意
14.1.1 損傷皮膚及び粘膜に使用しないこと。
14.1.2 湿疹又は発疹の部位に使用しないこと。
16. 薬物動態
16.3 分布
16.3.1 生物学的同等性試験
ジクロフェナクナトリウムテープ15mg「NP」(旧処方製剤注))とボルタレンテープ15mgを健康成人男性の背部皮膚に貼付し、貼付0時間後及び24時間後の薬物回収量を用いてジクロフェナクナトリウムの皮膚への移行量を算出した。得られた値について90%信頼区間法にて統計解析を行った結果、皮膚への薬物移行量の平均値の差はlog(0.70)〜log(1.43)の範囲内であり、両剤の生物学的同等性が確認された1)。
注)ジクロフェナクナトリウムテープ30mg「NP」について現処方製剤と旧処方製剤の生物学的同等性が確認されたことから、容れ目違いであるジクロフェナクナトリウムテープ15mg「NP」の現処方製剤と旧処方製剤についても生物学的に同等であると判断された。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
酸性非ステロイド性抗炎症薬(NSAIDs)である。プロスタグランジン生合成の律速酵素であるシクロオキシゲナーゼ(COX)を阻害し、プロスタグランジンの産生を抑制することにより、抗炎症作用、解熱作用、鎮痛作用を現す。構成型COX(COX-1)と誘導型COX(COX-2)に対する選択性はない18)。
18.2 抗炎症作用
18.2.1 急性炎症
1%ジクロフェナクナトリウム軟膏は、カラゲニン足蹠浮腫(ラット)、紫外線紅斑(モルモット)で、1%インドメタシン軟膏と同程度の抗炎症作用を示す。また、カラゲニン誘発炎症足中(ラット)のプロスタグランジンE2の産生を有意に抑制する19)。
18.2.2 亜急性・慢性炎症
1%ジクロフェナクナトリウム軟膏は、マスタード足蹠浮腫(ラット)、ペーパーディスク試験(ラット)、アジュバント関節炎(ラット)で、1%インドメタシン軟膏と同程度の抗炎症作用を示す20)。
18.3 鎮痛作用
1%ジクロフェナクナトリウム軟膏は、酢酸ライジング疼痛試験(マウス)、イースト疼痛試験(ラット)で、1%インドメタシン軟膏と同程度の疼痛抑制作用を示す21)。
19. 有効成分に関する理化学的知見
19.1. ジクロフェナクナトリウム
22. 包装
<ジクロフェナクナトリウムテープ15mg「NP」>
70枚(7枚/1袋×10袋)
700枚(7枚/1袋×100袋)
<ジクロフェナクナトリウムテープ30mg「NP」>
70枚(7枚/1袋×10袋)
700枚(7枚/1袋×100袋)
23. 主要文献
- 社内資料:生物学的同等性試験[15mgテープ剤]
- 後期第II相用量設定試験(ボルタレンゲル1%:2000年1月18日承認、申請資料概要ト.I.2-3)
- 宗広忠平ほか, 臨床医薬, 16 (4), 407-417, (2000)
- 真鍋 等ほか, 臨床医薬, 16 (4), 419-426, (2000)
- 青木虎吉ほか, 臨床医薬, 16 (4), 427-443, (2000)
- 青木虎吉ほか, 臨床医薬, 16 (4), 445-467, (2000)
- 青木虎吉ほか, 臨床医薬, 16 (4), 469-488, (2000)
- 青木虎吉ほか, 臨床医薬, 16 (4), 489-503, (2000)
- 長屋郁郎ほか, 臨床医薬, 16 (4), 505-519, (2000)
- 竹光義治ほか, 臨床医薬, 16 (4), 521-527, (2000)
- 渡辺好博ほか, 臨床医薬, 16 (4), 529-538, (2000)
- 小野啓郎ほか, 臨床医薬, 16 (4), 539-555, (2000)
- 岩崎勝郎ほか, 臨床医薬, 16 (4), 557-566, (2000)
- 高橋栄明ほか, 臨床医薬, 16 (4), 567-576, (2000)
- 山野慶樹ほか, 臨床医薬, 16 (4), 577-585, (2000)
- 井形高明ほか, 臨床医薬, 16 (4), 587-594, (2000)
- 杉岡洋一ほか, 臨床医薬, 16 (4), 595-609, (2000)
- 第十八改正日本薬局方解説書, C-2173-C-2178, (2021), (廣川書店)
- 急性炎症(ボルタレンゲル1%:2000年1月18日承認、申請資料概要ホ.I.1-1)
- 亜急性・慢性炎症(ボルタレンゲル1%:2000年1月18日承認、申請資料概要ホ.I.1-2、ホ.I.1-3)
- 鎮痛作用(ボルタレンゲル1%:2000年1月18日承認、申請資料概要ホ.I.2)
24. 文献請求先及び問い合わせ先
文献請求先
ニプロ株式会社
医薬品情報室
〒566-8510
大阪府摂津市千里丘新町3番26号
電話:0120-226-898
FAX:050-3535-8939
製品情報問い合わせ先
ニプロ株式会社
医薬品情報室
〒566-8510
大阪府摂津市千里丘新町3番26号
電話:0120-226-898
FAX:050-3535-8939
26. 製造販売業者等
26.1 製造販売元
ニプロファーマ株式会社
大阪府摂津市千里丘新町3番26号
26.2 販売元
ニプロ株式会社
大阪府摂津市千里丘新町3番26号