医薬品情報
| 総称名 | バンコマイシン |
|---|---|
| 一般名 | バンコマイシン塩酸塩 |
| 欧文一般名 | Vancomycin Hydrochloride |
| 製剤名 | バンコマイシン塩酸塩眼軟膏 |
| 薬効分類名 | グリコペプチド系抗生物質製剤 |
| 薬効分類番号 | 6113 |
| ATCコード | A07AA09 J01XA01 S01AA28 |
| KEGG DRUG |
D00926
バンコマイシン塩酸塩
|
| KEGG DGROUP |
DG01580
グリコペプチド系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| バンコマイシン眼軟膏1% | Vancomycin Ophthalmic Ointment 1% | 東亜薬品 | 6113700M1023 | 4274.7円/g | 処方箋医薬品注) |
1. 警告
本剤の耐性菌の発現を防ぐため、「5.効能・効果に関連する注意」、「7.用法・用量に関連する注意」、「8.重要な基本的注意」の項を熟読の上、適正使用に努めること。
2. 禁忌
次の患者には投与しないこと
本剤の成分によるショックの既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
本剤の投与にあたっては、耐性菌の発現を防ぐため、原則として他の抗菌薬及び本剤に対する感受性を確認し、他の薬剤による効果が期待できず、かつ、本剤に感性のMRSAあるいはMRSEが起炎菌と診断された感染症である場合に投与すること。
6. 用法及び用量
通常、適量を1日4回塗布する。
7. 用法及び用量に関連する注意
7.1 本剤の投与にあたっては、耐性菌の発現を防ぐため、次のことに注意すること。
7.1.1 本剤の投与期間は、14日間以内を目安とすること。
なお、感染部位、重症度、患者の症状等を考慮し、適切な時期に、本剤の継続投与が必要か否か判定し、疾病の治療上必要な最低限の期間の投与にとどめること。
なお、感染部位、重症度、患者の症状等を考慮し、適切な時期に、本剤の継続投与が必要か否か判定し、疾病の治療上必要な最低限の期間の投与にとどめること。
7.1.2 14日間を超えた投与期間における安全性は確認されていない。
8. 重要な基本的注意
本剤の投与にあたっては、耐性菌の発現を防ぐため、感染症の治療に十分な知識と経験を持つ医師又はその指導の下で投与すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。静脈内投与により、ヒト母乳中への移行が認められている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(呼吸困難、全身潮紅、浮腫等)を起こすことがある。
11.1.2 角膜障害(頻度不明)
びらん等の角膜上皮障害が発現することがある。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 眼 | 眼瞼浮腫、結膜充血 | 眼の異常感、そう痒感、分泌物増加 | 眼瞼発赤 |
| その他 | 顔面腫脹 | 創傷治癒の遅延 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・薬剤汚染防止のため、塗布するとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜嚢内に塗布し、閉瞼して軟膏が全体に広がった後、開瞼すること。
・軟膏が眼瞼皮膚等についた場合には、すぐにふき取ること。
・他の点眼剤を併用する場合には、本剤を最後に塗布すること。その際、少なくとも5分以上間隔をあけること。
14.2 薬剤投与時の注意
眼科用にのみ使用すること。
16. 薬物動態
16.1 血中濃度
バンコマイシン眼軟膏0.3%〜3%製剤注)を健康成人男性各10例に単回又はバンコマイシン眼軟膏1%及び2%製剤注)を健康成人男性各10例に1日4回14日間反復塗布したところ、いずれにおいても塗布後1時間及び24時間の血漿中バンコマイシン濃度は定量限界(0.01μg/mL)以下であった1)。
16.3 分布
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
MRSAまたはMRSEに起因する眼感染症患者25例を対象として、バンコマイシン眼軟膏1%製剤の有効性及び安全性を検討した。用法用量は1回約1cm(約50mg)、1日4回(朝、昼、夕、就寝前)投与した。投与期間は治験責任医師等が菌消失と判断した時点で投与を終了した。なお、バンコマイシン眼軟膏1%の投与は、14日間を超えないものとした。菌種別にはMRSA19例、MRSE2例であった。疾患別には、結膜炎14例(66.7%)、眼瞼炎3例(14.3%)、涙嚢炎2例(9.5%)、瞼板腺炎および角膜炎各1例(4.8%)であった。結果、臨床効果判定で66.7%(14/21例:95%信頼区間43.0〜85.4%)の有効率が認められた。菌種別には、MRSAに対する有効率は63.2%(12/19例)、MRSEに対する有効率は100.0%(2/2例)であった。副作用発現頻度は、28.0%(7/25例)であった。主な副作用は、眼瞼浮腫12.0%(3/25例)及び結膜充血12.0%(3/25例)等であった6)。
17.2 製造販売後調査等
17.2.1 国内使用成績調査
MRSAまたはMRSEに起因する眼感染症患者632例を対象にした使用成績調査において、バンコマイシン眼軟膏1%製剤の有効性及び安全性を検討した。臨床効果判定での有効率は85.1%(639/751眼:95%信頼区間82.4〜87.5%)であり、細菌学的効果判定でのMRSA消失率は68.6%(378/551眼:95%信頼区間64.6〜72.3%)、MRSE消失率は88.7%(55/62眼:95%信頼区間78.5〜94.4%)であった。
安全性解析対象632例における臨床検査値異常を含む副作用発現割合は7.3%(46/632例)であった。その主なものは、角膜びらん0.8%(5/632例)、眼瞼発赤、好酸球数高値が各0.6%(4/632例)、眼瞼腫脹、点状表層角膜症、適用部位疼痛、CRP増加が各0.5%(3/632例)であった7)。
18. 薬効薬理
18.1 作用機序
好気性のグラム陽性球菌であるブドウ球菌、腸球菌、レンサ球菌属、肺炎球菌、嫌気性のグラム陽性菌であるクロストリジウム、ラクトバチルスなどにすぐれた抗菌力を示す。
その作用は細胞壁ペプチドグリカンの合成阻害と細胞膜の変性及びRNA合成阻害であり、殺菌的である。特に最近臨床において深刻な問題となっているメチシリン耐性ブドウ球菌に対して、in vitro及びin vivoですぐれた効果が認められているが、バンコマイシン耐性菌も出現している8)。
18.2 MRSA角膜炎に対する効果
バンコマイシン眼軟膏は、ウサギMRSA角膜炎モデルにおいて1%以上の濃度で治療効果が認められた9)。
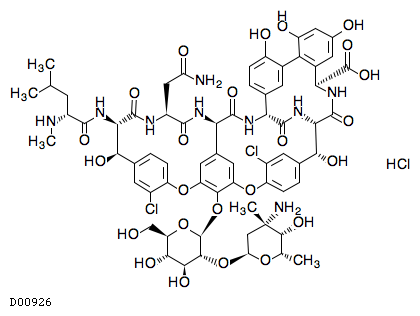
19. 有効成分に関する理化学的知見
19.1. バンコマイシン塩酸塩
21. 承認条件
21.1 適切な製造販売後調査(感受性調査を含む)を継続し、情報を収集すること。
21.2 収集した情報を解析し、適正な使用を確保するため医療機関に対し必要な情報提供を継続すること。
21.3 安全性定期報告に準じた報告書を年1回厚生労働省に提出すること。
22. 包装
5gチューブ×1本
23. 主要文献
- 深瀬広幸ほか, 臨床医薬, 27 (3), 227-235, (2011)
- 社内資料:ウサギに点眼投与したときの体内動態試験(角膜,結膜及び眼房水中濃度)に関する資料(承認年月日:2009年10月16日、CTD2.6.4.4)
- 社内資料:ウサギに単回点眼投与したときの体内動態試験(2%製剤での眼組織内分布及び尿糞中排泄)に関する資料(承認年月日:2009年10月16日、CTD2.6.4.4)
- 社内資料:ウサギに点眼投与したときの体内動態試験(眼組織内分布)に関する資料(承認年月日:2009年10月16日、CTD2.6.4.4)
- 社内資料:ウサギ尿及び糞中排泄率に関する資料(承認年月日:2009年10月16日、CTD2.6.4.6)
- Chie Sotozono,et al., BMJ Open., 3, e001206, (2013)
- 社内資料:使用成績調査
- 第十七改正日本薬局方解説書, C4017, (2016), (廣川書店)
- 社内資料:ウサギMRSA角膜炎モデルにおける有用性に関する資料(承認年月日:2009年10月16日、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
日東メディック株式会社
おくすり相談窓口
〒104-0031
東京都中央区京橋1-10-7
電話:03-3523-0345
FAX:03-6264-4086
製品情報問い合わせ先
日東メディック株式会社
おくすり相談窓口
〒104-0031
東京都中央区京橋1-10-7
電話:03-3523-0345
FAX:03-6264-4086
26. 製造販売業者等
26.1 製造販売元
東亜薬品株式会社
富山県富山市水橋開発277番10
26.2 発売元
日東メディック株式会社
富山県富山市八尾町保内1-14-1