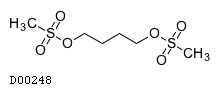
医薬品情報
| 総称名 | ブスルフェクス |
|---|---|
| 一般名 | ブスルファン |
| 欧文一般名 | Busulfan |
| 製剤名 | 注射用ブスルファン |
| 薬効分類名 | 造血幹細胞移植前治療薬 |
| 薬効分類番号 | 4213 |
| ATCコード | L01AB01 |
| KEGG DRUG |
D00248
ブスルファン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年8月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ブスルフェクス点滴静注用60mg | Busulfex injection 60mg | 大塚製薬 | 4213400A2025 | 27803円/瓶 | 劇薬, 処方箋医薬品注) |
1. 警告
1.1 造血幹細胞移植の前治療に本剤を投与する場合には、緊急時に十分対応できる医療施設において、造血幹細胞移植に十分な知識と経験をもつ医師のもとで、適切と判断される患者にのみ実施すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
1.2 本剤を小児に投与する場合には、小児のがん化学療法に十分な知識と経験をもつ医師のもとで実施すること。
1.3 本剤の使用にあたっては、慎重に患者を選択すること。
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
○同種造血幹細胞移植の前治療
6. 用法及び用量
<同種造血幹細胞移植の前治療、ユーイング肉腫ファミリー腫瘍及び神経芽細胞腫における自家造血幹細胞移植の前治療>
他の抗悪性腫瘍薬との併用において、成人にはA法又はB法、小児にはC法又はD法を使用する。なお、患者の状態により適宜減量する。
<悪性リンパ腫における自家造血幹細胞移植の前治療>
他の抗悪性腫瘍薬との併用において、成人にはA法又はB法を使用する。なお、患者の状態により適宜減量する。
| 成人 | A法:ブスルファンとして1回0.8mg/kgを2時間かけて点滴静注する。本剤は6時間毎に1日4回、4日間投与する。 B法:ブスルファンとして1回3.2mg/kgを3時間かけて点滴静注する。本剤は1日1回、4日間投与する。 | ||
| 小児 | C法:ブスルファンとして以下の体重別の投与量を2時間かけて点滴静注する。本剤は6時間毎に1日4回、4日間投与する。 D法:ブスルファンとして以下の体重別の投与量を3時間かけて点滴静注する。本剤は1日1回、4日間投与する。 | ||
| 実体重 | 本剤投与量〔mg/kg〕 | ||
| C法 | D法 | ||
| 9kg未満 | 1.0 | 4.0 | |
| 9kg以上16kg未満 | 1.2 | 4.8 | |
| 16kg以上23kg以下 | 1.1 | 4.4 | |
| 23kg超34kg以下 | 0.95 | 3.8 | |
| 34kg超 | 0.8 | 3.2 | |
7. 用法及び用量に関連する注意
<効能共通>
7.1 肥満患者(BMIが25以上)では投与量が過多にならないように、標準体重から換算した投与量を考慮すること。
<同種造血幹細胞移植の前治療、ユーイング肉腫ファミリー腫瘍及び神経芽細胞腫における自家造血幹細胞移植の前治療>
8. 重要な基本的注意
8.1 本剤の使用にあたっては、患者の状態及び臓器機能(心、肺、肝、腎等)を十分検討し、造血幹細胞移植を実施可能と判断される患者にのみ投与し、以下の事項について特に注意すること。
・本剤の投与中は心電図、血圧及び尿量等のモニターを行うこと。また、投与後は定期的に臨床検査(血液検査、肝機能検査、腎機能検査等)及び尿量のモニター等を行うこと。
・本剤の投与後は患者の状態を十分に観察し、致命的な感染症の発現を抑制するため、抗菌剤投与等の感染症対策を行い、適切な無菌管理を行うこと。
・本剤の投与後は輸血及び造血因子の投与等適切な支持療法を行うこと。
8.2 本剤の投与により痙攣を起こす可能性があるため、あらかじめ抗痙攣薬の使用を考慮するなどの適切な措置を講ずること。[11.1.4参照]
8.4 本剤をB法(成人)1)又はD法(小児)2)で使用する際には、関連文献(「医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:ブスルファン(新用法・用量の追加)」等)を熟読すること。
8.5 本剤を悪性リンパ腫における自家造血幹細胞移植の前治療に使用する際には、関連文献(「医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:ブスルファン(悪性リンパ腫における自家造血幹細胞移植の前治療)3)」等)を熟読すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心機能障害のある患者
心機能障害が増悪するおそれがある。
9.1.2 肺障害のある患者
肺障害が増悪するおそれがある。
9.1.3 感染症を合併している患者
感染症が増悪し致命的となることがある。[11.1.2参照]
9.2 腎機能障害患者
腎機能障害が増悪するおそれがある。
9.3 肝機能障害患者
9.4 生殖能を有する者
9.4.1 妊娠可能な女性に対して、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.4.2 パートナーが妊娠する可能性のある男性に対して、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[15.2.1参照]
9.4.3 小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。ヒト乳汁中への移行については不明である。また、非臨床試験等のデータはなく、ヒトで哺乳中の児における影響は不明である。[15.2.1参照]
9.7 小児等
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.2 感染症(22.5%)、出血(頻度不明)等
11.1.3 ショック、アナフィラキシー(頻度不明)
11.1.4 痙攣(頻度不明)
11.1.5 肺胞出血・喀血(2.1%)、急性呼吸窮迫症候群(1.6%)、間質性肺炎(1.1%)、呼吸不全(1.1%)
11.1.6 心筋症(頻度不明)
11.1.7 胃腸障害
口内炎・舌炎(84.0%)、嘔吐(71.1%)、悪心(68.4%)、食欲不振(56.1%)、下痢・軟便(54.5%)が高頻度にあらわれる。
注)同種・自家移植を対象とした国内第II相試験(KRN246/01-A01)、自家移植を対象とした海外第II相試験(OMC-BUS-3)、同種移植を対象とした海外第II相試験(OMC-BUS-4)及び小児における同種・自家移植を対象とした海外第II相試験(F60002IN101G0)の集計。
11.2 その他の副作用
| 20%以上 | 5〜20%未満 | 5%未満 | 頻度不明 | |
| 肝臓 | ALT上昇(32.1%)、ビリルビン上昇、AST上昇 | γ-GTP上昇、Al-P上昇、肝腫大 | LDH上昇、肝機能異常、黄疸、肝臓痛、門脈圧亢進症、門脈狭窄 | |
| 血液 | 発熱性好中球減少症 | APTT延長、脾腫、FDP上昇、プロトロンビン時間延長、アンチトロンビンIII低下、凝血異常、血栓性微小血管症、血中フィブリノゲン上昇、血中フィブリノゲン低下、白血球増多、有熱性骨髄無形成 | ||
| 免疫 | 移植片対宿主病 | 免疫グロブリン低下、生着症候群、骨髄移植拒絶反応 | ||
| 呼吸器 | 咽喉頭疼痛、鼻出血 | 咽頭紅斑、咳嗽、呼吸困難、ラ音、鼻閉、胸水、鼻漏、咽喉頭不快感、呼吸音減弱、咽喉乾燥、上気道炎、鼻乾燥、頻呼吸、副鼻腔うっ血、副鼻腔不快感、無気肺、嗄声、嚥下性肺炎 | ||
| 循環器 | 頻脈、血圧上昇、血圧低下、起立性低血圧、心拡大、徐脈 | |||
| 消化器 | 腹痛 | 消化不良、肛門周囲の異常、腹水 | 腹部膨満、吐血、しゃっくり、舌苔、腹部不快感、便秘、痔核、食道炎、直腸炎、嚥下障害、口腔内痛、口腔粘膜出血、唾液過多、胃炎、鼓腸、直腸出血、マロリー・ワイス症候群、メレナ、胃酸過多、胃前庭部毛細血管拡張症、胃腸出血、口内乾燥、口内水疱、歯肉出血、出血性胃炎、食道痛、食道不快感、蛋白漏出性胃腸症、腸炎、腸雑音異常、裂肛、膵炎 | |
| 精神・神経系 | 頭痛、情動不安、めまい | 不眠症、錯乱状態、振戦、しびれ感、悪夢、肝性脳症、激越、失見当識、脳出血、譫妄 | ||
| 腎臓・泌尿器 | 血清クレアチニン上昇、乏尿 | 血尿、出血性膀胱炎、排尿困難、BUN上昇、腎機能障害、蛋白尿、膀胱炎、BUN低下、前立腺炎、多尿、尿意切迫、尿閉、膀胱痛 | ||
| 皮膚 | 脱毛、発疹、紅斑、皮下出血 | 色素沈着、そう痒症、皮膚落屑、皮膚障害、皮脂欠乏症、皮膚乾燥 | ||
| 代謝 | 血清マグネシウム低下、血清カリウム低下 | 血糖上昇、血清カルシウム低下、血清アルブミン低下、血清リン低下 | 血清総蛋白低下、体液貯留、血清ナトリウム低下、血清リン上昇、血清カリウム上昇、トリグリセリド上昇、血清クロル上昇、血清クロル低下、血清ナトリウム上昇、脱水、電解質失調、尿酸上昇 | |
| 筋骨格 | 関節痛、筋痛、背部痛、筋痙攣、四肢痛、頸部痛、顎痛、顔面痛、骨痛、殿部痛 | |||
| 感覚器 | 味覚異常 | 口内異常感、耳痛、耳鳴 | ||
| 眼 | 霧視、角膜炎、眼そう痒、眼球乾燥、眼充血、眼瞼炎、強膜浮腫、結膜炎、結膜出血、羞明 | |||
| その他 | 発熱(38.5%)、倦怠感 | 浮腫、脱力、体重増加 | 体重減少、ほてり・潮紅、悪寒、CRP上昇、不正子宮出血、灼熱感、膣出血、圧迫感、胸痛、胸部不快感、粘膜過形成、白血球Al-P上昇、冷感、疼痛 | 無月経、早発閉経、卵巣機能不全、卵巣障害、性腺機能低下、乏精子症、無精子症、精巣萎縮 |
13. 過量投与
13.1 処置
ブスルファンは透析により除去可能であるとの報告があることから、過量投与の場合透析を考慮すること12)。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は細胞毒性を有するため、調製時には手袋、マスク、防護メガネ等を着用し、十分に注意すること。皮膚、粘膜、眼等に本溶液が付着した場合には、直ちに多量の流水でよく洗うこと。
14.1.2 本剤は10倍量の生理食塩液又は5%ブドウ糖液に添加し、十分に混和して使用すること。
14.1.3 本剤は希釈後、安定性が低下するので、室温(約25℃)で用時調製し、調製から8時間以内に投与を終了すること。
14.1.4 調製後に混濁又は結晶が認められる場合は使用しないこと。
14.1.5 ポリカーボネート製の容器・シリンジ等及びポリエーテルスルホン製のシリンジフィルターは使用しないこと。
14.2 薬剤投与時の注意
14.2.1 他の注射剤との配合又は混注は行わないこと。
14.2.2 インラインフィルターを用いて、又は点滴用セットにフィルターを装着して本剤を投与する場合は、ポリエーテルスルホン製、ポリスルホン製又はポリエステル製のフィルターを使用すること。
14.2.3 ポリカーボネート製の三方活栓や延長チューブ等を使用した場合、そのコネクター部分にひび割れが発生し、血液及び薬液漏れ、空気混入等の可能性があるので注意すること。
14.2.4 直接末梢静脈に投与すると薬液の漏出による局所の組織障害を起こすことがあるので、必ず中心静脈からの点滴静脈内投与とし、皮下、筋肉内には投与しないこと。
中心静脈カテーテルを留置して投与すること。
中心静脈カテーテルを留置して投与すること。
14.2.5 本剤の投与においては希釈調製された全量が1回2時間(A法及びC法)又は1回3時間(B法及びD法)で投与されるよう、持続注入ポンプを用いて点滴静脈注射すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 添加剤であるN,N-ジメチルアセトアミド(DMA)は、海外臨床試験において、肝トランスアミナーゼの上昇を伴う肝毒性及び幻覚等の神経毒性が報告されている13)。
15.1.2 ブスルファンを投与した患者に二次発がんが認められたとの報告がある14)。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回及び反復投与
(1)成人
悪性腫瘍患者に、1回0.8mg/kgの用量で6時間毎に1日4回、4日間静脈内投与した時、血漿中未変化体濃度は、投与時間の経過とともに上昇し、投与終了直前でCmaxが観察され、投与終了後速やかに減少した(図16-1)。
図16-1 血漿中ブスルファン濃度の推移(平均値±標準偏差)
(2)小児
・悪性腫瘍又は非悪性腫瘍患者に、1回0.8〜1.2mg/kgの用量で6時間毎に1日4回、4日間静脈内投与した時、血漿中未変化体濃度を用いて算出した薬物動態パラメータは表16-2のとおりである。反復投与による薬物動態の変動はみられなかった18)(外国人データ)。
| 体重 | 投与量(mg/kg) | 例数 | 投与回数 | t1/2(hr) | AUC(μmol・min/L) | CL/ABWa)(mL/min/kg) | Vz/ABWb)(L/kg) |
| 体重<9kg | 1.0 | 8 | 1回目 | 2.08±0.242 | 1132±263 | 3.74±0.734 | 0.68±0.182 |
| 9回目 | 2.36±0.357 | 1270±253 | 3.30±0.559 | 0.68±0.182 | |||
| 13回目 | 2.35±0.263 | 1292±375 | 3.33±0.742 | 0.68±0.182 | |||
| 9kg≦体重<16kg | 1.2 | 14 | 1回目 | 1.98±0.284 | 1152±176 | 4.31±0.693 | 0.73±0.079 |
| 9回目 | 2.18±0.300 | 1269±204 | 3.92±0.658 | 0.73±0.079 | |||
| 13回目 | 2.19±0.409 | 1277±248 | 3.93±0.744 | 0.73±0.079 | |||
| 16kg≦体重≦23kg | 1.1 | 14 | 1回目 | 2.27±0.277 | 1171±177 | 3.89±0.524 | 0.76±0.066 |
| 9回目 | 2.46±0.385 | 1273±234 | 3.61±0.597 | 0.76±0.066 | |||
| 13回目 | 2.51±0.426 | 1301±272 | 3.56±0.627 | 0.76±0.066 | |||
| 23kg<体重≦34kg | 0.95 | 6 | 1回目 | 2.27±0.246 | 1110±64 | 3.42±0.108 | 0.67±0.069 |
| 9回目 | 2.52±0.291 | 1230±97 | 3.09±0.170 | 0.67±0.069 | |||
| 13回目 | 2.61±0.234 | 1281±104 | 2.97±0.201 | 0.67±0.069 | |||
| 体重>34kg | 0.8 | 13 | 1回目 | 2.67±0.401 | 1213±178 | 2.73±0.398 | 0.62±0.053 |
| 9回目 | 2.93±0.513 | 1323±177 | 2.49±0.298 | 0.62±0.053 | |||
| 13回目 | 2.95±0.508 | 1338±215 | 2.49±0.377 | 0.62±0.053 |
・小児に、1回3.2〜4.8mg/kgの用量で24時間毎に1日1回静脈内投与した時の薬物動態の成績は得られていないが、シミュレーションに基づく薬物動態パラメータの推定値は表16-3のとおりである19)。
| 1日1回投与 | 1日4回投与 | |||
| 体重 | 1回投与量(mg/kg) | AUCss,24ha)(μmol・min/L) | 1回投与量(mg/kg) | AUCss,24hb)(μmol・min/L) |
| 体重<9kg | 4.0 | 3446±1167 | 1.0 | 3443±1166 |
| 9kg≦体重<16kg | 4.8 | 5445±1971 | 1.2 | 5438±1968 |
| 16kg≦体重≦23kg | 4.4 | 5811±2173 | 1.1 | 5804±2170 |
| 23kg<体重≦34kg | 3.8 | 4236±1582 | 0.95 | 4231±1580 |
| 体重>34kg | 3.2 | 4345±1573 | 0.8 | 4341±1572 |
16.4 代謝
17. 臨床成績
17.1 有効性及び安全性に関する試験
<同種造血幹細胞移植の前治療>
17.1.1 国内第II相試験
・造血器腫瘍患者28例(小児3例を含む)を対象とした非盲検試験において、本剤0.8mg/kgを点滴静注により6時間毎に計16回、移植施行日(day0)のday-7からday-4に4日間連日投与し、その後シクロホスファミド60mg/kgを1日1回、day-3からday-2に2日間連日投与した後(BU/CY2レジメン)、day0に造血幹細胞が輸注された。27例中8例が非血縁ドナーからの移植であったほかは、血縁ドナーからの移植であった。HLA適合度は、血清型では全例一致していたが、1例のみ遺伝子型一座不一致非血縁ドナーからの移植であった。また、27例中10例が末梢血幹細胞移植であり、その他の症例は骨髄移植であった。
同種移植における患者背景を表17-1、主要な有効性に関する臨床試験成績を表17-2に示す16)。
| 原疾患 | 同種移植 |
| 合計(%) | 27(100) |
| 急性白血病 | 16(59.3) |
| 慢性骨髄性白血病 | 5(18.5) |
| 悪性リンパ腫 | 3(11.1) |
| 骨髄異形成症候群 | 3(11.1) |
| 同種移植 | |
| 骨髄抑制率 | 100%(27/27例) |
| 生着率 | 96.3%(26/27例) |
| 生着日数a) | 14日(9〜20日) |
| 100日生存率b) | 96.0% |
副作用発現頻度は、27例中27例(100%)であった。主な副作用は、嘔吐18例(66.7%)、下痢18例(66.7%)、悪心17例(63.0%)、口内炎17例(63.0%)、食欲不振17例(63.0%)及び倦怠感14例(51.9%)であった。[7.2参照]
・同試験に組み入れられた18歳未満の小児3例の試験成績を表17-3に示す16)。本試験での本剤の投与量は、0.8mg/kg/回であった。
| 原疾患 | 体重 | 移植種 | 骨髄抑制 | 生着日数b) | 生存日数d) |
| 急性骨髄性白血病 | 43.2kg | 同種移植 | −3日 | 13日 | 50日+ |
| 急性骨髄性白血病 | 17.8kga) | 同種移植 | 0日 | 15日 | 100日+ |
| 慢性骨髄性白血病 | 46.7kg | 同種移植 | 2日 | −c) | 28日+ |
骨髄移植拒絶反応(生着不全)が重篤な副作用として3例中1例(33.3%)に認められた。[7.2参照]
17.1.2 海外第II相試験
造血器腫瘍患者61例を対象とした非盲検試験において、本剤の有効成分であるブスルファン0.8mg/kgを点滴静注により6時間毎に計16回、移植施行日(day0)のday-7からday-4に4日間連日投与し、その後シクロホスファミド60mg/kgを1日1回、day-3からday-2に2日間連日投与した後(BU/CY2レジメン)、day0に造血幹細胞が輸注された。全例とも血縁ドナーからの移植であり、HLA適合度は、血清型では全例一致していた。また、61例中34例が末梢血幹細胞移植であり、その他の症例は骨髄移植であった。
同種移植における患者背景を表17-4、主要な有効性に関する臨床試験成績を表17-5に示す17)。
| 原疾患 | 同種移植 |
| 合計(%) | 61(100) |
| 急性白血病 | 26(42.6) |
| 慢性骨髄性白血病 | 17(27.9) |
| 悪性リンパ腫 | 9(14.8) |
| 骨髄異形成症候群 | 9(14.8) |
| 同種移植 | |
| 骨髄抑制率 | 100%(61/61例) |
| 生着率 | 98.4%(60/61例) |
| 生着日数a) | 13日(9〜29日) |
| 100日生存率b) | 81.5% |
副作用発現頻度は、61例中61例(100%)であった。主な副作用は、嘔気57例(93.4%)、白血球減少症56例(91.8%)、血小板減少症55例(90.2%)、嘔吐54例(88.5%)、貧血53例(86.9%)、粘膜の炎症49例(80.3%)、食欲不振40例(65.6%)、下痢38例(62.3%)、顆粒球減少症32例(52.5%)及び低マグネシウム血症32例(52.5%)であった。[7.2参照]
<同種造血幹細胞移植の前治療、ユーイング肉腫ファミリー腫瘍及び神経芽細胞腫における自家造血幹細胞移植の前治療>
17.1.3 海外第II相試験
造血器腫瘍患者58例(同種及び自家造血幹細胞移植:年齢0〜18歳未満)を対象とし本剤の目標AUC値を900〜1350μmol・min/Lと設定し、シクロホスファミド又はメルファランを併用した前治療の非盲検試験が実施された。
同種移植は、28例中5例が非血縁ドナーからの移植であったほかは、血縁ドナーからの移植であった。HLA適合度は、26例で一致していたが、1例が二座不一致血縁ドナーであり、残る1例は一座不一致非血縁ドナーからの移植であった。
同種移植では、本剤の有効成分であるブスルファン0.8〜1.2mg/kg(承認用法・用量と同一の体重別投与量設定)を点滴静注により6時間毎に計16回、移植施行日(day0)のday-9からday-6に4日間連日投与し、その後シクロホスファミド50mg/kgを1日1回、day-5からday-2に4日間連日投与した後(BU/CY4レジメン)、day0に造血幹細胞が輸注された。自家移植では、ブスルファン0.8〜1.2mg/kg(承認用法・用量と同一の体重別投与量設定)を点滴静注により6時間毎に計16回、移植施行日(day0)のday-6からday-3に4日間連日投与し、その後メルファラン140mg/m2を1回、day-1に投与した後(BU/L-PAMレジメン)、day0に造血幹細胞が輸注された。同種移植では28例中27例が骨髄移植であり、残る1例は末梢血幹細胞移植であった。自家移植では全例が末梢血幹細胞移植であった。
本試験の患者背景を表17-6、主要な有効性に関する臨床試験成績を表17-7に示す18)。
なお、自家移植27例の観察期間中央値は16.9ヵ月(範囲:5.4〜26.5ヵ月)であり、神経芽細胞腫24例での2年再発率注)及び無事象生存率注)は、それぞれ31%及び50%、ユーイング肉腫ファミリー腫瘍3例での1年再発率注)及び無事象生存率注)は、0%及び67%であった。
なお、自家移植27例の観察期間中央値は16.9ヵ月(範囲:5.4〜26.5ヵ月)であり、神経芽細胞腫24例での2年再発率注)及び無事象生存率注)は、それぞれ31%及び50%、ユーイング肉腫ファミリー腫瘍3例での1年再発率注)及び無事象生存率注)は、0%及び67%であった。
注)Kaplan-Meier推定
| 原疾患 | 同種移植 | 自家移植 |
| 合計(%) | 28(100) | 27(100) |
| 急性骨髄性白血病 | 14(50.0) | − |
| 急性リンパ性白血病 | 1(3.6) | − |
| 慢性骨髄性白血病 | 3(10.7) | − |
| 骨髄異形成症候群 | 1(3.6) | − |
| 鎌状赤血球症 | 5(17.9) | − |
| サラセミア | 1(3.6) | − |
| Wiskott-Aldrich症候群 | 2(7.1) | − |
| 白血球接着不全症 | 1(3.6) | − |
| 神経芽細胞腫 | − | 24(88.9) |
| ユーイング肉腫 | − | 3(11.1) |
| 同種移植 | 自家移植 | |
| 骨髄抑制率 | 100%(28/28例) | 100%(27/27例) |
| 生着率 | 100%(28/28例) | 100%(27/27例) |
| 生着日数a) | 21日(12〜47日) | 11日(10〜15日) |
| 100日生存率b) | 100% | 100% |
18. 薬効薬理
18.1 作用機序
細胞内に取り込まれた後にDNA鎖間又はDNA鎖内架橋形成などを介して細胞増殖を抑制し、骨髄抑制作用や抗腫瘍作用を示す。
18.2 骨髄抑制作用
18.3 抗腫瘍作用
19. 有効成分に関する理化学的知見
19.1. ブスルファン
22. 包装
10mL×1バイアル
23. 主要文献
- 医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:ブスルファン(新用法・用量の追加), (要望番号;III-[1]-61)
- 医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:ブスルファン(新用法・用量の追加), (要望番号;III-[1]-60)
- 医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:ブスルファン(悪性リンパ腫における自家造血幹細胞移植の前治療)
- Bishop,J.B.et al., Mutat Res., 168 (1), 15-45, (1986) »PubMed
- Nishimura,S.et al., Eur J Cancer Care., 22 (3), 353-360, (2013)
- Dai,Q.Y.et al., Bone Marrow Transplant., 34 (8), 667-673, (2004) »PubMed
- Buggia,I.et al., Anticancer Res., 16 (4A), 2083-2088, (1996) »PubMed
- Nilsson,C.et al., Bone Marrow Transplant., 31 (6), 429-435, (2003) »PubMed
- Sweiss,K.et al., Bone Marrow Transplant., 47 (2), 315-316, (2012) »PubMed
- Kwiatkowski,J.et al., Ann Pharmacother., 52 (5), 497-498, (2018) »PubMed
- Santos,G.W., Bone Marrow Transplant., 4 (Suppl.1), 236-239, (1989)
- Stein,J.et al., Bone Marrow Transplant., 27 (5), 551-553, (2001) »PubMed
- Weiss,A.J.et al., Cancer Chemother Rep., 16, 477-485, (1962) »PubMed
- IARC Monographs., (Suppl.7), 137-139, (1987)
- Kennedy,G.L.Jr., Critical Rev Toxicol., 17 (2), 129-182, (1986)
- 社内資料:国内臨床試験成績(2006年10月20日承認、CTD2.7.6.2)
- Andersson,B.S.et al., Biol Blood Marrow Transplant., 8 (3), 145-154, (2002) »PubMed
- 社内資料:海外臨床試験(小児)成績(2006年10月20日承認、CTD2.7.6.2)
- 社内資料:ブスルファンの小児生理学的薬物速度論モデル解析
- Diestelhorst,C.et al., Cancer Chemother Pharmacol., 72 (5), 991-1000, (2013)
- Diestelhorst,C.et al., Pediatr Hematol Oncol., 31 (8), 731-742, (2014) »PubMed
- Hassan,M.et al., Drug Metab Dispos., 15 (3), 399-402, (1987) »PubMed
- Hassan,M.et al., Eur J Clin Pharmacol., 36 (5), 525-530, (1989) »PubMed
- Gibson,F.M.et al., Int J Exp Pathol., 84 (1), 31-47, (2003) »PubMed
- Fried,W.et al., Exp Hematol., 13 (Suppl.16), 49-56, (1985)
- Hoffman,R.et al., Br J Cancer., 59 (3), 347-348, (1989) »PubMed
- Sanderson,B.J.S.et al., Environ Mol Mutagen., 17 (4), 238-243, (1991) »PubMed
- Teicher,B.A.et al., Cancer Res., 46 (9), 4379-4383, (1986) »PubMed
- Pacheco,D.Y.et al., Cancer Res., 50 (23), 7555-7558, (1990) »PubMed
- Fichtner,I.et al., Eur J Cancer., 39 (6), 801-807, (2003) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
製品情報問い合わせ先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
26. 製造販売業者等
26.1 製造販売元
大塚製薬株式会社
東京都千代田区神田司町2-9