医薬品情報
| 総称名 | アズマネックス |
|---|---|
| 一般名 | モメタゾンフランカルボン酸エステル |
| 欧文一般名 | Mometasone Furoate |
| 製剤名 | モメタゾンフランカルボン酸エステルドライパウダーインヘラー |
| 薬効分類名 | 吸入ステロイド喘息治療剤 |
| 薬効分類番号 | 2290 |
| ATCコード | R03BA07 |
| KEGG DRUG |
D00690
モメタゾンフランカルボン酸エステル
|
| KEGG DGROUP |
DG00419
モメタゾン
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年8月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アズマネックスツイストヘラー100μg60吸入 | ASMANEX Twisthaler 100μg 60doses | オルガノン | 2290703G1020 | 1087.6円/キット | 処方箋医薬品 |
| アズマネックスツイストヘラー200μg60吸入 | ASMANEX Twisthaler 200μg 60doses | オルガノン | 2290703G2026 | 1366.9円/キット | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 有効な抗菌剤の存在しない感染症、深在性真菌症の患者[症状を増悪させるおそれがある。]
2.2 本剤の成分に対して過敏症の既往歴のある患者
2.3 デスモプレシン酢酸塩水和物(男性における夜間多尿による夜間頻尿)を投与中の患者[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤は急性の発作に対して使用しないこと。[8.1参照]
5.2 本剤の投与開始前には、患者の喘息症状を比較的安定な状態にしておくこと。特に、喘息発作重積状態又は喘息の急激な悪化状態のときには原則として本剤は使用しないこと。
6. 用法及び用量
通常、成人にはモメタゾンフランカルボン酸エステルとして1回100μgを1日2回吸入投与する。
なお、年齢、症状により適宜増減するが、1日の最大投与量は800μgを限度とする。
なお、年齢、症状により適宜増減するが、1日の最大投与量は800μgを限度とする。
7. 用法及び用量に関連する注意
7.1 症状の緩解がみられた場合は、治療上必要最小限の用量で投与すること。[8.4参照]
8. 重要な基本的注意
8.1 本剤は気管支拡張剤や全身性ステロイド剤のように既に起きている発作を速やかに軽減する薬剤ではないので、毎日規則正しく使用すること。[5.1参照]
8.2 本剤の投与期間中に発現する急性の発作に対しては、発作発現時に短時間作動型吸入β2刺激薬等の他の適切な薬剤を使用するよう患者に注意を与えること。また、その薬剤の使用量が増加したり、ピークフロー値が低下するなど効果が十分でなくなってきたと感じられたら、喘息の管理が十分でないことが考えられるため、可及的速やかに医療機関を受診し治療を求めるように患者に注意を与えるとともに、そのような状態がみられた場合には、生命を脅かす可能性があるので、本剤の増量あるいは気管支拡張剤・全身性ステロイド剤を短期間併用し、症状の軽減にあわせて併用薬剤を徐々に減量すること。
8.3 本剤の投与を突然中止すると喘息の急激な悪化を起こすことがあるので、投与を中止する場合には患者の喘息症状を観察しながら徐々に減量していくこと。
8.4 全身性ステロイド剤と比較し可能性は低いが、吸入ステロイド剤の投与により全身性の作用(クッシング症候群、クッシング様症状、副腎皮質機能抑制、小児の成長遅延、骨密度の低下、白内障、緑内障を含む)が発現する可能性があるので、吸入ステロイド剤の投与量は患者毎に喘息をコントロールできる最少用量に調節すること。
国内臨床試験においては本剤の1日最大用量(800μg/日)を長期投与した場合の安全性についての情報は限られており、また、日本人に本剤800μg/日を反復投与したときのCmax、AUCは外国人と比べて高かったとの報告があることから、本剤の1日最大用量投与時には患者の状態を十分に観察しながら投与を行うこと。
特に長期間、大量投与の場合には定期的に検査を行い、全身性の作用が認められた場合には患者の喘息症状を観察しながら徐々に減量するなど適切な処置を行うこと。[7.1、16.1.2参照]
国内臨床試験においては本剤の1日最大用量(800μg/日)を長期投与した場合の安全性についての情報は限られており、また、日本人に本剤800μg/日を反復投与したときのCmax、AUCは外国人と比べて高かったとの報告があることから、本剤の1日最大用量投与時には患者の状態を十分に観察しながら投与を行うこと。
特に長期間、大量投与の場合には定期的に検査を行い、全身性の作用が認められた場合には患者の喘息症状を観察しながら徐々に減量するなど適切な処置を行うこと。[7.1、16.1.2参照]
8.5 全身性ステロイド剤の減量は本剤の吸入開始後、症状の安定をみて徐々に行うこと。減量にあたっては一般のステロイド剤の減量法に準ずる。急激な減量により、抑制されていた既存のアレルギーが顕在化される可能性があるので、症状が出現した場合、適切な処置を行うこと。
8.6 一般的に吸入ステロイド剤投与後に、潜在していた基礎疾患である好酸球性多発血管炎性肉芽腫症にみられる好酸球増多症がまれにあらわれることがある。この症状は通常、全身性ステロイド剤の減量並びに離脱に伴って発現しており、吸入ステロイド剤との直接的な因果関係は確立されていない。本剤の投与期間中は、好酸球数の推移や、他の好酸球性多発血管炎性肉芽腫症の症状(しびれ、発熱、関節痛、肺の浸潤等の血管炎症状等)に注意すること。
8.7 全身性ステロイド剤の減量並びに離脱に伴って、鼻炎、湿疹、じん麻疹、眩暈、動悸、倦怠感、うつ、顔のほてり、結膜炎等の症状が発現・増悪することがあるので、このような症状があらわれた場合には適切な処置を行うこと。
8.8 ステロイド剤又は他の免疫抑制剤の投与により、水痘、麻疹等の感染症があらわれる可能性があるので、定期的に医師の診察を受けるよう患者に注意を与えること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 結核性疾患の患者
症状を増悪させるおそれがある。
9.1.2 感染症(有効な抗菌剤の存在しない感染症、深在性真菌症を除く)の患者
症状を増悪させるおそれがある。
9.1.3 気管支粘液の分泌が著しい患者
本剤の肺内での作用を確実にするため本剤の吸入に先立って、分泌がある程度減少するまで他剤を使用するとよい。
9.1.4 長期又は大量の全身性ステロイド療法を受けている患者、あるいは全身性ステロイド剤から吸入ステロイド剤に切り替えた患者
全身性ステロイド剤の減量中並びに離脱後も副腎皮質機能検査を行い、外傷、手術、重症感染症等の侵襲には十分に注意を払うこと。また、必要があれば一時的に全身性ステロイド剤の増量を行い、患者の全身状態を観察しながら、症状の改善に伴い徐々に減量していくこと。これらの患者では副腎皮質機能不全となっていることが考えられる。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。経皮又は経口投与による動物実験(ラット、ウサギ)で催奇形性作用が報告されている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。経口投与による動物実験(ラット)で乳汁中に移行することが報告されている2)。
9.7 小児等
国内において、小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
相互作用序文
本剤の代謝には肝代謝酵素CYP3A4が関与している。[16.4参照]
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| デスモプレシン酢酸塩水和物 ミニリンメルト (男性における夜間多尿による夜間頻尿) [2.3参照] | 低ナトリウム血症が発現するおそれがある。 | 機序不明 |
10.2 併用注意
| CYP3A4酵素阻害作用を有する薬剤 イトラコナゾール リトナビル等 [16.7.1参照] | 副腎皮質ステロイド剤を全身投与した場合と同様の症状があらわれる可能性がある。 | CYP3A4による本剤の代謝が阻害されることにより、本剤の血中濃度が上昇する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
アナフィラキシー(呼吸困難、全身潮紅、血管浮腫、じん麻疹等)があらわれることがある。
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒 | ||
| 口腔並びに呼吸器 | 口腔カンジダ症(6.0%)、嗄声(5.7%)、咽喉頭症状(不快感、疼痛、乾燥、刺激感) | 味覚異常、口内炎、咳嗽、発声困難、咽頭炎、気管支喘息の増悪 | |
| 肝臓 | ALT上昇、Al-P上昇、LDH上昇 | ||
| 精神神経系 | 頭痛 | ||
| 眼 | 白内障 | 緑内障、眼圧亢進、霧視、中心性漿液性網脈絡膜症 | |
| 血液 | 白血球増多、好中球増多、リンパ球減少 | ||
| その他 | 不正出血、オステオカルシン減少(4.5%)、コルチゾール減少(6.4%)、尿糖 | 帯状疱疹、月経異常、血圧上昇、蛋白尿 |
13. 過量投与
13.1 症状
長期間の過量投与により、副腎皮質系機能抑制があらわれることがある。この抑制が長期にわたった場合、副腎皮質ステロイド剤を全身投与した場合と同様な症状があらわれることがある。
13.2 処置
全身性ステロイド療法を中止する手順で本剤を徐々に減量すること。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 患者には添付の携帯袋及び使用説明書を渡し、以下の使用方法と注意事項を説明すること。
14.1.2 吸入前
(1)本剤は防湿のためにアルミ包装されているので、使用開始直前にアルミ包装を開封する。
(2)本剤には残量計がついており、その目盛は残りのキャップ開閉操作の可能回数を示している。残量計の目盛が“01”から“00”に変わると、使用できなくなる。
14.1.3 吸入時
本剤は口腔からの吸入投与にのみ使用する。
14.1.4 吸入後
局所的な副作用(口腔カンジダ症又は嗄声等)を予防するため、本剤吸入後に、うがいを実施する。ただし、うがいが困難な場合には、口腔内をすすぐ。
14.1.5 保管時
(1)アルミ包装開封後は、防湿のため、使用時以外はキャップを閉めておく。
(2)マウスピース(吸入口)は常に清浄な乾燥状態を保つために、使用後に乾いた布かティッシュペーパー等で拭く。(水で洗ったり、湿ったもので拭いたりしない。)
(3)本剤はキャップ開閉の一連の操作により次回吸入分の薬剤を充填する構造になっているので、使用後はキャップを完全に閉める。また、本剤は吸入の有無にかかわらず、キャップ開閉操作を60回行うとキャップがロックされ使用できなくなるので、吸入時以外はキャップを開閉しない。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性(日本人各群6例)に本剤100〜1,200μg注1)を単回吸入投与したとき、400μg以下の投与量では血漿中モメタゾンフランカルボン酸エステルの濃度は極めて低く、薬物動態パラメータを算出することは不可能であった。800〜1,200μgの用量範囲では、投与量の増加に応じてAUCの上昇が確認された3)。
| 投与量(μg) | tmax(hr) | Cmax(pg/mL) | AUC0-t(pg・hr/mL) |
| 800 | 2.50(40) | 178(34) | 1,018(48) |
| 1,000 | 2.33(22) | 356(48) | 1,993(48) |
| 1,200 | 2.92(27) | 342(23) | 2,905(41) |
16.1.2 反復投与
16.3 分布
16.3.1 血漿蛋白結合率
99.0%〜99.5%6)(in vitro)
16.4 代謝
16.5 排泄
健康成人男性(外国人6例)に3H-モメタゾンフランカルボン酸エステル約971μg注1)を単回吸入投与したとき、放射能は主に糞中に排泄され(73.5%)、尿中放射能排泄率は7.57%であった7)。
16.7 薬物相互作用
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相比較試験
中等症の気管支喘息患者200例を対象に、フルチカゾンプロピオン酸エステルドライパウダー剤(FP-DPI)を対照薬とした非盲検比較試験において、本剤1日量200μgを1日2回又はFP-DPI 1日量200μgを1日2回、8週間投与したとき、起床時ピークフロー(PEF)値の投与前値からの変化量は次のとおりであった。本試験の結果、起床時PEF値の最終評価時における変化量において本剤の対照薬に対する非劣性が検証された(非劣性マージンΔ=20L/min)9)。
| 投与群 | 変化量†(L/min) | 対照薬との差と95%両側信頼区間 |
| 本剤 (n=99) | 8.2±3.1 | 2.6 [−6.0,11.3] |
| 対照薬(FP-DPI) (n=101) | 5.5±3.1 |
本剤における副作用は、99例中28例(28.3%)に認められた。主なものは、オステオカルシン減少7例(7.1%)、発声障害5例(5.1%)、血中LDH増加3例(3.0%)であった。
17.1.2 国内長期投与試験
各種吸入ステロイド剤を4週間以上使用している中等症の気管支喘息患者199例に、本剤1日量400μgを1日2回にて12週間投与後、さらに症状に応じて本剤1日量200μg又は400μgを1日2回にて40週間、計52週間投与したとき、起床時及び夜のPEF値の投与前値からの変化量は、下図のとおりであった10)。
図 起床時及び夜のPEF値の投与前値からの変化量の推移
副作用は、203例中83例(40.9%)に認められた。主なものは、口腔カンジダ症25例(12.3%)、発声障害16例(7.9%)、血中コルチゾール減少12例(5.9%)、オステオカルシン減少11例(5.4%)であった。
18. 薬効薬理
18.1 作用機序
モメタゾンフランカルボン酸エステルは抗アレルギー作用及び抗炎症作用を有する。気管内投与により抗原誘発喘息モデルにおいて喘息反応抑制作用を示した。ヒトのヘルパーT(Th)細胞からのインターロイキン-4(IL-4)及びIL-5産生(Th2細胞の活性化)を抑制した11)(in vitro)。皮下投与により能動感作マウスのIgE及びIgG1抗体産生を抑制した12)(in vivo)。ラット好酸球の走化性因子による遊走能を低下させた13)(in vitro)。さらに、能動感作マウスにおいて、抗原惹起による気管支肺胞洗浄液又は肺組織中における好酸球等の炎症細胞数増加、肺組織におけるIL-4及びIL-5のmRNA発現に対して、吸入投与により抑制作用を示した14)(in vivo)。
18.2 喘息反応抑制作用
モメタゾンフランカルボン酸エステルは能動感作ラットの抗原誘発気道狭窄反応に対して、気管内投与により抑制作用を示した15)(in vivo)。
18.3 局所抗炎症作用
モメタゾンフランカルボン酸エステルは亜急性炎症モデルであるマウスクロトン油耳浮腫に対して、局所投与により抑制作用を示し、その作用はベクロメタゾンプロピオン酸エステルよりも低用量で発現した16)(in vivo)。
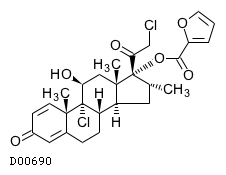
19. 有効成分に関する理化学的知見
19.1. モメタゾンフランカルボン酸エステル
22. 包装
<アズマネックスツイストヘラー100μg60吸入>
1本(60吸入、乾燥剤入り)×1
<アズマネックスツイストヘラー200μg60吸入>
1本(60吸入、乾燥剤入り)×1
23. 主要文献
- 社内資料:毒性試験(2009年7月7日承認、CTD2.6.6.1)
- 社内資料:薬物動態試験(2009年7月7日承認、CTD2.6.4.6)
- 社内資料:第I相単回投与試験(2009年7月7日承認、CTD2.7.2.2)
- 社内資料:喘息患者反復投与試験・国内(2009年7月7日承認、CTD2.7.2.2)
- 社内資料:喘息患者反復投与試験・海外(2009年7月7日承認、CTD2.7.2.2)
- 社内資料:薬物動態試験(2009年7月7日承認、CTD2.7.2.3)
- 社内資料:標識体体内動態試験(2009年7月7日承認、CTD2.7.2.3)
- 社内資料:ケトコナゾール併用試験(2009年7月7日承認、CTD2.7.2.2)
- 宮本昭正ほか, アレルギー・免疫, 16, 716-31, (2009)
- 宮本昭正ほか, アレルギー・免疫, 16, 732-45, (2009)
- Umland SP,et al., J Allergy Clin Immunol., 100, 511-9, (1997) »PubMed »DOI
- 社内資料:IgE抗体産生に及ぼす影響・マウス(2009年7月7日承認、CTD2.6.2.2)
- Sugimoto Y,et al., Int Immunopharmacol., 3, 845-52, (2003) »PubMed »DOI
- Chapman RW,et al., Arzneim-Forsch/Drug Res., 48, 384-91, (1998)
- 社内資料:喘息反応抑制作用・ラット(2009年7月7日承認、CTD2.6.2.2)
- 社内資料:局所抗炎症作用・マウス(2009年7月7日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
オルガノン株式会社
カスタマーサポートセンター
東京都港区南青山1-24-3
電話:フリーダイヤル 0120-095-213
製品情報問い合わせ先
オルガノン株式会社
カスタマーサポートセンター
東京都港区南青山1-24-3
電話:フリーダイヤル 0120-095-213
26. 製造販売業者等
26.1 製造販売元
オルガノン株式会社
東京都港区南青山1-24-3