医薬品情報
| 総称名 | タムスロシン塩酸塩 |
|---|---|
| 一般名 | タムスロシン塩酸塩 |
| 欧文一般名 | Tamsulosin Hydrochloride |
| 製剤名 | タムスロシン塩酸塩口腔内崩壊錠 |
| 薬効分類名 | 前立腺肥大症の排尿障害改善剤 |
| 薬効分類番号 | 2590 |
| ATCコード | G04CA02 |
| KEGG DRUG |
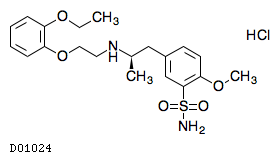
D01024
タムスロシン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年4月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| タムスロシン塩酸塩OD錠0.1mg「明治」 (後発品) | TAMSULOSIN HYDROCHLORIDE OD Tablets「MEIJI」 | Meiji Seikaファルマ | 2590008F1093 | 11.2円/錠 | 処方箋医薬品注) |
| タムスロシン塩酸塩OD錠0.2mg「明治」 (後発品) | TAMSULOSIN HYDROCHLORIDE OD Tablets「MEIJI」 | Meiji Seikaファルマ | 2590008F2090 | 15円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
前立腺肥大症に伴う排尿障害
5. 効能または効果に関連する注意
5.1 本剤による治療は原因療法ではなく、対症療法であることに留意し、本剤投与により期待する効果が得られない場合は、手術療法等、他の適切な処置を考慮すること。
5.2 前立腺肥大症の診断・診療については、国内外のガイドライン等の最新の情報を参考にすること。
6. 用法及び用量
通常、成人にはタムスロシン塩酸塩として0.2mgを1日1回食後に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
7. 用法及び用量に関連する注意
高齢者で腎機能が低下している場合は0.1mgから投与を開始し、経過を十分に観察した後に0.2mgに増量すること。0.2mgで期待する効果が得られない場合にはそれ以上の増量は行わず、他の適切な処置を行うこと。[9.8参照]
8. 重要な基本的注意
8.1 本剤の過剰投与により血圧低下が予想されるので、投与量には注意すること。
8.2 立位血圧が低下することがあるので、体位変換による血圧変化に注意すること。[9.1.1参照]
8.3 めまい等があらわれることがあるので、高所作業、自動車の運転等危険を伴う作業に従事する場合には注意させること。
8.4 本剤投与開始時に降圧剤投与の有無について問診を行い、降圧剤が投与されている場合には血圧変化に注意し、血圧低下がみられたときには、減量又は中止するなど適切な処置を行うこと。[10.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 起立性低血圧のある患者
症状が悪化するおそれがある。[8.2参照]
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
血漿中濃度が上昇するおそれがある。[16.6.1参照]
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
血漿中濃度が上昇するおそれがある。
9.8 高齢者
腎機能が低下していることがある。[7.、16.6.1参照]
10. 相互作用
10.2 併用注意
| 降圧剤 [8.4参照] | 起立性低血圧が起こるおそれがあるので、減量するなど注意すること。 | 降圧剤服用中の患者は起立時の血圧調節力が低下している場合がある。 |
| ホスホジエステラーゼ5阻害作用を有する薬剤 シルデナフィルクエン酸塩 バルデナフィル塩酸塩水和物 等 | 併用により症候性低血圧があらわれるとの報告がある。 | 本剤はα遮断作用を有するため、併用によりこれらの血管拡張作用による降圧作用を増強するおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 失神・意識喪失(頻度不明)
血圧低下に伴う一過性の意識喪失等があらわれることがある。
11.1.2 肝機能障害、黄疸(いずれも頻度不明)
AST上昇、ALT上昇、黄疸等があらわれることがある。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 精神神経系 | めまい、ふらふら感 | 立ちくらみ、頭痛、眠気、いらいら感、しびれ感 |
| 循環器 | 頻脈 | 血圧低下、起立性低血圧、動悸、不整脈 |
| 過敏症 | 発疹 | そう痒感、蕁麻疹、多形紅斑、血管浮腫 |
| 消化器 | 胃不快感、嘔気、嘔吐、胃重感、胃痛、食欲不振、嚥下障害 | 口渇、便秘、下痢 |
| その他 | 咽頭灼焼感、全身倦怠感 | 鼻閉、浮腫、尿失禁、味覚異常、女性化乳房、持続勃起症、射精障害、術中虹彩緊張低下症候群、霧視、視力障害、ほてり、熱感、灼熱感、胸部不快感 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は噛み砕かずに服用させること。本剤はタムスロシン塩酸塩の徐放性粒を含有しており、噛み砕いた際に徐放性粒が壊れ、薬物動態が変わる可能性がある。
14.1.3 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
14.1.4 本剤は寝たままの状態では、水なしで服用させないこと。
15. その他の注意
15.1 臨床使用に基づく情報
α1遮断薬を服用中又は過去に服用経験のある患者において、α1遮断作用によると考えられる術中虹彩緊張低下症候群(Intraoperative Floppy Iris Syndrome)があらわれるとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
16.1.2 生物学的同等性試験
タムスロシン塩酸塩OD錠0.1mg「明治」とハルナールD錠0.1mg又はタムスロシン塩酸塩OD錠0.2mg「明治」とハルナールD錠0.2mgを、クロスオーバー法によりそれぞれ2錠又は1錠(タムスロシン塩酸塩として0.2mg)健康成人男子に絶食時水あり、絶食時水なし及び食後水なしの条件下、単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、いずれもlog(0.80)〜log(1.25)の範囲内であり、それぞれ両剤の生物学的同等性が確認された3)4)。
<タムスロシン塩酸塩OD錠0.1mg「明治」>
図1 0.1mgOD錠2錠投与時の血漿中未変化体濃度推移(絶食時水あり服用)
図2 0.1mgOD錠2錠投与時の血漿中未変化体濃度推移(絶食時水なし服用)
図3 0.1mgOD錠2錠投与時の血漿中未変化体濃度推移(食後水なし服用)
| 被験者数 | 判定パラメータ | 参考パラメータ | |||||
| AUCt(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | ||||
| 絶食時 | 水あり服用 | タムスロシン塩酸塩OD錠0.1mg「明治」×2 | 20 | 90.0±31.2 | 8.18±1.96 | 3.8±0.9 | 7.1±1.7 |
| ハルナールD錠0.1mg×2 | 20 | 84.2±25.0 | 7.16±1.47 | 4.4±0.8 | 7.7±2.1 | ||
| 水なし服用 | タムスロシン塩酸塩OD錠0.1mg「明治」×2 | 20 | 114.2±41.3 | 9.79±2.95 | 4.2±1.3 | 8.1±2.0 | |
| ハルナールD錠0.1mg×2 | 20 | 101.2±32.3 | 8.30±2.35 | 4.8±1.2 | 8.2±1.8 | ||
| 食後 | タムスロシン塩酸塩OD錠0.1mg「明治」×2 | 18 | 81.1±26.4 | 6.25±1.78 | 6.2±1.7 | 7.9±2.1 | |
| ハルナールD錠0.1mg×2 | 18 | 81.3±29.9 | 5.69±1.52 | 6.7±1.7 | 8.7±2.3 | ||
<タムスロシン塩酸塩OD錠0.2mg「明治」>
図4 0.2mgOD錠1錠投与時の血漿中未変化体濃度推移(絶食時水あり服用)
図5 0.2mgOD錠1錠投与時の血漿中未変化体濃度推移(絶食時水なし服用)
図6 0.2mgOD錠1錠投与時の血漿中未変化体濃度推移(食後水なし服用)
| 被験者数 | 判定パラメータ | 参考パラメータ | |||||
| AUCt(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | ||||
| 絶食時 | 水あり服用 | タムスロシン塩酸塩OD錠0.2mg「明治」 | 20 | 97.6±28.0 | 8.89±2.35 | 4.2±1.1 | 7.5±1.7 |
| ハルナールD錠0.2mg | 20 | 93.1±25.0 | 7.85±2.13 | 4.6±0.9 | 8.3±1.9 | ||
| 水なし服用 | タムスロシン塩酸塩OD錠0.2mg「明治」 | 20 | 89.8±19.4 | 8.46±1.63 | 4.0±1.1 | 7.4±1.6 | |
| ハルナールD錠0.2mg | 20 | 85.7±25.6 | 7.51±1.65 | 4.4±1.0 | 8.4±2.1 | ||
| 食後 | タムスロシン塩酸塩OD錠0.2mg「明治」 | 20 | 79.2±18.4 | 6.01±1.33 | 7.2±2.0 | 8.0±2.5 | |
| ハルナールD錠0.2mg | 20 | 75.0±23.1 | 5.31±1.40 | 6.8±1.6 | 8.0±2.3 | ||
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
注)本剤の承認された1日用量は、0.2mgである。なお、年齢、症状により適宜増減する。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
尿道及び前立腺部のα1受容体を遮断することにより、尿道内圧曲線の前立腺部圧を低下させ、前立腺肥大症に伴う排尿障害を改善する。
18.2 ヒトでの作用
ヒト前立腺標本での受容体結合実験において、プラゾシン塩酸塩より2.2倍、フェントラミンメシル酸塩より40倍強いα1受容体遮断作用を示した10)(in vitro試験)。
18.3 動物での作用
18.3.1 交感神経α受容体遮断作用
18.3.2 下部尿路(尿道・膀胱)及び前立腺に対する作用
18.3.3 排尿障害改善作用
19. 有効成分に関する理化学的知見
19.1. タムスロシン塩酸塩
20. 取扱い上の注意
開封後は湿気を避けて保存すること。
使用期限内であっても開封後はなるべく速やかに使用すること。
22. 包装
<タムスロシン塩酸塩OD錠0.1mg「明治」>
PTP包装(乾燥剤入) 140錠(14錠×10)
<タムスロシン塩酸塩OD錠0.2mg「明治」>
PTP包装(乾燥剤入) 140錠(14錠×10)
23. 主要文献
- 角尾道夫ほか, 臨床医薬, 6 (12), 2529-2551, (1990)
- 角尾道夫ほか, 臨床医薬, 7 (1), 63-83, (1991)
- 社内資料:タムスロシン塩酸塩OD錠0.1mg「明治」の生物学的同等性試験に関する資料
- 社内資料:タムスロシン塩酸塩OD錠0.2mg「明治」の生物学的同等性試験に関する資料
- Koiso,K.et al., J.Clin.Pharmacol., 36 (11), 1029-1038, (1996) »PubMed
- Kawachi,Y., Curr.Ther.Res., 59 (3), 149-161, (1998)
- 河邉香月ほか, 泌尿器外科, 3 (10), 1247-1259, (1990)
- Kawabe,K.et al., J.Urol., 144 (4), 908-912, (1990) »PubMed
- 河邉香月ほか, 泌尿器外科, 4 (2), 231-242, (1991)
- Yamada,S.et al., J.Pharmacol.Exp.Ther., 242 (1), 326-330, (1987) »PubMed
- Honda,K.et al., Naunyn-Schmiedeberg's Arch.Pharmacol., 328 (3), 264-272, (1985) »PubMed
- Honda,K.et al., Naunyn-Schmiedeberg's Arch.Pharmacol., 336 (3), 295-302, (1987) »PubMed
- Honda,K.et al., Naunyn-Schmiedeberg's Arch.Pharmacol., 330 (1), 16-21, (1985) »PubMed
- Shibasaki,M.et al., J.Auton.Pharmacol., 12 (4), 263-268, (1992) »PubMed
- Sudoh,K.et al., J.Auton.Pharmacol., 16 (3), 147-154, (1996) »PubMed
- Sudoh,K.et al., Gen.Pharmacol., 28 (4), 521-524, (1997) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
Meiji Seikaファルマ株式会社
くすり相談室(Meファルマ株式会社専用ダイヤル)
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル0120-261-158
FAX:03-3272-2438
製品情報問い合わせ先
Meiji Seikaファルマ株式会社
くすり相談室(Meファルマ株式会社専用ダイヤル)
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル0120-261-158
FAX:03-3272-2438
26. 製造販売業者等
26.1 製造販売元
Meiji Seikaファルマ株式会社
東京都中央区京橋2-4-16
26.2 販売元
Meファルマ株式会社
東京都中央区京橋2-4-16