医薬品情報
| 総称名 | セフォタックス |
|---|---|
| 一般名 | セフォタキシムナトリウム |
| 欧文一般名 | Cefotaxime Sodium |
| 製剤名 | 注射用セフォタキシムナトリウム |
| 薬効分類名 | セフェム系抗生物質 |
| 薬効分類番号 | 6132 |
| ATCコード | J01DD01 |
| KEGG DRUG |
D00919
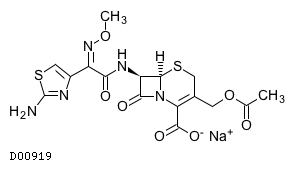
セフォタキシムナトリウム
|
| KEGG DGROUP |
DG01488
セフェム系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| セフォタックス注射用0.5g | Cefotax for Injection | 日医工 | 6132409D1041 | 560円/瓶 | 処方箋医薬品注) |
| セフォタックス注射用1g | Cefotax for Injection | 日医工 | 6132409D2048 | 799円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 リドカイン等のアニリド系局所麻酔剤に対し過敏症の既往歴のある患者(筋注用の溶解液としてリドカイン等のアニリド系局所麻酔剤を用いる場合)
4. 効能または効果
<適応菌種>
<適応症>
5. 効能または効果に関連する注意
<急性気管支炎>
「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
6. 用法及び用量
通常成人には、セフォタキシムとして1日1〜2g(力価)を2回に分けて静脈内又は筋肉内に注射する。
通常小児には、セフォタキシムとして1日50〜100mg(力価)/kgを3〜4回に分けて静脈内に注射する。
なお、難治性又は重症感染症には症状に応じて、1日量を成人では4g(力価)まで増量し、2〜4回に分割投与する。また小児では150mg(力価)/kgまで増量し、3〜4回に分割投与する。なお、小児の化膿性髄膜炎では300mg(力価)/kgまで増量できる。
静脈内注射に際しては、注射用水、生理食塩液又はブドウ糖注射液に溶解し、緩徐に注射する。また補液に加えて、点滴静注することもできる。筋肉内注射に際しては、0.5%リドカイン注射液に溶解して注射する。
静脈内注射に際しては、注射用水、生理食塩液又はブドウ糖注射液に溶解し、緩徐に注射する。また補液に加えて、点滴静注することもできる。筋肉内注射に際しては、0.5%リドカイン注射液に溶解して注射する。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.2 本剤によるショック、アナフィラキシーの発生を確実に予知できる方法がないので、次の措置をとること。[11.1.1、11.1.2参照]
・事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。
・投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
・投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に、投与開始直後は注意深く観察すること。
8.3 急性腎障害があらわれることがあるので、定期的に検査を行うこと。[11.1.3参照]
8.4 汎血球減少症、溶血性貧血、無顆粒球症、血小板減少症があらわれることがあるので、定期的に検査を行うこと。[11.1.5参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 セフェム系又はペニシリン系抗生物質に対し過敏症の既往歴のある患者(ただし、本剤に対し過敏症の既往歴のある患者には投与しないこと。)
9.1.2 本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者
9.1.3 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
観察を十分に行うこと。ビタミンK欠乏症状があらわれることがある。
9.2 腎機能障害患者
9.2.1 高度の腎障害のある患者
減量又は投与間隔をあけて投与すること。血中濃度が持続する。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.8 高齢者
次の点に注意し、用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。
・生理機能が低下していることが多く副作用が発現しやすい。
・ビタミンK欠乏による出血傾向があらわれることがある。
10. 相互作用
10.2 併用注意
| 利尿剤 フロセミド等 | 類似化合物(他のセフェム系抗生物質)で腎障害増強作用が報告されているので、腎機能に注意すること。 | 機序は明確でないが、利尿剤による細胞内への水分再吸収低下のため、尿細管細胞中の抗菌薬濃度が上昇するとの説がある。 |
| ワルファリン | プロトロンビン時間の延長(INR値の上昇)の報告がある。併用する場合には、血液凝固能の変動に十分注意し、ワルファリンの投与量を調節するなど適切な処置を行うこと。 | 作用機序は不明だが、本剤が腸内細菌によるビタミンKの産生を抑制し、ワルファリンの作用が増強される可能性があると考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)[8.2参照]
11.1.2 アナフィラキシー(頻度不明)
アナフィラキシー(発赤、呼吸困難、浮腫等)があらわれることがある。[8.2参照]
11.1.3 急性腎障害(頻度不明)[8.3参照]
11.1.4 偽膜性大腸炎(頻度不明)
偽膜性大腸炎等の血便を伴う重篤な大腸炎があらわれることがある。腹痛、頻回の下痢があらわれた場合には直ちに投与を中止するなど適切な処置を行うこと。
11.1.5 汎血球減少症、溶血性貧血、無顆粒球症、血小板減少症(いずれも頻度不明)[8.4参照]
11.1.6 肝機能障害(頻度不明)、黄疸(0.04%)
AST、ALTの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.7 間質性肺炎、PIE症候群(いずれも頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、PIE症候群等があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.8 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発疹性膿疱症(いずれも頻度不明)
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、発熱、そう痒 | ||
| 肝臓 | 黄疸 | AST上昇、ALT上昇 | |
| 血液 | 貧血、好酸球増多 | ||
| 消化器 | 下痢 | 悪心、嘔吐、腹痛 | |
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等) | ||
| 菌交代症 | 口内炎、カンジダ症 | ||
| その他 | 手足のしびれ感、視力障害、呼吸困難、頭痛 | 注射部位反応(腫脹、壊死等)、めまい、浮腫、全身倦怠感 |
12. 臨床検査結果に及ぼす影響
12.1 テステープ反応を除くベネディクト試薬、フェーリング試薬による尿糖検査では偽陽性を呈することがあるので注意すること。
12.2 ヤッフェ反応によるクレアチニン検査では、クレアチニン値がみかけ上高値を示すことがあるので注意すること。
12.3 直接クームス試験陽性を呈することがある。
14. 適用上の注意
14.1 薬剤調製時の注意
<投与経路共通>
14.1.1 溶解後は速やかに使用すること。
<静脈内投与>
14.1.2 点滴静注の際には、注射用水を使用しないこと。溶液が低張となるため浮腫等があらわれることがある。
14.1.3 以下のとおり注射液を調製すること。
| 注射用製剤 | 投与経路 | 溶解液 | 溶解液量 |
| 本剤0.5g(力価) | 静脈内 | 注射用水、5%ブドウ糖注射液又は生理食塩液 | 2mL以上 |
| 本剤1g(力価) | 4mL以上 |
<筋肉内投与>
14.1.4 以下のとおり注射液を調製すること。
| 注射用製剤 | 投与経路 | 溶解液 | 溶解液量 |
| 本剤0.5g(力価) | 筋肉内 | 0.5%リドカイン注射液 | 2mL |
| 本剤1g(力価) | 4mL |
14.2 薬剤投与時の注意
<静脈内投与>
14.2.1 薬液が血管外に漏れると、注射部位に腫脹・壊死等を起こすことがあるので、薬液が血管外に漏れないように慎重に投与すること。
14.2.2 注射速度
(1)点滴静注にあたっては、原則として100〜300mLの補液に溶解し、およそ1時間かけて点滴静注する。また、500mLの補液に溶解し、およそ2時間かけて点滴静注することもできる。
(2)静脈内大量投与により、まれに静脈炎を起こすことがあるので、注射液の調製、注射部位、注射方法等について十分注意し、注射速度はできるだけ遅くすること。
<筋肉内投与>
14.2.3 注射部位に疼痛、硬結をみることがあるので、繰り返し注射する場合には、同一部位への反復注射は避けること。
14.2.4 注射時疼痛を緩和するためにリドカイン注射液に溶解したときには、静脈内注射には使用しないこと。
14.2.5 乳幼児、小児には筋肉内注射をしないこと。
14.2.6 筋肉内注射にあたっては、神経走行部位を避けるよう注意して注射すること。
16. 薬物動態
16.1 血中濃度
健康成人に本剤0.5g、1g及び2gを静注、1g及び2gを点滴静注(2時間)した際の血中濃度の推移は図1及び図2に示すとおりである2)。
図1 セフォタキシム血中濃度(単回静脈内投与時)
図2 セフォタキシム血中濃度(点滴静注時)
16.3 分布
16.3.1 喀痰中移行
呼吸器感染症患者各1例に本剤0.5g、1g及び2gを60分かけて点滴静注した場合の喀痰中移行率は血中濃度の0.7〜1.3%(血中及び喀痰中濃度の最高値の比)の範囲にあり、最高喀痰中濃度はそれぞれ0.54μg/mL、0.42μg/mL、0.6μg/mLであった3)。
16.3.2 胆汁中移行
本剤1gを静注(n=8)及び60分かけて点滴静注(n=7)した場合の最高胆汁中濃度はそれぞれ2.2〜20.0μg/mL及び2.0〜23.4μg/mLであった4)。
16.3.3 髄液内移行
化膿性髄膜炎の小児に本剤50mg/kgを静注した場合、2.55〜13.2μg/mLの髄液中濃度を示した5)。
16.3.4 子宮組織への移行
子宮動脈血では本剤1gを静注後0.33時間に最高値93.0μg/mLを示した。卵巣、卵管、内膜、筋層、漿膜、頸部、腟部等、各組織への本剤の移行は1g静注後0.30〜0.48時間で、2.68〜4.39μg/gであった6)。
16.4 代謝
16.5 排泄
健康成人に本剤0.5g、1g、2gを静注した場合、24時間までの尿中回収率は平均71.1%、69.0%、49.1%であった2)。
16.6 特定の背景を有する患者
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内比較対照試験
17.1.2 国内一般臨床試験
| 疾患名 | 菌種 | 有効率 | |
| 敗血症 | レンサ球菌属、大腸菌、クレブシエラ属等 | 66.7%(28/42) | |
| 感染性心内膜炎 | レンサ球菌属等 | 80.0%(4/5) | |
| 呼吸器感染症 | 急性気管支炎、肺炎、肺膿瘍、膿胸、慢性呼吸器病変の二次感染 | レンサ球菌属、肺炎球菌、大腸菌、肺炎桿菌、インフルエンザ菌等 | 73.0%(465/637) |
| 尿路感染症 | 膀胱炎、腎盂腎炎 | 大腸菌、クレブシエラ属、エンテロバクター属、セラチア属、プロテウス属等 | 68.7%(673/979) |
| 胆道感染症 | 胆嚢炎、胆管炎 | 大腸菌、クレブシエラ属、エンテロバクター属等 | 83.9%(78/93) |
| 女性生殖器感染症 | バルトリン腺炎、子宮内感染、子宮付属器炎、子宮旁結合織炎 | 大腸菌、クレブシエラ属、ペプトストレプトコッカス属、バクテロイデス属等 | 93.2%(164/176) |
| 化膿性髄膜炎 | レンサ球菌属、肺炎球菌、大腸菌、インフルエンザ菌等 | 92.1%(35/38) | |
18. 薬効薬理
18.1 作用機序
18.1.1 本剤は細菌の細胞壁合成阻害により抗菌作用を示す。
18.2 抗菌作用
19. 有効成分に関する理化学的知見
19.1. セフォタキシムナトリウム
20. 取扱い上の注意
本品は光によって外観が徐々に着色するので、開封後の保存には注意すること。
22. 包装
<セフォタックス注射用0.5g>
10バイアル
<セフォタックス注射用1g>
10バイアル
23. 主要文献
- 厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
- 真下啓明 他, Chemotherapy., 28 (S-1), 194-217, (1980) »DOI
- 松本慶蔵 他, Chemotherapy., 28 (S-1), 436-446, (1980) »DOI
- 谷村弘 他, Chemotherapy., 28 (S-1), 641-654, (1980) »DOI
- 小林裕 他, Chemotherapy., 28 (S-1), 548-555, (1980) »DOI
- 高瀬善次郎 他, 産婦人科の世界, 32 (11), 1345-1364, (1980)
- 中山一誠 他, Chemotherapy., 28 (S-1), 606-622, (1980) »DOI
- 沢江義郎 他, Chemotherapy., 28 (S-1), 391-405, (1980) »DOI
- 薄田芳丸 他, Chemotherapy., 28 (S-1), 293-303, (1980) »DOI
- 三木文雄 他, 感染症学雑誌, 54 (11), 627-693, (1980) »DOI
- 北本治 他, 感染症学雑誌, 54 (9), 471-517, (1980) »PubMed
- 清水保夫 他, Chemotherapy., 29 (2), 107-131, (1981) »DOI
- 大川光央 他, Chemotherapy., 29 (1), 9-29, (1981) »DOI
- 熊沢浄一 他, 西日本泌尿器科, 42 (6), 1293-1310, (1980)
- 益吉真次 他, Chemotherapy., 28 (S-1), 1-11, (1980) »DOI
- 西野武志 他, Chemotherapy., 39 (S-1), 46-58, (1991) »DOI
- 五島瑳智子 他, Chemotherapy., 28 (S-1), 23-32, (1980) »DOI
- 村田加寿美 他, Chemotherapy., 28 (S-1), 33-41, (1980) »DOI
- 西野武志 他, Chemotherapy., 28 (S-1), 42-64, (1980) »DOI
- 猿渡勝彦 他, Jap. J. Antibiotics., 34 (3), 425-439, (1981)
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工株式会社
富山市総曲輪1丁目6番21