医薬品情報
| 総称名 | ビダーザ |
|---|---|
| 一般名 | アザシチジン |
| 欧文一般名 | Azacitidine |
| 製剤名 | 注射用アザシチジン |
| 薬効分類名 | 骨髄異形成症候群 急性骨髄性白血病治療剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01BC07 |
| KEGG DRUG |
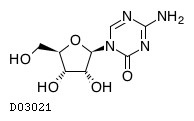
D03021
アザシチジン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年4月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ビダーザ注射用100mg | Vidaza for Injection | 日本新薬 | 4291419D1026 | 21963円/瓶 | 劇薬, 処方箋医薬品注) |
1. 警告
本剤は、緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に対して十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与すること。また、本剤による治療開始に先立ち、患者又はその家族に有効性及び危険性を十分に説明し、同意を得てから投与を開始すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
5. 効能または効果に関連する注意
6. 用法及び用量
通常、成人にはアザシチジンとして75mg/m2(体表面積)を1日1回7日間皮下投与又は10分かけて点滴静注し、3週間休薬する。これを1サイクルとし、投与を繰り返す。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
<効能共通>
7.1 原則として皮下投与を行うこと。出血傾向等により皮下投与が困難な場合は、点滴静注を行うこと。
7.2 本剤の投与については、以下の基準を目安に、適切に減量、治療開始の延期(休薬)及び投与中止の判断を行うこと。
7.2.1 グレード3以上の非血液毒性が発現した場合、治療開始前の状態に回復するまで休薬する。次サイクル開始予定日から21日以内に回復しない場合、又は当該毒性が重篤化した場合は投与を中止する(グレードはCTCAEに準じる)。
7.2.2 血液学的検査値による投与量調節[8.1参照]
(1)治療開始前値が白血球数≧3,000/mm3、好中球数≧1,500/mm3かつ血小板数≧75,000/mm3の全てを満たす患者
| 当該サイクルの最低値 | 次サイクルの治療開始の延期(休薬)・減量基準 |
| 好中球数<1,000/mm3 又は 血小板数<50,000/mm3 | [1]治療開始前値からの減少量の50%が回復注)した後、次サイクルを開始する [2]14日以内に回復注)しない場合、次サイクル投与量を50%量に減量する |
(2)治療開始前値が白血球数<3,000/mm3、好中球数<1,500/mm3又は血小板数<75,000/mm3のいずれかに該当する患者
| 当該サイクルの最低値 | 次サイクルの治療開始の延期(休薬)・減量基準 |
| 白血球数、好中球数又は血小板数のいずれかが治療開始前値の50%以下に減少 (ただし、同時にいずれかに輸血等の処置なしで当該サイクル開始時よりも増加が認められる場合は該当しない) | [1]治療開始前値からの減少量の50%が回復注)した後、次サイクルを開始する |
| [2]14日以内に回復注)しない場合、下表に従う 骨髄細胞密度:>50% 次サイクル投与量:100%量で継続する 骨髄細胞密度:15〜50% 次サイクル投与量:21日以内に回復注)しない場合、50%量に減量する 骨髄細胞密度:<15% 次サイクル投与量:21日以内に回復注)しない場合、33%量に減量する |
注)回復:血球数≧最低値+[0.5×(治療開始前値−最低値)]
7.2.3 腎機能及び血清電解質による投与量調節[8.2参照]
| 当該サイクル | 次サイクルの治療開始の延期(休薬)・減量基準 |
| 血清重炭酸塩<20mEq/L(静脈血) | 次サイクル投与量を50%量に減量する |
| BUN又は血清クレアチニンが施設基準値上限を超え、治療開始前値の2倍以上に上昇 | 施設基準値又は治療開始前値に回復した後、次サイクル投与量を50%量に減量する |
<骨髄異形成症候群>
7.3 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
<急性骨髄性白血病>
7.4 本剤を他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は「17.臨床成績」の項、国内外の最新のガイドライン等を参考にした上で、選択すること。
8. 重要な基本的注意
8.1 血小板減少、好中球減少及び貧血があらわれることがあるので、本剤投与前及び投与中は血液検査(血球数算定、白血球分画測定等)を定期的に行い、患者の状態を十分観察すること。[7.2.2、11.1.1参照]
8.3 間質性肺疾患があらわれることがあるので、咳嗽、呼吸困難、発熱等の臨床症状を十分に観察すること。[11.1.4参照]
8.4 腫瘍崩壊症候群があらわれることがあるので、血清中電解質濃度及び腎機能検査を行うなど、患者の状態を十分に観察すること。[11.1.10参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 感染症を合併している患者
骨髄抑制により感染症が増悪することがある。[11.1.1参照]
9.2 腎機能障害患者
[16.6.1参照]
9.3 肝機能障害患者
転移性癌による広範な腫瘍病変を有する患者(特に血清アルブミン値<3.0g/dLの患者)に対し本剤を投与中、進行性肝性昏睡により死亡に至った例が報告されている。
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性には、本剤投与中及び投与終了後一定期間は、適切な避妊を行うよう指導すること。[9.5参照]
9.4.2 生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。動物実験(マウス及びラット)で、ヒトの臨床用量を下回る用量で、本剤を投与した雄で精巣毒性が認められ、交配した雌の妊娠率の低下、異常胚の増加及び胚死亡の増加が認められている。
9.4.3 パートナーが妊娠する可能性のある男性には、本剤投与中及び投与終了後一定期間は、適切な避妊を行うよう指導すること。[15.2.2参照]
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。本剤が乳汁に移行する可能性があり、乳児が乳汁を介して本剤を摂取した場合、乳児に重篤な副作用が発現するおそれがある。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制
11.1.2 感染症
肺炎(11.7%)、敗血症(4.2%)等の感染症があらわれることがある。
11.1.3 出血
脳出血(頻度不明)、頭蓋内出血(頻度不明)、消化管出血(0.3%)、眼出血(頻度不明)、血尿(0.7%)、処置後出血(頻度不明)等があらわれることがある。
11.1.4 間質性肺疾患(頻度不明)
異常が認められた場合には、胸部X線、胸部CT等の検査を実施すること。間質性肺疾患が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。[8.3参照]
11.1.5 心障害
心房細動(1.3%)、心不全(0.9%)等の心障害があらわれることがある。観察を十分に行い、症状や徴候がみられた場合には速やかに検査を行い、投与を中止するなど、適切な処置を行うこと。
11.1.6 ショック、アナフィラキシー(いずれも頻度不明)
バイタルサインのモニタリングや自他覚症状など、観察を十分に行い、異常が認められた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.7 肝機能障害、黄疸
ALT増加(5.2%)、AST増加(4.8%)、ALP増加(3.5%)、血中ビリルビン増加(4.2%)、γ-GTP増加(0.3%)等を伴う肝機能障害、黄疸があらわれることがある。
11.1.8 腎不全(0.7%)、腎尿細管性アシドーシス(頻度不明)
腎不全、腎尿細管性アシドーシス等の腎障害があらわれることがある。[8.2参照]
11.1.9 低血圧
低血圧(1.5%)、起立性低血圧(頻度不明)があらわれることがある。
11.1.10 腫瘍崩壊症候群(0.3%)
異常が認められた場合には、適切な処置(生理食塩液、高尿酸血症治療剤等の投与、透析等)を行うとともに、症状が回復するまで患者の状態を十分に観察すること。[8.4参照]
11.2 その他の副作用
| 10%以上 | 1〜10%未満 | 1%未満 | 頻度不明 | |
| 感染症 | 咽頭炎(上咽頭炎含む)、菌血症、口腔カンジダ症、尿路感染、肺感染、上気道感染、気管支炎、蜂巣炎、口腔ヘルペス | 敗血症性ショック、副鼻腔炎(急性副鼻腔炎含む)、感染、皮膚感染、腸球菌感染、帯状疱疹、歯周炎、クロストリジウム・ディフィシレ大腸炎、膀胱炎、消化管感染、歯肉炎、肛門膿瘍、白癬感染、気道感染、医療機器関連感染、肛門直腸蜂巣炎、気管支肺アスペルギルス症、憩室炎、せつ、喉頭炎、肝膿瘍、下気道感染、リンパ管炎、偽膜性大腸炎、中咽頭カンジダ症、大腸菌性尿路感染、好中球減少性感染、クレブシエラ感染、カンジダ感染 | 単純ヘルペス、鼻炎、ブラストミセス症、トキソプラズマ症、四肢膿瘍、直腸周囲膿瘍 | |
| 血液 | ヘモグロビン減少、ヘマトクリット減少 | 血小板増加症、骨髄機能不全、好塩基球増加症、顆粒球減少症、リンパ球増加症、単球増加症、好酸球増加症、白血球増加症、アンチトロンビンIII減少、血球減少症、活性化部分トロンボプラスチン時間延長、平均赤血球ヘモグロビン濃度減少、芽球細胞数増加 | ||
| 代謝異常 | 食欲減退 | 低カリウム血症、LDH増加、低リン酸血症、低アルブミン血症、血中ブドウ糖増加、総蛋白減少、高尿酸血症、低ナトリウム血症 | 高リン酸塩血症、高カリウム血症、低カルシウム血症、低マグネシウム血症、血中重炭酸塩減少・増加、血中尿酸減少、水分過負荷、血中クロール増加、糖尿病、痛風、高カルシウム血症 | 血中クロール減少 |
| 精神神経系 | 頭痛、浮動性めまい、味覚異常 | 不眠症、錯乱状態、回転性めまい、睡眠障害、譫妄、うつ病、睡眠の質低下 | 不安、嗜眠、意識障害 | |
| 眼 | 結膜出血 | 眼乾燥、視力障害、眼瞼炎、眼充血、結膜充血 | ||
| 循環器 | 高血圧、動悸、心膜炎、頻脈(洞性頻脈含む)、心房粗動、心室性期外収縮 | |||
| 呼吸器 | 鼻出血、呼吸困難、口腔咽頭痛、咳嗽 | 胸水、上気道の炎症、口腔咽頭不快感、急性呼吸不全、労作性呼吸困難、喀血、呼吸不全、低酸素症、肺障害、鼻閉、肺臓炎、湿性咳嗽、鼻漏 | 肺浸潤 | |
| 消化器 | 悪心、便秘、嘔吐、下痢 | 口内炎、腹痛、腹部膨満、上腹部痛、痔核、消化不良、口唇炎(口角口唇炎含む) | 腹部不快感、口腔内出血、口腔内潰瘍形成、胃炎(慢性胃炎含む)、口唇乾燥、歯周病、肛門周囲痛、下腹部痛、胃食道逆流性疾患、歯肉出血、裂肛、嚥下障害、歯肉痛、歯肉腫脹、舌炎、口腔内痛、歯痛、軟便、アフタ性潰瘍、齲歯、口内乾燥、腸炎、胃潰瘍、メレナ、舌苔、痔出血、肛門びらん | |
| 皮膚 | 発疹、そう痒症(全身性そう痒症含む)、紅斑、点状出血、アレルギー性皮膚炎 | 紫斑、脱毛症、皮膚乾燥、斑状出血、斑状丘疹状皮疹、水疱(血性水疱含む)、紅斑性皮疹、接触皮膚炎、薬疹、湿疹、皮脂欠乏性湿疹、皮膚反応、皮膚潰瘍、皮膚腫瘤、皮膚炎、皮下出血、寝汗、全身性皮疹、斑状皮疹、丘疹性皮疹、蕁麻疹 | 皮膚小結節、皮膚硬結、好中球浸潤・有痛性紅斑・発熱を伴う皮膚障害(Sweet症候群) | |
| 腎臓及び尿路系 | 血中クレアチニン増加、尿中蛋白陽性、尿中血陽性 | 急性腎障害、腎機能障害、尿閉、頻尿、慢性腎臓病、尿中ブドウ糖陽性、血中尿素増加 | 排尿困難 | |
| その他 | 注射部位反応(紅斑、発疹、そう痒感、硬結等)、発熱 | 疲労、倦怠感、体重減少、脱力感、浮腫(末梢性浮腫含む)、挫傷、四肢痛、粘膜の炎症、血腫、背部痛、CRP増加 | 疼痛、悪寒、脱水、関節痛、筋痙縮、筋力低下、胸痛、末梢腫脹、転倒、筋肉痛、末梢性ニューロパチー、異常感、全身健康状態低下、胆石症、骨痛、錯感覚、失神、胸部不快感、炎症、非心臓性胸痛、胆嚢炎、関節炎、腱鞘炎、失神寸前の状態、痙攣発作、振戦、蒼白、静脈炎、表在性静脈炎、血管炎、ほてり | カテーテル留置部位反応(紅斑、出血、感染等)、脾腫、筋骨格痛、頚部痛、筋骨格系胸痛 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 取扱い時にはゴム手袋、防護メガネ等の着用が望ましい。眼や皮膚に薬液が付着した場合は直ちに多量の水で十分に洗浄し、医師の診断を受けるなど、適切な処置を行うこと。
14.1.2 注射液の調製法
(1)皮下投与の場合、1バイアルにつき注射用水4mLを注入し、バイアルを激しく振り混ぜて均一に懸濁させる。
(2)点滴静注の場合、1バイアルにつき注射用水10mLを注入し、バイアルを激しく振り混ぜて完全に溶解する。溶解液の必要量を生理食塩液(0.9%塩化ナトリウム注射液)又は乳酸リンゲル液50mLに混合すること。
14.1.3 5%ブドウ糖注射液、ヘタスターチ及び重炭酸塩を含む溶液とは配合禁忌である(本剤の分解を促進する可能性がある)。
14.1.4 本剤のバイアルは1回使い切りである。残液をその後の投与に使用しないこと。
14.1.5 本剤は用時調製し、調製から1時間以内に投与を終了すること。[安定性が低下するため]
14.2 薬剤投与時の注意
14.2.1 皮下投与では、投与直前に注射用シリンジ内の懸濁液を、両掌に挟んで激しく転がすなどの方法で再度均一に懸濁させること。なお、皮下投与では、懸濁液を冷蔵条件下(2〜8℃)で8時間まで保存することができる。冷蔵条件から取り出した懸濁液は、30分以内に投与することとし、室温に戻した後、投与直前に上記の方法で再度懸濁させて投与すること。
14.2.2 皮下投与の場合、投与量に応じて、複数箇所に分けて投与すること。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 動物実験(マウス及びラット)で、造血器系、リンパ系器官、肺、乳腺、精巣、皮膚(投与部位周囲)等に腫瘍発生が報告されている。
15.2.2 細菌を用いた復帰突然変異試験、並びにヒトリンパ芽球及びマウスリンパ腫細胞を用いた遺伝子突然変異試験で変異原性、マウスリンパ腫及びハムスター胚由来線維芽細胞を用いた小核試験で小核誘発性、マウス白血病細胞を用いた染色体異常試験で染色体異常誘発性が報告されている。[9.4.3参照]
16. 薬物動態
16.1 血中濃度
日本人MDS患者(n=9)に本剤75mg/m2を1日1回7日間(28日毎)皮下投与又は10分かけて点滴静注し、1サイクルと2サイクルの投与経路をクロスオーバーして、各サイクル1日目の血漿中濃度を測定した。皮下投与後を点滴静注後と比較するとCmaxは約1/3に、t1/2,βは約2倍となった。AUCの比較により算出した皮下投与時のバイオアベイラビリティ(BA)は91.1%であった1)。薬物動態パラメータは下表の通り。
| 投与量(mg/m2) | Cmax(ng/mL) | tmax(h) | AUC0-∞(ng・h/mL) | t1/2,β(h) | BA(%) | |
| 皮下投与 | 75 | 1120±210 | 0.361±0.253 | 1180±250 | 1.05±0.61 | 91.1注1) (80.7〜103) |
| 点滴静注 | 75 | 4170±1850 | 0.158±0.028 | 1440±520 | 0.441±0.041 | − |
点滴静注後の平均分布容積は76±26Lで、全身クリアランスは147±47L/hであった。皮下投与後の見かけ上の平均クリアランスは167±49L/hであった2)(外国人データ)。
MDS患者に本剤を75mg/m2皮下投与又は点滴静注した後の血漿中未変化体濃度推移(平均値±標準偏差、n=9)
16.3 分布
16.4 代謝
本剤は、自然加水分解によって代謝されると考えられており、ヒト肝S9画分においては、加水分解物であるN-ホルミルグアニルリボシルウレア及びグアニルリボシルウレア、並びにその脱アミノ体であるホルミルリボフラノシルビウレット及びリボフラノシルビウレットの生成が確認された。また、本剤は、シチジンデアミナーゼによる脱アミノ化によってアザウリジンに代謝されると考えられている。
初代培養ヒト肝細胞を用いたin vitro試験において、アザシチジンは100μmol/L(臨床における皮下投与及び点滴静注後のCmaxのそれぞれ22倍及び6倍)で、CYP1A2及びCYP2E1をそれぞれ19.4%及び27.1%阻害したが、アザシチジンが臨床においてP450に基づく薬物相互作用を示す可能性は低いと考えられた5)6)。
初代培養ヒト肝細胞を用いたin vitro試験において、アザシチジンは100μmol/L(臨床における皮下投与及び点滴静注後のCmaxのそれぞれ22倍及び6倍)で、CYP1A2及びCYP2E1をそれぞれ19.4%及び27.1%阻害したが、アザシチジンが臨床においてP450に基づく薬物相互作用を示す可能性は低いと考えられた5)6)。
16.5 排泄
本剤及びその代謝物は主に尿中に排泄されると考えられている。癌患者に14C-アザシチジンを皮下投与及び静脈内投与した場合、投与後48時間までの放射能の尿中排泄率はそれぞれ50%及び85%であり、糞中排泄率は1%未満であったと報告されている7)8)(外国人データ)。
雄性ラットに14C-アザシチジンを皮下又は静脈内投与した場合、投与後168時間までの放射能の尿中排泄率はそれぞれ89.5%及び96.4%であり、糞中排泄率は6.1%及び3.3%であった9)。
16.6 特定の背景を有する患者
17. 臨床成績
17.1 有効性及び安全性に関する試験
<骨髄異形成症候群>
17.1.1 国内第I/II相試験
本剤75mg/m2を1日1回7日間(28日毎)皮下投与又は10分かけて点滴静注した。4サイクル及び最終サイクル終了時に有効性(主要評価項目:血液学的改善)を評価し、4サイクル終了時に血液学的改善以上の有効性が認められた患者については、最大18サイクルまで投与継続可能と規定した。
投与例53例の成績(最良総合効果)を下表に示す11)。
投与例53例の成績(最良総合効果)を下表に示す11)。
試験対象患者注1)
・FAB分類によるMDS(RA、RARS、RAEB、RAEB-T)
・RA及びRARSの場合、ヘモグロビン<10g/dLかつ3ヵ月以内の赤血球輸血歴、血小板数<50,000/mm3もしくは出血症状、又は好中球数<1,000/mm3かつ易感染状態のうち、一つ以上該当
・RAEB-Tの場合、二次性(治療関連)MDSは対象外
| 血液学的寛解及び血液学的改善率 | 全例 (n=53) | IPSS分類注2) | |||
| Low (n=0) | Int-1注3) (n=23) | Int-2注4) (n=15) | High (n=15) | ||
| 寛解(CR+PR+marrowCR) | 28.3%(15/53) | − | 21.7(5/23) | 33.3(5/15) | 33.3(5/15) |
| 完全寛解(CR) | 15.1%(8/53) | − | 17.4(4/23) | 13.3(2/15) | 13.3(2/15) |
| 部分寛解(PR) | 0%(0/53) | − | 0(0/23) | 0(0/15) | 0(0/15) |
| 骨髄寛解(marrowCR) | 13.2%(7/53) | − | 4.3(1/23) | 20.0(3/15) | 20.0(3/15) |
| 血液学的改善 | 54.9%(28/51) | − | 60.9(14/23) | 46.2(6/13) | 53.3(8/15) |
| 赤血球系改善 | 45.7%(21/46) | − | 47.6(10/21) | 41.7(5/12) | 46.2(6/13) |
| 血小板系改善 | 66.7%(22/33) | − | 62.5(10/16) | 71.4(5/7) | 70.0(7/10) |
| 好中球系改善 | 48.3%(14/29) | − | 30.0(3/10) | 55.6(5/9) | 60.0(6/10) |
副作用は、53例中53例(100.0%)に認められた。主な副作用は、好中球減少症(発熱性好中球減少症を含む)47例(88.7%)、血小板減少症46例(86.8%)、白血球減少症45例(84.9%)、ヘモグロビン減少39例(73.6%)、便秘37例(69.8%)、赤血球減少症、注射部位反応(紅斑、発疹、そう痒感、硬結等) 各36例(67.9%)、ヘマトクリット減少32例(60.4%)、リンパ球減少症28例(52.8%)、倦怠感27例(50.9%)、発熱22例(41.5%)、ALT増加、食欲不振 各20例(37.7%)、発疹、ALP増加 各19例(35.8%)、AST増加、血中アルブミン減少 各18例(34.0%)であった。[5.参照]
17.1.2 外国第III相比較試験(AZA-001試験)
本剤は単独で75mg/m2を1日1回7日間(28日毎)皮下投与された。投与期間は最低6サイクル、疾患の増悪や治療継続困難な有害事象の発現が認められない限り投与継続可能と規定した。
358例がAZA(本剤)群179例、CCR注5)(通常治療)群179例に割り付けられた。
358例がAZA(本剤)群179例、CCR注5)(通常治療)群179例に割り付けられた。
試験対象患者注1)
・IPSSでInt-2又はHighかつFAB分類でRAEB又はRAEB-T
・IPSSでInt-2又はHighかつ以下の基準に該当するmodified CMML
末梢血単球数>1×109/L、白血球数<13×109/L、骨髄所見で一系統以上の異形成、骨髄芽球10〜29%
・造血幹細胞移植を行う見込みのない患者
・二次性(治療関連)MDSは対象外
主要評価項目である生存期間(中央値)は、CCR群15.02ヵ月に対し、AZA群24.46ヵ月であり9.44ヵ月の差が認められた(層別ログランク検定、p=0.0001)12)。
AZA-001試験の生存期間のカプランマイヤー曲線
| 治療群 | 全例 | IPSS分類注2) | ||
| Int-2注4) | High | |||
| 生存期間[ヵ月](例数) | AZA | 24.46(179) | 34.7(76) | 19.2(82) |
| CCR | 15.02(179) | 16.9(70) | 14.5(85) | |
副作用は、175例中169例(96.6%)に認められた。主な副作用は、血小板減少症90例(51.4%)、好中球減少症83例(47.4%)、注射部位紅斑73例(41.7%)、悪心71例(40.6%)、貧血55例(31.4%)であった。[5.参照]
<急性骨髄性白血病>
17.1.3 国内第II相比較試験(NS17A-P2試験)
65歳以上で造血幹細胞移植の適応とならない未治療の急性骨髄性白血病(AML)に対し、本剤75mg/m2を1日1回7日間(28日毎)皮下投与又は点滴静注した。
主解析対象を予後不良集団(FASU)注6)とし、該当する28例がAZA(本剤)群14例、CCR注7)(通常治療)群14例に割り付けられた。また、予後不良集団以外の未治療AMLにおいては、全例(16例)に本剤を投与した。
主要評価項目である全生存期間(中央値)は、主解析対象とされた予後不良集団(FASU)(本剤群14例、CCR群14例)において、CCR群8.8ヵ月(95%信頼区間:1.2ヵ月〜NA)に対し、AZA群9.6ヵ月(95%信頼区間:4.9〜18.7ヵ月)であり、事前に設定した達成基準注8)を満たさなかった(ハザード比:1.04、95%信頼区間:0.43〜2.56、ログランク検定、p=0.9250)13),注9)。
なお、FASUから中央診断で予後不良と判断されなかった症例(2例)を除いた集団(mFAS)及びmFASのうち、強力な寛解導入療法の適応とならない患者集団における結果は下表のとおりであった。
主解析対象を予後不良集団(FASU)注6)とし、該当する28例がAZA(本剤)群14例、CCR注7)(通常治療)群14例に割り付けられた。また、予後不良集団以外の未治療AMLにおいては、全例(16例)に本剤を投与した。
主要評価項目である全生存期間(中央値)は、主解析対象とされた予後不良集団(FASU)(本剤群14例、CCR群14例)において、CCR群8.8ヵ月(95%信頼区間:1.2ヵ月〜NA)に対し、AZA群9.6ヵ月(95%信頼区間:4.9〜18.7ヵ月)であり、事前に設定した達成基準注8)を満たさなかった(ハザード比:1.04、95%信頼区間:0.43〜2.56、ログランク検定、p=0.9250)13),注9)。
なお、FASUから中央診断で予後不良と判断されなかった症例(2例)を除いた集団(mFAS)及びmFASのうち、強力な寛解導入療法の適応とならない患者集団における結果は下表のとおりであった。
| 全体 | IC不適応注10) | |||
| 治療群 | AZA | CCR | AZA | CCR |
| 例数 | 14 | 12 | 11 | 9 |
| 中央値(月) | 9.6 | 5.3 | 12.3 | 5.6 |
| ハザード比[95%信頼区間] | 0.82[0.33,2.03] | 0.71[0.25,2.05] | ||
| p値注11) | 0.664 | 0.529 | ||
副作用は、30例中27例(90.0%)に認められた。主な副作用は、発熱性好中球減少症12例(40.0%)、血小板減少症11例(36.7%)、好中球減少症8例(26.7%)、貧血8例(26.7%)、便秘6例(20.0%)、注射部位反応6例(20.0%)及び食欲減退6例(20.0%)であった。[5.参照]
17.1.4 外国第III相比較試験(AZA-AML-001試験)
65歳以上で造血幹細胞移植の適応とならない未治療のAMLに対し、本剤75mg/m2を1日1回7日間(28日毎)皮下投与した。488例がAZA(本剤)群241例、CCR注12)(通常治療)群247例に割り付けられた。
主要評価項目である全生存期間(中央値)は、CCR群6.5ヵ月(95%信頼区間:5.0〜8.6ヵ月)に対し、AZA群10.4ヵ月(95%信頼区間:8.0〜12.7ヵ月)であり(ハザード比:0.85、95%信頼区間:0.69〜1.03、層別ログランク検定、p=0.1009)、AZA群はCCR群に対して統計学的に有意な延長を示さなかった14)15),注13)。
なお、強力な寛解導入療法の適応とならない患者集団(本剤群198例、CCR群203例)における全生存期間(中央値)は、CCR群5.7ヵ月(95%信頼区間:4.3〜7.1ヵ月)に対し、AZA群9.9ヵ月(95%信頼区間:7.0〜12.6ヵ月)であった(ハザード比:0.84、95%信頼区間:0.68〜1.05、ログランク検定、p=0.1220)。
主要評価項目である全生存期間(中央値)は、CCR群6.5ヵ月(95%信頼区間:5.0〜8.6ヵ月)に対し、AZA群10.4ヵ月(95%信頼区間:8.0〜12.7ヵ月)であり(ハザード比:0.85、95%信頼区間:0.69〜1.03、層別ログランク検定、p=0.1009)、AZA群はCCR群に対して統計学的に有意な延長を示さなかった14)15),注13)。
なお、強力な寛解導入療法の適応とならない患者集団(本剤群198例、CCR群203例)における全生存期間(中央値)は、CCR群5.7ヵ月(95%信頼区間:4.3〜7.1ヵ月)に対し、AZA群9.9ヵ月(95%信頼区間:7.0〜12.6ヵ月)であった(ハザード比:0.84、95%信頼区間:0.68〜1.05、ログランク検定、p=0.1220)。
AZA-AML-001試験の全生存期間のカプランマイヤー曲線
副作用は、236例中188例(79.7%)に認められた。主な副作用は、悪心64例(27.1%)、好中球減少症47例(19.9%)及び血小板減少症41例(17.4%)であった。[5.参照]
17.1.5 国際共同第III相比較試験(Viale-A[M15-656]試験)
強力な寛解導入療法の適応とならない未治療のAML患者に対し、ベネトクラクスとの併用(AZA+V群)又はプラセボとの併用(AZA+P群)で、本剤75mg/m2を1日1回7日間(28日毎)皮下投与又は静脈内投与した。ベネトクラクス及びプラセボは、第1、2及び3日目にそれぞれベネトクラクス100、200及び400mg又はプラセボを1日1回食後に経口投与した後、ベネトクラクス400mg又はプラセボを1日1回継続投与した。
433例(日本人患者37例を含む)がAZA+V群287例、AZA+P群146例に割り付けられた。
主要評価項目である全生存期間(中央値)は、AZA+P群9.6ヵ月(95%信頼区間:7.4〜12.7ヵ月)に対し、AZA+V群14.7ヵ月(95%信頼区間:11.9〜18.7ヵ月)であり(ハザード比:0.662、層別ログランク検定、p<0.001)、AZA+V群はAZA+P群に対して統計学的に有意な延長を認めた16),注14)。もう1つの主要評価項目である治験責任医師判定の複合的完全寛解(完全寛解[CR]+血球数回復が不完全な完全寛解[CRi])率は、AZA+P群25.3%(20/79例、95%信頼区間:16.2〜36.4%)に対し、AZA+V群で65.3%(96/147例、95%信頼区間:57.0〜73.0%)であり(Cochran-Mantel-Haenszel検定、p<0.001)、AZA+V群はAZA+P群に対して統計学的に有意に高値であった注15)。
433例(日本人患者37例を含む)がAZA+V群287例、AZA+P群146例に割り付けられた。
主要評価項目である全生存期間(中央値)は、AZA+P群9.6ヵ月(95%信頼区間:7.4〜12.7ヵ月)に対し、AZA+V群14.7ヵ月(95%信頼区間:11.9〜18.7ヵ月)であり(ハザード比:0.662、層別ログランク検定、p<0.001)、AZA+V群はAZA+P群に対して統計学的に有意な延長を認めた16),注14)。もう1つの主要評価項目である治験責任医師判定の複合的完全寛解(完全寛解[CR]+血球数回復が不完全な完全寛解[CRi])率は、AZA+P群25.3%(20/79例、95%信頼区間:16.2〜36.4%)に対し、AZA+V群で65.3%(96/147例、95%信頼区間:57.0〜73.0%)であり(Cochran-Mantel-Haenszel検定、p<0.001)、AZA+V群はAZA+P群に対して統計学的に有意に高値であった注15)。
Viale-A試験の全生存期間のカプランマイヤー曲線
副作用は、本剤が投与された427例中354例(82.9%)に認められた。主な副作用は、血小板減少症134例(31.4%)、好中球減少症128例(30.0%)及び悪心123例(28.8%)であった注14)。[5.参照]
注1)RA:不応性貧血、RARS:鉄芽球性不応性貧血、RAEB:芽球増加を伴う不応性貧血、RAEB-T:移行期の芽球増加を伴う不応性貧血、CMML:慢性骨髄単球性白血病
注2)国際予後スコアリングシステム
注3)Intermediate-1
注4)Intermediate-2
注5)CCR(conventional care regimen):支持療法単独105例/少量シタラビン49例/シタラビン+アントラサイクリン25例
注6)予後不良集団:以下のいずれかに該当するAML
・WHO分類による骨髄異形成関連変化を伴うAML
・NCCNガイドラインによる予後不良の細胞遺伝学的異常を有するAML
注7)CCR(conventional care regimen):支持療法単独1例/少量シタラビン10例/シタラビン+アントラサイクリン3例
注8)達成基準は、本薬群のCCR群に対するハザード比が1未満であることとされた。
注9)データカットオフ日:2020年4月24日
注10)強力な寛解導入療法の適応とならない患者
注11)ログランク検定
注12)CCR(conventional care regimen):支持療法単独45例/少量シタラビン158例/シタラビン+アントラサイクリン44例
注13)データカットオフ日:2014年1月22日
注14)データカットオフ日:2020年1月4日
注15)データカットオフ日:2018年10月1日
18. 薬効薬理
18.1 作用機序
18.2 細胞増殖抑制作用
19. 有効成分に関する理化学的知見
19.1. アザシチジン
22. 包装
1バイアル
23. 主要文献
- 国内のMDS患者にアザシチジンを皮下または静脈内投与した場合の薬物動態(承認年月日:2011年1月21日、CTD 2.7.1.2.2)
- 海外のMDS患者にアザシチジンを皮下または静脈内投与した場合の薬物動態(承認年月日:2011年1月21日、CTD 2.7.1.2.1)
- in vitroヒト血清タンパク結合率(承認年月日:2011年1月21日、CTD 2.6.4.4.2)
- in vitroヒト血球移行率(承認年月日:2011年1月21日、CTD 2.6.4.4.5)
- Daher GC,et al., Pharmacol Ther., 48, 189-222, (1990) »PubMed
- in vitro代謝試験(承認年月日:2011年1月21日、CTD 2.6.4.5.2)
- Troetel WM,et al., Cancer Chemother Rep., 56, 405-11, (1972) »PubMed
- Israili ZH,et al., Cancer Res., 36, 1453-61, (1976) »PubMed
- 雄性ラットに静脈内投与又は皮下投与した後の尿及び糞中排泄率(承認年月日:2011年1月21日、CTD 2.6.4.6.3)
- Laille E,et al., Pharmacotherapy., 34, 440-51, (2014) »PubMed
- Uchida T,et al., Cancer Sci., 102, 1680-6, (2011) »PubMed
- 骨髄異形成症候群に対するアザシチジンの外国第III相比較試験(AZA-001試験)(承認年月日:2011年1月21日、CTD 2.7.3.3.2.1)
- 急性骨髄性白血病患者に対するアザシチジンの国内第II相比較試験(NS17A-P2試験)(承認年月日:2021年3月23日、CTD 2.7.6.2)
- 急性骨髄性白血病患者に対するアザシチジンの外国第III相比較試験(AZA-AML-001試験)(承認年月日:2021年3月23日、CTD 2.7.6.1)
- Dombret H,et al., Blood., 126, 291-9, (2015) »PubMed
- DiNardo CD,et al., N Engl J Med., 383, 617-29, (2020) »PubMed
- Hollenbach PW,et al., PLoS ONE., 5, e9001, (2010) »PubMed
- Hofmann WK,et al., Leuk Res., 30, 1347-53, (2006) »PubMed
- Khan R,et al., Exp Hematol., 34, 35-43, (2006) »PubMed
- Kimura S,et al., Anticancer Res., 32, 795-8, (2012) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル 0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
製品情報問い合わせ先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル 0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
26. 製造販売業者等
26.1 製造販売元
日本新薬株式会社
京都市南区吉祥院西ノ庄門口町14