医薬品情報
| 総称名 | フェブリク |
|---|---|
| 一般名 | フェブキソスタット |
| 欧文一般名 | Febuxostat |
| 製剤名 | フェブキソスタット製剤 |
| 薬効分類名 | 非プリン型選択的キサンチンオキシダーゼ阻害剤 高尿酸血症治療剤 |
| 薬効分類番号 | 3949 |
| ATCコード | M04AA03 |
| KEGG DRUG |
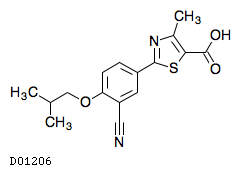
D01206
フェブキソスタット
|
| KEGG DGROUP |
DG02878
フェブキソスタット
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 改訂(用法用量変更)(第5版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| フェブリク錠10mg | Feburic Tablets 10mg | 帝人ファーマ | 3949003F1023 | 15.5円/錠 | 処方箋医薬品注) |
| フェブリク錠20mg | Feburic Tablets 20mg | 帝人ファーマ | 3949003F2020 | 29.8円/錠 | 処方箋医薬品注) |
| フェブリク錠40mg | Feburic Tablets 40mg | 帝人ファーマ | 3949003F3026 | 53.3円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 メルカプトプリン水和物又はアザチオプリンを投与中の患者[10.1参照]
4. 効能または効果
○痛風、高尿酸血症
○がん化学療法に伴う高尿酸血症
5. 効能または効果に関連する注意
<痛風、高尿酸血症>
5.1 本剤の適用にあたっては、最新の治療指針等を参考に、薬物治療が必要とされる患者を対象とすること。
<がん化学療法に伴う高尿酸血症>
5.2 本剤の適用にあたっては、腫瘍崩壊症候群の発症リスクを考慮して適応患者を選択すること。
5.3 本剤は既に生成された尿酸を分解する作用はないため、血中尿酸値を急速に低下させる効果は期待できない。
5.4 がん化学療法後に発症した高尿酸血症に対する本剤の有効性及び安全性は確立していない。
6. 用法及び用量
<痛風、高尿酸血症>
成人
通常、成人にはフェブキソスタットとして1日10mgより開始し、1日1回経口投与する。その後は血中尿酸値を確認しながら必要に応じて徐々に増量する。維持量は通常1日1回40mgで、患者の状態に応じて適宜増減するが、最大投与量は1日1回60mgとする。
小児
通常、小児には体重に応じてフェブキソスタットとして下記の投与量を1日1回経口投与する。
体重40kg未満
通常、1日5mgより開始し、1日1回経口投与する。その後は血中尿酸値を確認しながら必要に応じて徐々に増量する。維持量は通常1日1回20mgで、患者の状態に応じて適宜増減するが、最大投与量は1日1回30mgとする。
体重40kg以上
通常、1日10mgより開始し、1日1回経口投与する。その後は血中尿酸値を確認しながら必要に応じて徐々に増量する。維持量は通常1日1回40mgで、患者の状態に応じて適宜増減するが、最大投与量は1日1回60mgとする。
<がん化学療法に伴う高尿酸血症>
通常、成人にはフェブキソスタットとして60mgを1日1回経口投与する。
7. 用法及び用量に関連する注意
<痛風、高尿酸血症>
7.1 成人
7.2 小児
<がん化学療法に伴う高尿酸血症>
7.3 本剤は、がん化学療法開始1〜2日前から投与を開始すること。
7.4 臨床症状及び血中尿酸値をモニタリングしながら、化学療法開始5日目まで投与すること。なお、患者の状態に応じて、投与期間を適宜延長すること。
8. 重要な基本的注意
<効能共通>
8.1 肝機能障害があらわれることがあるので、本剤投与中は定期的に検査を行うなど、患者の状態を十分に観察すること。[11.1.1参照]
8.2 本剤投与中は甲状腺関連の所見の有無を確認し、異常が認められた場合には甲状腺機能関連の検査を実施すること。
8.3 心血管疾患を有する成人の痛風患者を対象とした海外臨床試験において、アロプリノール群に比較してフェブキソスタット群で心血管死の発現割合が高かったとの報告がある。本剤を投与する場合には心血管疾患の増悪や新たな発現に注意すること。[15.1参照]
<痛風、高尿酸血症>
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 重度の腎機能障害患者
重度の腎機能障害のある患者を対象とした臨床試験は実施していない。[16.6.1参照]
9.3 肝機能障害患者
肝機能障害のある患者を対象とした臨床試験は実施していない。[16.6.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で本剤が乳汁中に移行することが報告されている。また、動物実験(ラットにおける出生前及び出生後の発生並びに母体の機能に関する試験)の12mg/kg/日(60mg/日でのヒトの血漿中曝露量の11.1倍)以上で出生児の腎臓にキサンチンと推定される結晶沈着あるいは結石、48mg/kg/日(60mg/日でのヒトの血漿中曝露量の39.3倍)で離乳率の低下、体重低値などの発育抑制、甲状腺の大型化及び甲状腺重量増加の傾向が認められている1)。
9.7 小児等
成長に伴う血中尿酸値の変動を考慮し、定期的に用量調節の必要性を検討すること。低出生体重児、新生児、乳児、幼児を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察し、十分に注意しながら本剤を投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.1 併用禁忌
| メルカプトプリン水和物 (ロイケリン) アザチオプリン (イムラン、アザニン) [2.2参照] | 骨髄抑制等の副作用を増強する可能性がある。 | アザチオプリンの代謝物メルカプトプリンの代謝酵素であるキサンチンオキシダーゼの阻害により、メルカプトプリンの血中濃度が上昇することがアロプリノール(類薬)で知られている。本剤もキサンチンオキシダーゼ阻害作用をもつことから、同様の可能性がある。 |
10.2 併用注意
| ビダラビン | 幻覚、振戦、神経障害等のビダラビンの副作用を増強する可能性がある。 | ビダラビンの代謝酵素であるキサンチンオキシダーゼの阻害により、ビダラビンの代謝を抑制し、作用を増強させることがアロプリノール(類薬)で知られている。本剤もキサンチンオキシダーゼ阻害作用をもつことから、同様の可能性がある。 |
| ジダノシン | ジダノシンの血中濃度が上昇する可能性がある。 本剤と併用する場合は、ジダノシンの投与量に注意すること。 | ジダノシンの代謝酵素であるキサンチンオキシダーゼの阻害により、健康成人及びHIV患者においてジダノシンのCmax及びAUCが上昇することがアロプリノール(類薬)で知られている。本剤もキサンチンオキシダーゼ阻害作用をもつことから、同様の可能性がある。 |
| ロスバスタチン | ロスバスタチンの血中濃度が上昇する可能性がある。 | 本剤がBCRPを阻害することにより、ロスバスタチンのAUCが約1.9倍、Cmaxが約2.1倍上昇したとの報告がある2)。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害(頻度不明)
AST、ALT等の上昇を伴う肝機能障害があらわれることがある。[8.1参照]
11.1.2 過敏症(頻度不明)
全身性皮疹、発疹などの過敏症があらわれることがある。
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 血液 | 白血球数減少 | 血小板数減少、貧血 | |
| 内分泌系 | TSH増加 | ||
| 神経系 | 手足のしびれ感、浮動性めまい、傾眠 | 頭痛、味覚異常 | |
| 心臓 | 心電図異常 | 動悸 | |
| 胃腸 | 下痢、腹部不快感、悪心、腹痛 | ||
| 肝・胆道系 | 肝機能検査値異常(AST増加、ALT増加、γ-GTP増加等) | ||
| 皮膚 | 発疹、そう痒症、紅斑 | 蕁麻疹、脱毛 | |
| 筋骨格系 | 関節痛 | 四肢痛、四肢不快感、CK増加、筋肉痛 | |
| 腎及び尿路 | β-NアセチルDグルコサミニダーゼ増加、尿中β2ミクログロブリン増加、血中クレアチニン増加、血中尿素増加、頻尿 | 尿量減少 | |
| その他 | 倦怠感、口渇、血中トリグリセリド増加、CRP増加、血中カリウム増加 | 浮腫 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
海外で実施された心血管疾患を有する成人の痛風患者を対象とした二重盲検非劣性試験において、主要評価項目(心血管死、非致死性心筋梗塞、非致死性脳卒中、不安定狭心症に対する緊急血行再建術の複合エンドポイント)についてはアロプリノール群に対しフェブキソスタット群で非劣性が示されたものの、副次評価項目のうち心血管死の発現割合はフェブキソスタット群及びアロプリノール群でそれぞれ4.3%(134/3,098例)、3.2%(100/3,092例)でありフェブキソスタット群で高かった(ハザード比[95%信頼区間]:1.34[1.03,1.73])。心血管死の中では両群ともに心突然死が最も多かった(フェブキソスタット群2.7%(83/3,098例)、アロプリノール群1.8%(56/3,092例))。また、全死亡の発現割合についても、フェブキソスタット群及びアロプリノール群でそれぞれ7.8%(243/3,098例)、6.4%(199/3,092例)でありフェブキソスタット群で高かった(ハザード比[95%信頼区間]:1.22[1.01,1.47])。[8.3参照]
15.2 非臨床試験に基づく情報
げっ歯類を用いた104週間投与によるがん原性試験において、最高用量群(ラット24mg/kg/日[60mg/日でのヒトの血漿中曝露量の約25(雄)及び26(雌)倍]、マウス18.75mg/kg/日[60mg/日でのヒトの血漿中曝露量の約4(雄)及び12(雌)倍])の膀胱にキサンチンと推定される結晶沈着・結石が認められ、マウスの18.75mg/kg/日(雌)及びラットの24mg/kg/日(雄)に膀胱腫瘍(移行上皮乳頭腫及び移行上皮癌)の発生頻度の増加が認められた。マウスでは膀胱にキサンチン結晶・結石が生成しない条件下で、膀胱移行上皮の過形成は認められなかった。げっ歯類では、結晶・結石などによる機械的刺激が長時間持続することにより、膀胱粘膜の腫瘍性変化が誘発されるとの報告がある。また、臨床試験において、キサンチン結晶・結石を疑わせる尿沈渣所見はなかった3)。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性30例に、フェブキソスタットとして10、20、40及び80mg注)を絶食下で単回経口投与したとき、血漿中フェブキソスタットの濃度推移及び薬物動態パラメータは以下のとおりである4)5)。
| 用量 | 薬物動態パラメータ | |||
| AUCinf(ng・h/mL) | Cmax(ng/mL) | t1/2(h) | tmax(h) | |
| 10mg(N=8) | 1537.0±430.9 | 496.2±166.0 | 6.2±0.9 | 1.4±1.1 |
| 20mg(N=8) | 3296.2±751.9 | 1088.3±178.9 | 6.2±1.1 | 1.3±0.5 |
| 40mg(N=8) | 7085.2±1341.2 | 2270.3±866.7 | 7.3±1.8 | 1.2±0.8 |
| 80mg(N=6) | 13300.5±3032.3 | 3765.3±1008.3 | 6.9±1.8 | 1.9±1.0 |
16.1.2 反復投与
<効能共通>
健康成人男性6例に、フェブキソスタットとして40mgを朝食後に1日1回7日間反復経口投与したとき、血漿中フェブキソスタット濃度は投与開始後3日で定常状態に達し、反復投与による蓄積性は認められなかった6)。
| 用量 | 観察日 | Cmax(ng/mL) | tmax(h) | AUC0,24h(ng・h/mL) | t1/2(h) |
| 40mg/日(N=6) | 1日目 | 1019.1±343.2 | 1.8±0.8 | 3658.5±625.6 | 6.3±1.6 |
| 7日目 | 1299.8±312.6 | 1.5±0.3 | 4442.1±729.5 | 8.8±2.2 |
<痛風、高尿酸血症>
成人の高尿酸血症患者10例にフェブキソスタット10mg/日で2週間、20mg/日を4週間1日1回朝食後に投与したとき、投与開始後6週における薬物動態パラメータは以下のとおりであった7)。
| 用量 | Cmax(ng/mL) | tmax(h) | AUC0,24h(ng・h/mL) | t1/2(h) |
| 20mg(N=10) | 541.8±227.8 | 2.2±1.6 | 2092.3±463.2 | 8.2±2.4 |
16.1.3 母集団薬物動態解析
健康成人、腎機能低下患者及び小児高尿酸血症患者142例から得られた血漿中フェブキソスタット濃度に基づく母集団薬物動態解析を実施した。小児高尿酸血症患者に本剤を食後に1日1回反復経口投与したとき、各体重区分(40kg未満及び40kg以上)での定常状態における薬物動態パラメータの推定値は以下のとおりであった8)。
| 体重区分 | 用量 | 例数 | 薬物動態パラメータ | |
| Cmax,ss(ng/mL) | AUCτ,ss(ng・h/mL) | |||
| 40kg未満 | 5mg | 10 | 193±54 | 1199±371 |
| 10mg | 10 | 386±107 | 2398±743 | |
| 20mg | 6 | 797±282 | 4798±1902 | |
| 30mg | 2 | 788,1432 | 4251,11305 | |
| 40kg以上 | 10mg | 19 | 301±90 | 1686±709 |
| 20mg | 18 | 604±184 | 3426±1439 | |
| 40mg | 12 | 1252±343 | 6724±2343 | |
| 60mg | 4 | 1719±495 | 7582±559 | |
16.2 吸収
16.2.1 食事の影響
健康成人16例に、フェブキソスタット40mgを食後に単回経口投与したとき、空腹時投与に比べて、Cmax及びAUCinfはそれぞれ28及び18%低下した4)。
| 投与群 | Cmax(ng/mL) | tmax(h) | AUCinf(ng・h/mL) | t1/2(h) |
| 絶食下投与(N=16) | 2049.1±782.3 | 1.2±0.8 | 6538.3±1263.0 | 6.8±1.7 |
| 食後投与(N=16) | 1456.0±514.8 | 1.8±1.0 | 5321.6±910.4 | 6.3±1.5 |
16.3 分布
16.3.1 蛋白結合率
フェブキソスタット(0.4〜10μg/mL添加時)のヒト血漿蛋白結合率は97.8〜99.0%であり、主な結合蛋白はアルブミンであった(in vitro試験)9)。
16.4 代謝
フェブキソスタットの主な代謝経路はグルクロン酸抱合反応であった。また、その他に複数の酸化代謝物、それらの硫酸抱合体及びグルクロン酸抱合体に代謝された10)。フェブキソスタットのCYP1A2、CYP2B6、CYP2C9、CYP2C19、及びCYP3A4/5に対する阻害は認められなかった。一方、フェブキソスタットのCYP2C8及びCYP2D6に対するKi値はそれぞれ20及び40μmol/Lであった(ヒト肝ミクロソームを用いたin vitro試験)9)11)。
フェブキソスタットはCYP1A1/2、CYP2B6、CYP2C9、CYP2C19、CYP2D6、CYP2E1及びCYP3A4/5を誘導しなかった(ヒト初代肝細胞を用いたin vitro試験)11)。
16.5 排泄
16.5.1 健康成人男性24例にフェブキソスタットとして10、20、40mgを絶食下単回経口投与したとき、投与後24及び96時間までの投与量に対するフェブキソスタットの尿中排泄率はそれぞれ2.1〜3.8%及び2.2〜3.9%であった。また、投与後24及び96時間までの投与量に対するフェブキソスタットのグルクロン酸抱合体の尿中排泄率はそれぞれ46.7〜49.7%及び49.0〜51.6%であった4)。
16.5.2 健康成人男性6例に14C-フェブキソスタットとして80mg注)を含有する液剤を、絶食下単回経口投与したとき、投与後4時間までの血漿中総放射能に対するフェブキソスタット及びそのグルクロン酸抱合体の割合はそれぞれ83.8〜95.8%及び2.3〜6.8%であった。投与後48時間までのフェブキソスタットの尿中排泄率(投与量に対する割合、以下同様)は1.1〜3.5%、投与後120時間までの糞中排泄率は7.8〜15.8%であった。また、代謝物を含めた総放射能の投与後216時間までの尿及び糞中排泄率はそれぞれ49.1及び44.9%であった(外国人のデータ)10)。
16.6 特定の背景を有する患者
16.6.1 腎機能低下患者
成人の軽度(5例)及び中等度(7例)の腎機能低下患者にフェブキソスタット20mgを1日1回朝食後に7日間反復経口投与したとき、投与後7日における軽度腎機能低下群のフェブキソスタットのCmaxは腎機能正常群(9例)と変わらなかったが、AUC0,24hは腎機能正常群に比較して53%増加した。中等度腎機能低下群のCmax及びAUC0,24hは腎機能正常群に比較して、それぞれ26及び68%増加した12)。
16.6.2 肝機能低下患者
16.6.3 高齢者
高齢者(65歳以上、24例)と若年者(18〜40歳、24例)にフェブキソスタット80mg注)を1日1回朝食前に7日間反復経口投与したとき、投与後7日における高齢者のCmax及びAUC0,24hは若年者に対してそれぞれ1%低下及び12%上昇した(外国人のデータ)15)。
16.6.4 女性
フェブキソスタット80mg注)を1日1回朝食前に7日間反復経口投与したとき、投与後7日における成人の女性被験者群(24例)のCmax及びAUC0,24hは成人の男性被験者群(24例)に比較してそれぞれ24及び12%高かった(外国人のデータ)15)。
16.7 薬物相互作用
16.7.1 制酸剤
健康成人24例に制酸剤(5mL中に水酸化マグネシウム200mg及び水酸化アルミニウム225mgを含有する配合剤)を単回経口投与後にフェブキソスタット80mg注)を単回経口投与したとき、フェブキソスタットのCmax及びAUCinfはそれぞれ32及び15%低下した(外国人のデータ)16)。
16.7.2 コルヒチン
健康成人22例にフェブキソスタット40mgを1日1回7日間反復経口投与し、更に4〜7日目にコルヒチンを1.2mg/日で1日2回反復経口投与したとき、フェブキソスタットのCmax及びAUC0,24hはそれぞれ12及び7%上昇した(外国人のデータ)17)。
健康成人26例にフェブキソスタット120mg注)を1日1回及びコルヒチンを1.2mg/日で1日2回14日間反復経口投与したとき、コルヒチンの朝食前投与後もしくは夕食後投与後のCmaxはそれぞれ12%低下及び2%上昇した。また、AUC0,24hは3%低下した17)。
16.7.3 インドメタシン
健康成人26例にフェブキソスタット80mg注)を1日1回及びインドメタシン100mg/日で1日2回5日間反復経口投与したとき、フェブキソスタットのCmaxは7%低下し、AUC0,24hは2%上昇した。また、インドメタシンのCmax及びAUC0,24hの低下は2%以内であった(外国人のデータ)18)。
16.7.4 ナプロキセン
健康成人25例にフェブキソスタット80mg注)を1日1回及びナプロキセン1000mg/日を1日2回7日間反復経口投与したとき、ナプロキセンの併用により、フェブキソスタットのCmax及びAUC0,24hはそれぞれ28及び40%上昇した。一方、フェブキソスタットの併用によるナプロキセンのCmaxの上昇及びAUC0,24hの低下は1%以内であった(外国人のデータ)18)。
16.7.5 デシプラミン
健康成人18例にフェブキソスタット120mg注)を1日1回9日間反復経口投与し、投与開始後6日にデシプラミン(国内未承認)25mgを単回経口投与したとき、デシプラミンのCmax及びAUCinfはそれぞれ16及び22%上昇した(外国人のデータ)19)。
16.7.6 ワルファリンナトリウム
健康成人13例にフェブキソスタット120mg注)とワルファリンナトリウム(国内未承認)(用量はINRを基準に設定)を1日1回14日間反復経口投与したとき、R-及びS-ワルファリンのCmax及びAUC0,24hの上昇は5%以内であった。また、ワルファリンの薬力学の変化(INRmaxの上昇、INRmean,24hの低下及び第VII因子活性平均値の上昇)は7%以内であった(外国人のデータ)20)。
健康成人27例にフェブキソスタット80mg注)とワルファリンナトリウム(国内未承認)(用量はINRを基準に設定)を1日1回14日間反復経口投与したとき、R-ワルファリンのCmax及びAUC0,24hの低下は2%以内であった。また、S-ワルファリンのCmaxの低下及びAUC0,24hの上昇は1%以内であった。また、ワルファリンの薬力学の変化(INRmaxとINRmean,24hの低下及び第VII因子活性平均値の上昇)は4%以内であった(外国人のデータ)20)。
16.7.7 ヒドロクロロチアジド
健康成人33例にフェブキソスタット80mg注)とヒドロクロロチアジド50mgを単回経口投与したとき、フェブキソスタットのCmax及びAUCinfの上昇は4%以内であった(外国人のデータ)21)。
16.7.8 テオフィリン
健康成人23例にフェブキソスタット80mg注)を1日1回7日間反復経口投与し、投与開始後5日にテオフィリン400mgを単回経口投与したとき、テオフィリンのCmax及びAUCinfの上昇は5%以内であった(外国人のデータ)22)。
16.7.9 ロシグリタゾン
健康成人36例にフェブキソスタット120mg注)を1日1回9日間反復経口投与し、投与開始後5日にロシグリタゾン(国内未承認)4mgを単回経口投与したとき、ロシグリタゾンのCmaxの低下及びAUCinfの上昇は6%以内であった23)。
注)本剤の承認された用法及び用量における最大投与量は60mg/日である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<痛風、高尿酸血症>
17.1.1 国内後期第II相試験(成人)
痛風を含む高尿酸血症患者202例を対象としたプラセボ対照無作為化二重盲検用量反応比較試験を行った。本剤10mg/日から投与を開始し、各群の固定維持用量(20、40、60又は80mg注)/日)まで用量を段階的に増量した。増量のタイミングは投与開始後2、6及び10週とし、これ以降16週まで用量を維持した。なお、女性患者はプラセボ群1/38例、本剤20mg/日群2/43例、本剤40mg/日群0/41例、本剤60mg/日群1/36例、本剤80mg/日群1/41例であった。投与開始後16週時(各群の維持用量まで用量を段階的に増量した期間を含む)に、血清尿酸値が6.0mg/dL以下に到達した患者の割合(達成率)及び各投与期間での痛風関節炎の発現割合は、下表のとおりであった24)。
| 投与群 | 血清尿酸値6.0mg/dL以下達成率 | プラセボ群との差 | 95%信頼区間(%) |
| プラセボ(38例) | 2.6% | − | − |
| 20mg/日(43例) | 46.5% | 43.9% | 28.1〜59.6 |
| 40mg/日(41例) | 82.9% | 80.3% | 67.7〜92.9 |
| 60mg/日(36例) | 83.3% | 80.7% | 67.5〜93.9 |
| 80mg/日(41例) | 87.8% | 85.2% | 73.9〜96.4 |
| 投与群 | 0〜2週以下 | 2週超6週以下 | 6週超10週以下 | 10週超16週以下 |
| プラセボ(38例) | 0.0% | 5.3% | 2.6% | 2.7% |
| 20mg/日(43例) | 0.6%(10mg/日) | 2.5%(20mg/日) | 4.9%(20mg/日) | 2.4%(20mg/日) |
| 40mg/日(41例) | 3.4%(40mg/日) | 7.5%(40mg/日) | ||
| 60mg/日(36例) | 8.8%(60mg/日) | |||
| 80mg/日(41例) | 17.9%(80mg/日) |
本試験における本剤の安全性評価対象199例中、副作用(臨床検査値の異常を含む)の発現頻度は、プラセボ群18.4%(7/38例)、本剤20mg/日群23.3%(10/43例)、本剤40mg/日群29.3%(12/41例)、本剤60mg/日群13.9%(5/36例)、本剤80mg/日群29.3%(12/41例)であった。本剤群における主な副作用は、本剤20mg/日群で痛風関節炎4例(9.3%)、倦怠感2例(4.7%)、本剤40mg/日群で痛風関節炎3例(7.3%)、TSH増加2例(4.9%)、本剤60mg/日群で痛風関節炎3例(8.3%)、本剤80mg/日群で痛風関節炎8例(19.5%)、関節痛2例(4.9%)、四肢不快感2例(4.9%)、ALT増加2例(4.9%)、CK増加2例(4.9%)であった。[7.1参照]
17.1.2 国内第III相試験(成人)
痛風を含む高尿酸血症患者244例を対象としたアロプリノール対照無作為化二重盲検比較試験を行った。本剤10mg/日又はアロプリノール100mg/日を12日間投与し、その後、それぞれ40mg/日又は200mg/日に増量し44日間投与した。なお、女性患者は本剤群3/122例、アロプリノール群3/121例であった。投与開始後8週の血清尿酸値変化率(主要評価項目)において、本剤40mg/日群のアロプリノール200mg/日群に対する非劣性が示された(P<0.001:非劣性マージンは5%)。また、投与開始後8週の血清尿酸値6.0mg/dL以下達成率(副次評価項目)は、本剤40mg/日群82.0%、アロプリノール200mg/日群70.0%であった。各投与期間での痛風関節炎の発現割合は下表のとおりであった25)。
| 投与群 | 血清尿酸初期値(mg/dL) | 血清尿酸値変化率a)(%) | 変化率の群間差[95%信頼区間](%) | 共分散分析 |
| 平均(標準偏差) | 平均(標準偏差) | |||
| アロプリノール200mg/日(120例) | 8.89(1.24) | −35.2(14.7) | −6.24[−9.65,−2.84] | P<0.001#) |
| 本剤40mg/日(122例) | 8.83(1.32) | −41.5(12.1) |
| 投与群 | 0〜12日以下 | 12日超6週以下 | 6週超8週以下 |
| アロプリノール200mg/日(121例) | 1.7%(100mg/日) | 3.3%(200mg/日) | 0.9%(200mg/日) |
| 本剤40mg/日(122例) | 1.6%(10mg/日) | 5.7%(40mg/日) | 3.3%(40mg/日) |
本試験における本剤の安全性評価対象243例中、副作用(臨床検査値の異常を含む)の発現頻度は、本剤群8.2%(10/122例)、アロプリノール群11.6%(14/121例)であった。本剤群における主な副作用は、痛風関節炎4例(3.3%)であった。[7.1参照]
17.1.3 国内長期投与試験(成人)
血清尿酸値9.0mg/dL以上の痛風を含む高尿酸血症患者171例を対象とした長期投与試験を実施した。本剤10mg/日から投与を開始し、投与開始後3週目に本剤20mg/日、投与開始後7週目に本剤40mg/日に増量した。投与開始後10週目の血清尿酸値が6.0mg/dLを超えていた場合は投与開始後15週目より本剤60mg/日に増量し、血清尿酸値が6.0mg/dL以下の場合は本剤40mg/日を維持した。なお、女性患者は本剤40mg/日群5/131例、本剤60mg/日群1/40例であった。投与開始後18週、26週、52週で血清尿酸値が6.0mg/dL以下に到達した患者の割合(達成率)は、本剤40mg/日群では、それぞれ93.5、91.5、86.4%、また、本剤60mg/日群では、それぞれ74.4、71.4、87.5%であった26)。
本試験における本剤の安全性評価対象171例中、副作用(臨床検査値の異常を含む)の発現頻度は、本剤40mg/日群37.4%(49/131例)、本剤60mg/日群35.0%(14/40例)であった。本剤群における主な副作用(臨床検査値の異常を含む)は、本剤40mg/日群で痛風関節炎26例(19.8%)、関節痛7例(5.3%)、四肢痛4例(3.1%)、本剤60mg/日群で痛風関節炎9例(22.5%)、関節痛3例(7.5%)、四肢痛3例(7.5%)、四肢不快感2例(5.0%)であった。[7.1参照]
17.1.4 国内第II相試験(小児)
6〜18歳の痛風を含む高尿酸血症患者30例を対象とした非盲検非対照試験を行った。実際に組み入れられた患者の年齢は8〜18歳であった。体重別に本剤の投与量(低用量、中用量、高用量及び最高用量として、体重40kg未満では5、10、20及び30mg、体重40kg以上では10、20、40及び60mg)を設定し、1日1回34週間投与した。投与開始後6週までは低用量、投与開始後7週〜14週までは中用量とし、投与開始後15週〜22週及び23週〜34週では、それぞれ投与開始後10週及び18週の血清尿酸値が6.0mg/dL以下を達成していない場合に、順次高用量、最高用量へ増量した。
その結果、投与開始後26週における主な有効性の結果は下表のとおりであった27)。
その結果、投与開始後26週における主な有効性の結果は下表のとおりであった27)。
| 体重40kg未満 | 体重40kg以上 | 全体 | |
| 血清尿酸値6.0mg/dL以下達成割合 | 60.0%(6/10例)[26.2,87.8%] | 65.0%(13/20例)[40.8,84.6%] | 63.3%(19/30例)[43.9,80.1%] |
| 血清尿酸値のベースラインからの変化率 | −36.60±14.31%(10例) | −36.80±10.76%(20例) | −36.73±11.81%(30例) |
<がん化学療法に伴う高尿酸血症>
17.1.5 国内第III相試験
化学療法施行予定の悪性腫瘍患者99例を対象にアロプリノール対照非盲検無作為化比較試験を行った。本剤60mg/日又はアロプリノールは300mg/日[腎機能障害のある患者(30≦eGFR<45mL/min/1.73m2)では200mg/日]を化学療法施行開始24時間前から6日間投与した。投与開始6日後までの血清尿酸値AUC(主要評価項目)は、アロプリノール群に対する本剤群の非劣性が示された(非劣性マージンは150mg・h/dL)。また、本剤60mg/日の投与により血清尿酸値は投与開始6日後まで経時的に減少した29)。
本試験における本剤60mg/日の安全性評価対象49例中1例(2.0%)に副作用が認められた。その副作用は、AST増加、ALT増加であった。
| 投与群 | 血清尿酸値AUC(mg・h/dL) | 群間差[95%信頼区間] |
| 最小二乗平均値±標準誤差 | ||
| アロプリノール200〜300mg/日(50例) | 513.44±13.13 | −33.61[−70.67,3.45] |
| 本剤60mg/日(49例) | 479.82±13.26 |
血清尿酸値の経時推移図
注)本剤の承認された用法及び用量における最大投与量は60mg/日である。
18. 薬効薬理
18.1 作用機序
18.1.1 フェブキソスタットは、尿酸生成を掌るキサンチンオキシダーゼの酸化型(Ki値:0.6nmol/L)、還元型(Ki値:3.1nmol/L)をいずれも阻害することにより、尿酸生成を抑制する(in vitro試験)30)。
18.1.2 フェブキソスタットは、他の主要なプリン・ピリミジン代謝酵素の活性に影響を及ぼさず、キサンチンオキシダーゼを選択的に阻害する(in vitro試験)30)。
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. フェブキソスタット
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<フェブリク錠10mg>
PTP
100錠(10錠×10)、500錠(10錠×50)
瓶
500錠(プラスチック製瓶入り)
<フェブリク錠20mg>
PTP
100錠(10錠×10)、500錠(10錠×50)
瓶
500錠(プラスチック製瓶入り)
<フェブリク錠40mg>
PTP
100錠(10錠×10)
23. 主要文献
- 社内報告:生殖発生毒性(ラット).2010.(2011年1月21日承認、CTD2.6.6.6)
- Lehtisalo M,et al., Clin Transl Sci., 13 (6), 1236-43, (2020) »PubMed
- 社内報告:がん原性(マウス、ラット).2010.(2011年1月21日承認、CTD2.6.6.5)
- 社内報告:血漿中濃度及び排泄(健康成人、単回).2010.(2011年1月21日承認、CTD2.7.6.1)
- 社内報告:血漿中濃度(健康成人、単回).2010.(2011年1月21日承認、CTD2.7.6.5)
- 社内報告:血漿中濃度(健康成人、反復).2010.(2011年1月21日承認、CTD2.7.6.8)
- 社内報告:血漿中濃度(高尿酸血症患者、反復).2010.(2011年1月21日承認、CTD2.7.6.31)
- 社内報告:母集団薬物動態解析(健康成人、腎機能低下患者及び小児高尿酸血症患者).2023.(2023年6月26日承認、審査報告書)
- Mukoyoshi M,et al., Xenobiotica., 38 (5), 496-510, (2008) »PubMed
- Grabowski BA,et al., J Clin Pharmacol., 51 (2), 189-201, (2011) »PubMed
- 社内報告:代謝(ヒト).2010.(2011年1月21日承認、CTD2.7.2.2.1)
- 社内報告:血漿中濃度(腎機能低下患者、反復).2010.(2011年1月21日承認、CTD2.7.6.13)
- Mayer MD,et al., Am J Ther., 12 (1), 22-34, (2005) »PubMed
- Khosravan R,et al., J Clin Pharmacol., 46 (1), 88-102, (2006) »PubMed
- Khosravan R,et al., J Clin Pharmacol., 48 (9), 1014-24, (2008) »PubMed
- Khosravan R,et al., Br J Clin Pharmacol., 65 (3), 355-63, (2008) »PubMed
- 社内報告:薬物相互作用(コルヒチン).2010.(2011年1月21日承認、CTD2.7.6.18、2.7.6.19)
- Khosravan R,et al., J Clin Pharmacol., 46 (8), 855-66, (2006) »PubMed
- 社内報告:薬物相互作用(デシプラミン).2010.(2011年1月21日承認、CTD2.7.6.16)
- 社内報告:薬物相互作用(ワルファリン).2010.(2011年1月21日承認、CTD2.7.6.23、2.7.6.24)
- Grabowski BA,et al., Br J Clin Pharmacol., 70 (1), 57-64, (2010)
- 社内報告:薬物相互作用(テオフィリン).2010.(2011年1月21日承認、CTD2.7.6.25)
- 社内報告:薬物相互作用(ロシグリタゾン).2010.(2011年1月21日承認、CTD2.7.6.26)
- 社内報告:プラセボ対照無作為化二重盲検用量反応比較試験(痛風を含む高尿酸血症患者).2010.(2011年1月21日承認、CTD2.7.6.33)
- 社内報告:アロプリノール対照無作為化二重盲検比較試験(痛風を含む高尿酸血症患者).2010.(2011年1月21日承認、CTD2.7.6.35a)
- 社内報告:長期投与試験(痛風を含む高尿酸血症患者).2010.(2011年1月21日承認、CTD2.7.6.40)
- 社内報告:国内第II相試験(痛風を含む高尿酸血症の小児患者).2023.(2023年6月26日承認、CTD2.7.6.8)
- 社内報告:国内第II相継続投与試験(痛風を含む高尿酸血症の小児患者).2023.(2023年6月26日承認、CTD2.7.6.9)
- Tamura K,et al., Int J Clin Oncol., 21 (5), 996-1003, (2016) »PubMed
- Takano Y,et al., Life Sci., 76 (16), 1835-47, (2005) »PubMed
- 社内報告:血中及び尿中尿酸低下作用(ラット).2010.(2011年1月21日承認、CTD2.6.2.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
帝人ファーマ株式会社
メディカル情報グループ
〒100-8585
東京都千代田区霞が関3丁目2番1号
電話:フリーダイヤル 0120-189-315
製品情報問い合わせ先
帝人ファーマ株式会社
メディカル情報グループ
〒100-8585
東京都千代田区霞が関3丁目2番1号
電話:フリーダイヤル 0120-189-315
26. 製造販売業者等
26.1 製造販売元
帝人ファーマ株式会社
東京都千代田区霞が関3丁目2番1号