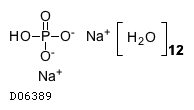医薬品情報
| 総称名 | リン酸Na |
|---|---|
| 一般名 | リン酸水素ナトリウム水和物 リン酸二水素ナトリウム水和物 |
| 欧文一般名 | Dibasic Sodium Phosphate Hydrate Sodium Dihydrogen Phosphate Dihydrate |
| 薬効分類名 | 補正用電解質液 |
| 薬効分類番号 | 3319 |
| JAPIC | 添付文書(PDF) |
添付文書情報2023年10月 改訂(第1版)

|
4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リン酸Na補正液0.5mmol/mL | Sodium Phosphate Corrective Injection 0.5mmol/mL | 大塚製薬工場 | 3319407A1025 | 143円/管 | 処方箋医薬品注) |
4. 効能または効果
電解質補液の電解質補正
6. 用法及び用量
電解質補液の電解質の補正用として、体内の水分、電解質の不足に応じて電解質液に添加して用いる。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.1 本剤は電解質の補正用製剤であるため、必ず希釈して使用すること。
8.2 本剤の急速な投与により高リン血症、血中カルシウム減少、腎臓へのリン酸カルシウム沈着等が発現するおそれがあるため、投与は緩徐に行うこと。
8.3 投与に際しては、患者の血清リン濃度及び血清カルシウム濃度の測定、症状観察を行うこと。必要に応じて、腎機能(尿蛋白等)の検査を行うことが望ましい。
8.4 本剤を長期間投与する場合には、臨床症状の推移を十分観察したうえで、慎重に投与すること。本剤の投与が不要となった場合には、投与を中止すること。
9. 特定の背景を有する患者に関する注意
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
本剤の臨床試験において、新生児(低出生体重児)で紅斑、血中カルシウム減少が見られたので、これらの症状が見られた場合には、投与を中止するなど適切な処置を行うこと。[7.参照]
9.8 高齢者
投与速度を緩徐にし、減量するなど注意すること。一般に生理機能が低下している。
11. 副作用
11.2 その他の副作用
| 5%以上 | |
| 過敏症 | 紅斑 |
| 電解質異常 | 血中カルシウム減少 |
13. 過量投与
13.1 症状
海外の同一成分薬において、過量投与により、高リン血症、高ナトリウム血症、組織へのリン酸カルシウム沈着(腎臓、皮膚、角膜、肺等)、テタニー症状などが発現することが報告されている。
13.2 処置
症状が認められた場合には、本剤の投与を速やかに中止し適切な処置を行うこと。
14. 適用上の注意
14.1 全般的な注意
使用時には、感染に対する配慮をすること。
14.2 薬剤調製時の注意
14.2.1 本剤は使用に際して、よく混合されるよう注意すること。
14.2.2 以下の製剤と配合する場合、沈殿を生じることがあるので注意すること。
・カルシウム塩を含む製剤
・マグネシウム塩を含む製剤
14.3 薬剤投与時の注意
14.3.1 新生児(低出生体重児を含む)に対してリン補給を行う際、カルシウム塩、マグネシウム塩を含む製剤と併用する場合には、本剤とは投与経路を別に設けるなど特に注意すること。
14.3.2 ゆっくり静脈内に点滴投与すること。
14.3.3 残液は使用しないこと。
16. 薬物動態
16.5 排泄
健康成人男性7例に32P-リン酸水素ナトリウムを静脈内投与した結果、投与後24時間の尿中累積排泄率は4.1〜13.0%であった1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(低出生体重児)
経口、経腸管栄養補給が不能又は不十分な新生児(低出生体重児)6例を対象とした非盲検非対照試験2)において、本剤1日0.37〜3.84mLを4〜14日間投与した。
有効性評価項目とした血清リン濃度は、すべての症例で本剤投与開始前に4mg/dL未満であったが、本剤投与により血清カリウム濃度に影響を与えることなく、投与終了時には、4mg/dL以上に補正できた。
副作用発現頻度は、33.3%(2/6例)であり、紅斑16.7%(1/6例)、カルシウムイオン減少16.7%(1/6例)であった。[7.参照]
有効性評価項目とした血清リン濃度は、すべての症例で本剤投与開始前に4mg/dL未満であったが、本剤投与により血清カリウム濃度に影響を与えることなく、投与終了時には、4mg/dL以上に補正できた。
副作用発現頻度は、33.3%(2/6例)であり、紅斑16.7%(1/6例)、カルシウムイオン減少16.7%(1/6例)であった。[7.参照]
17.1.2 国内第III相試験(腎不全患者)
血液透析を施行しており経静脈投与によりリンの補給を必要とする腎不全患者10例を対象とした非盲検非対照試験3)において、本剤1日2〜40mLを5〜12日間投与した。
有効性評価項目とした血清リン濃度は、すべての症例で本剤投与開始前に2.5mg/dL未満であったが、本剤投与により血清カリウム濃度に影響を与えることなく、投与終了時には3.5mg/dL以上に補正できた。
副作用発現頻度は、10.0%(1/10例)であり、血中カルシウム減少であった。
有効性評価項目とした血清リン濃度は、すべての症例で本剤投与開始前に2.5mg/dL未満であったが、本剤投与により血清カリウム濃度に影響を与えることなく、投与終了時には3.5mg/dL以上に補正できた。
副作用発現頻度は、10.0%(1/10例)であり、血中カルシウム減少であった。
18. 薬効薬理
18.1 作用機序
本剤は血清リン濃度の補正効果を示す。
19. 有効成分に関する理化学的知見
19.1. リン酸水素ナトリウム水和物
19.2. リン酸二水素ナトリウム水和物
| 一般的名称 | リン酸二水素ナトリウム水和物 |
|---|---|
| 一般的名称(欧名) | Sodium Dihydrogen Phosphate Dihydrate |
| 分子式 | NaH2PO4・2H2O |
| 分子量 | 156.01 |
| 物理化学的性状 | 無色又は白色の結晶又は結晶性の粉末である。 水に溶けやすく、エタノール(95)にほとんど溶けない。 やや潮解性である。 |
| 理化学知見その他 | 19.2 リン酸二水素ナトリウム水和物 |
20. 取扱い上の注意
以下の場合には使用しないこと。
・容器表面に水滴や結晶が認められる場合
・容器から薬液が漏れている場合
・性状その他薬液に異状が認められる場合
22. 包装
20mL 10管、50管 プラスチックアンプル
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
株式会社大塚製薬工場
輸液DIセンター
〒101-0048
東京都千代田区神田司町2-2
電話:0120-719-814
FAX:03-5296-8400
製品情報問い合わせ先
株式会社大塚製薬工場
輸液DIセンター
〒101-0048
東京都千代田区神田司町2-2
電話:0120-719-814
FAX:03-5296-8400
26. 製造販売業者等
26.1 製造販売元
株式会社大塚製薬工場
徳島県鳴門市撫養町立岩字芥原115
26.2 販売提携
大塚製薬株式会社
東京都千代田区神田司町2-9