医薬品情報
| 総称名 | オンブレス |
|---|---|
| 一般名 | インダカテロールマレイン酸塩 |
| 欧文一般名 | Indacaterol Maleate |
| 製剤名 | インダカテロールマレイン酸塩吸入用カプセル |
| 薬効分類名 | 長時間作用性吸入気管支拡張剤 |
| 薬効分類番号 | 2259 |
| ATCコード | R03AC18 |
| KEGG DRUG |
D09319
インダカテロールマレイン酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オンブレス吸入用カプセル150μg | onbrez inhalation capsules 150μg | ノバルティスファーマ | 2259710G1020 | 125.4円/カプセル | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤は慢性閉塞性肺疾患の症状の長期管理に用いること。本剤は慢性閉塞性肺疾患の増悪時における急性期治療を目的として使用する薬剤ではない。
5.2 本剤は気管支喘息治療を目的とした薬剤ではないため、気管支喘息治療の目的には使用しないこと。
6. 用法及び用量
通常、成人には1回1カプセル(インダカテロールとして150μg)を1日1回本剤専用の吸入用器具を用いて吸入する。
7. 用法及び用量に関連する注意
7.1 本剤は吸入用カプセルであり、必ず専用の吸入用器具(ブリーズヘラー)を用いて吸入し、内服しないこと。[14.1.2参照]
7.2 本剤は1日1回、一定の時間帯に吸入すること。吸入できなかった場合は、翌日、通常吸入している時間帯に1回分を吸入すること。
7.3 本剤を他の長時間作用性β2刺激剤又は長時間作用性β2刺激剤を含む配合剤と同時に使用しないこと。
8. 重要な基本的注意
8.1 用法・用量どおり正しく使用しても効果が認められない場合には、本剤が適当ではないと考えられるので、漫然と投与を継続せず中止すること。
8.2 吸入薬の場合、薬剤の吸入により気管支痙攣が誘発され生命を脅かすおそれがある。気管支痙攣が認められた場合は、直ちに投与を中止し、適切な処置を行うこと。
8.3 本剤の交感神経刺激作用により脈拍増加、血圧上昇等の心血管系症状があらわれるおそれがあるので、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
8.4 過度に使用を続けた場合、不整脈、場合により心停止を起こすおそれがあるので、使用が過度にならないよう注意すること。また、患者に対し、本剤の過度の使用による危険性を理解させ、1日1回を超えて使用しないよう注意を与えること。本剤の気管支拡張作用は通常24時間持続するので、その間は次の投与を行わないこと。[13.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 甲状腺機能亢進症の患者
甲状腺機能亢進症の症状を悪化させるおそれがある。
9.1.2 心血管障害(冠動脈疾患、急性心筋梗塞、不整脈、高血圧、QT間隔延長等)のある患者
交感神経刺激作用等により症状を悪化させるおそれがある。
9.1.3 糖尿病の患者
血糖値をモニタリングするなど慎重に投与すること。高用量のβ2刺激剤を投与すると、血糖値が上昇するおそれがある。
9.1.4 てんかん等の痙攣性疾患のある患者
痙攣の症状を悪化させるおそれがある。
9.1.5 気管支喘息を合併した患者
気管支喘息の管理が十分行われるよう注意すること。
9.1.6 低酸素血症の患者
血清カリウム値をモニターすることが望ましい。低酸素血症により血清カリウム値の低下の心リズムに及ぼす影響が増強されることがある。[11.1.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ウサギ)で骨格変異の発生率増加を伴う生殖発生毒性が報告されている。また、動物実験(ラット)で、胎盤通過性が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
用量調節の必要はないが、患者の状態を観察しながら注意して投与すること。臨床試験において、年齢とともに最高血中濃度及び全身暴露量が増加することが示唆されている。[16.1.1参照]
10. 相互作用
相互作用序文
本剤は主に代謝酵素チトクロームP450 3A4(CYP3A4)で代謝され、またP糖蛋白(Pgp)の基質である。
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
P糖蛋白(Pgp)
10.2 併用注意
| CYP3A4を阻害する薬剤 エリスロマイシン等 [16.7.1参照] | 本剤の血中濃度が上昇するおそれがある。エリスロマイシンとの併用投与により本剤のCmax及びAUCがそれぞれ1.2倍及び1.4〜1.6倍に上昇したとの報告がある。 | CYP3A4の活性を阻害することにより、本剤の代謝が阻害され、血中濃度が上昇すると考えられる。 |
| リトナビル [16.7.3参照] | 本剤のAUCが上昇するおそれがある。リトナビルとの併用投与により本剤のAUCが1.6〜1.8倍に上昇したとの報告がある。 | CYP3A4及びP糖蛋白の活性を阻害することにより、本剤の代謝及び排泄が阻害されると考えられる。 |
| P糖蛋白を阻害する薬剤 ベラパミル等 [16.7.2参照] | 本剤の血中濃度が上昇するおそれがある。ベラパミルとの併用投与により本剤のCmax及びAUCがそれぞれ1.5倍及び1.4〜2.0倍に上昇したとの報告がある。 | P糖蛋白の活性を阻害することにより、本剤の排泄が阻害され、血中濃度が上昇すると考えられる。 |
| QT間隔延長を起こすことが知られている薬剤 MAO阻害剤 三環系抗うつ剤等 | QT間隔が延長され心室性不整脈等のリスクが増大するおそれがある。 | いずれもQT間隔を延長させる可能性がある。 |
| 交感神経刺激剤 | 本剤の作用が増強するおそれがある。 | 交感神経刺激剤との併用により、アドレナリン作動性神経刺激が増大する可能性がある。 |
| キサンチン誘導体 ステロイド剤 利尿剤 サイアザイド系利尿剤 サイアザイド系類似利尿剤 ループ利尿剤 [11.1.1参照] | 低カリウム血症による心血管事象(不整脈)を起こすおそれがあるため、血清カリウム値に注意すること。 | キサンチン誘導体はアドレナリン作動性神経刺激を増大させるため、血清カリウム値の低下が増強する可能性がある。 ステロイド剤及びこれらの利尿剤は尿細管でのカリウム排泄促進作用があるため、血清カリウム値の低下が増強する可能性がある。 |
| β遮断剤(点眼剤を含む) | 本剤の作用が減弱するおそれがある。やむを得ず併用する場合には、心選択性β遮断剤が望ましいが、注意すること。 | β遮断剤との併用により、本剤の作用が拮抗される可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 感染症 | − | 鼻咽頭炎 | 上気道感染、副鼻腔炎 |
| 代謝及び栄養障害 | − | − | 糖尿病・高血糖 |
| 神経系障害 | − | 頭痛 | めまい、錯感覚 |
| 心血管障害 | − | 心房細動、動悸 | 虚血性心疾患、頻脈 |
| 呼吸器障害 | 咳嗽 | 口腔咽頭痛 | 鼻漏、気管支痙攣 |
| 過敏症 | − | 蕁麻疹 | 血管浮腫、そう痒症、発疹 |
| 筋骨格系障害 | − | 筋痙縮 | 筋肉痛、筋骨格痛 |
| その他 | − | 末梢性浮腫 | 胸痛、胸部不快感、口渇 |
13. 過量投与
13.1 症状
β2刺激剤の薬理学的作用による症状(頻脈、振戦、動悸、頭痛、悪心、嘔吐、傾眠、心室性不整脈、代謝性アシドーシス、低カリウム血症及び高血糖等)が過度にあらわれるおそれがある。外国において、慢性閉塞性肺疾患患者に対する3,000μgの単回投与で、中等度の脈拍増加、収縮期血圧上昇及びQT間隔延長が認められた。また、本剤1日1回600μgを1年間投与した場合に認められた副作用は、推奨用量を投与した場合と全般的に類似していたが、更に振戦と貧血が認められた。[8.4参照]
13.2 処置
治療剤として心選択性β遮断剤があるが、気管支痙攣を誘発する可能性があるため、使用にあたっては十分に注意すること。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 吸入前
(1)医療従事者は、患者に専用の吸入用器具(ブリーズヘラー)及び使用説明文書を渡し、正しい使用方法を十分に指導すること。また、呼吸状態の改善が認められない場合には、本剤を吸入せずに内服していないか確認すること。
(2)吸入の直前にブリスター(アルミシート)からカプセルを取り出すように指導すること。
(3)本剤のカプセル内容物は少量であり、カプセル全体に充填されていない。
14.1.2 吸入時
本剤は吸入用カプセルであり、必ず専用の吸入用器具(ブリーズヘラー)を用いて吸入し、内服しないこと。[7.1参照]
15. その他の注意
15.1 臨床使用に基づく情報
臨床試験において、本剤吸入直後の散発的な咳嗽(多くは15秒以内に発現し、持続時間は10秒程度)が平均11.3%〜23.1%観察され、227例中1例(300μg注)投与例)が咳嗽のため投与中止した。これらの咳嗽と気管支痙攣の発現や慢性閉塞性肺疾患の増悪、本剤の有効性低下との関連性は認められなかったと報告されている。
注)本剤の承認された用法及び用量は、1日1回150μgの吸入投与である。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人慢性閉塞性肺疾患患者にインダカテロール150〜600μg注)を単回吸入投与したとき、血清中濃度は20分で最高値に達した。Cmaxは用量比例をわずかに上回ったが、AUCは用量に比例して増加した1)。
| 用量(μg) | n | Tmax(h) | Cmax(pg/mL) | AUC(pg・h/mL) |
| 150 | 48 | 0.33(0.17〜1.13) | 157±61.6 | 1,140±503 |
| 300 | 47 | 0.33(0.20〜1.10) | 361±136 | 2,540±1,070 |
| 600 | 48 | 0.33(0.15〜1.17) | 740±285 | 5,150±2,100 |
また、日本人慢性閉塞性肺疾患患者にインダカテロール150〜600μg注)を単回吸入投与したときの血清中濃度推移を65歳以上及び65歳未満に層別した薬物動態パラメータは次のとおりであった1)。[9.8参照]
| 用量(μg) | 65歳未満 | 65歳以上 | ||||
| n | Cmax(pg/mL) | AUC(pg・h/mL) | n | Cmax(pg/mL) | AUC(pg・h/mL) | |
| 150 | 13 | 124±36.2 | 823±294 | 35 | 170±64.7 | 1,260±515 |
| 300 | 13 | 282±81.3 | 1,960±748 | 34 | 392±142 | 2,760±1,100 |
| 600 | 13 | 582±133 | 3,770±1,040 | 35 | 799±305 | 5,660±2,170 |
16.1.2 反復投与
健康成人にインダカテロール150〜600μg注)を1日1回14日間反復吸入投与したとき、投与初日及び14日目の血清中濃度はともに約15分で最高値に達した。Cmax及びAUCは用量に比例して増加した。また、投与開始14日目までに定常状態に到達し、定常状態時の血清中暴露量は単回投与時に比べ2.9〜3.5倍であった2)(外国人のデータ)。
| Day | 用量(μg) | n | Tmax(h) | Cmax(pg/mL) | AUC(pg・h/mL) | 半減期(h) |
| 1日目 | 150 | 72 | 0.25(0.25〜0.48) | 253±121 | 1,200±554 | − |
| 300 | 73 | 0.25(0.22〜1.08) | 537±224 | 2,640±862 | − | |
| 600 | 37 | 0.25(0.25〜0.75) | 1,040±286 | 5,280±1,160 | − | |
| 14日目 | 150 | 70 | 0.25(0.22〜3.08) | 439±196 | 3,880±1,550 | 49.1±17.3 |
| 300 | 68 | 0.25(0.17〜1.08) | 859±264 | 8,140±2,390 | 44.7±12.4 | |
| 600 | 37 | 0.25(0.25〜0.42) | 1,660±541 | 15,100±3,430 | 39.8±12.1 |
健康成人にインダカテロールを1日1回14日間反復吸入投与したときの血清中濃度推移
16.2 吸収
16.3 分布
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
軽度及び中等度の肝機能障害患者にインダカテロールを単回吸入投与したとき、インダカテロールのCmaxは健康成人の0.98倍及び0.77倍、AUCは健康成人の0.87〜1.0倍及び0.95〜1.1倍であった。肝機能障害による血清中蛋白結合率の変化はみられなかった。重度の肝機能障害患者に対する検討は行っていない10)(外国人のデータ)。
16.6.2 UGT1A1変異型を有する被験者
活性の低いUGT1A1変異型を有する被験者にインダカテロールを反復吸入投与したとき、定常状態時のCmax及びAUCはそれぞれ野生型を有する被験者の1.2倍であった11)(外国人のデータ)。
16.7 薬物相互作用
16.7.1 エリスロマイシン
16.7.2 ベラパミル
16.7.3 リトナビル
16.7.4 ケトコナゾール(経口剤は国内未発売)
健康成人男子にケトコナゾール200mg(経口投与)とインダカテロール300μg注)(吸入投与)を併用したとき、インダカテロールのCmax及びAUCがそれぞれ1.3倍及び1.9倍に上昇した15)(外国人のデータ)。
注)本剤の承認された用法及び用量は、1日1回150μgの吸入投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第III相試験
投与12週後のプラセボに対する優越性の検証を目的として、慢性閉塞性肺疾患患者347例(日本人152例)を対象に無作為化プラセボ対照二重盲検比較試験を実施し、そのうち230例(日本人102例)に本剤150μg又は300μg注)が投与された。本剤は初回投与5分後から肺機能(FEV1)を改善し、投与12週後のトラフFEV1は全体集団及び日本人部分集団ともに、次表のとおりプラセボ群と比べて有意に改善した。また、生活の質(QOL)[St.George's Respiratory Questionnaire(SGRQ)]、呼吸困難[Baseline dyspnea index/Transition dyspnea index(BDI/TDI)]がプラセボ群と比べて有意に改善した16)。
| 解析対象集団 | 治療群 | 症例数 | トラフFEV1 (L) LS mean±SE | プラセボ群との差(L) LS mean±SE(p値) |
| 全体集団 | インダカテロール300μg注) | 110 | 1.37±0.023 | 0.20±0.020 (p<0.001) |
| インダカテロール150μg | 109 | 1.34±0.024 | 0.17±0.020 (p<0.001) | |
| プラセボ | 104 | 1.17±0.025 | / | |
| 日本人部分集団 | インダカテロール300μg注) | 48 | 1.40±0.020 | 0.23±0.028 (p<0.001) |
| インダカテロール150μg | 49 | 1.38±0.020 | 0.20±0.027 (p<0.001) | |
| プラセボ | 43 | 1.17±0.021 | / |
副作用発現頻度は、本剤150μg投与群で9.6%(11/114例、日本人50例を含む)及び本剤300μg注)投与群で13.8%(16/116例、日本人52例を含む)であった。主な副作用は、150μg群では咳嗽1.8%(2例)、頭痛1.8%(2例)等、300μg注)群では咳嗽6.9%(8例)、蕁麻疹1.7%(2例)等であった16)。
17.1.2 国内第III相試験
慢性閉塞性肺疾患患者186例を対象とした無作為化非盲検並行群間比較52週長期投与試験で、本剤300μg注)を125例に投与したところ、本剤300μg群のトラフFEV1は上昇し、52週間の投与期間中、トラフFEV1に効果減弱はみられなかった。
副作用発現頻度は、本剤投与群で21.6%(27/125例)であった。主な副作用は、咳嗽8.8%(11例)、筋痙縮2.4%(3例)等であった17)。
注)本剤の承認された用法及び用量は、1日1回150μgの吸入投与である。
18. 薬効薬理
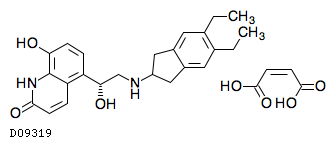
19. 有効成分に関する理化学的知見
19.1. インダカテロールマレイン酸塩
22. 包装
14カプセル[7カプセル×2シート、ブリーズヘラー1個]
28カプセル[7カプセル×4シート、ブリーズヘラー1個]
23. 主要文献
- 社内資料:日本人COPD患者を対象とした用量設定試験(2011年7月1日承認、CTD2.7.2-2.2.1.1)
- Khindri S.,et al., BMC Pulm.Med., 11, 31, (2011) »PubMed »DOI
- 社内資料:吸入投与時の絶対的バイオアベイラビリティの評価(2011年7月1日承認、CTD2.7.1-2.2.1.1)
- 社内資料:吸入投与時と経口投与時のバイオアベイラビリティの比較(2011年7月1日承認、CTD2.7.1-2.2.1.2)
- 社内資料:血漿及び血清中蛋白結合率(2011年7月1日承認、CTD2.6.4-4.1)
- 社内資料:吸収、代謝及び排泄の検討(2011年7月1日承認、CTD2.7.2-2.1.2.5)
- 社内資料:代謝酵素の同定(2011年7月1日承認、CTD2.6.4-5.2)
- 社内資料:Caco-2細胞単層膜を用いた膜透過性試験(2011年7月1日承認、CTD2.6.4-7.2)
- 社内資料:日本人及び外国人健康成人を対象とした単回投与試験(2011年7月1日承認、CTD2.7.2-2.1.1.1)
- 社内資料:肝機能障害が薬物動態に及ぼす影響(2011年7月1日承認、CTD2.7.2-2.1.2.6)
- 社内資料:UGT1A1変異型の薬物動態(2011年7月1日承認、CTD2.7.2-2.1.2.7)
- 社内資料:エリスロマイシンとの薬物間相互作用(2011年7月1日承認、CTD2.7.2-2.1.2.10)
- 社内資料:ベラパミルとの薬物間相互作用(2011年7月1日承認、CTD2.7.2-2.1.2.9)
- 社内資料:リトナビルとの薬物間相互作用
- 社内資料:ケトコナゾールとの薬物間相互作用(2011年7月1日承認、CTD2.7.2-2.1.2.8)
- 社内資料:COPD患者(日本を含むアジア地域)を対象とした二重盲検比較試験(2011年7月1日承認、CTD2.7.6-5.1.2)
- 社内資料:COPD患者(日本)を対象とした長期投与試験(2011年7月1日承認、CTD2.7.6-5.2.1)
- 社内資料:アドレナリンβ受容体に対するインダカテロールのIn vitroにおける選択性及び機能活性(2011年7月1日承認、CTD2.4-3.1.1)
- 社内資料:覚醒下モルモットにおけるインダカテロールの作用持続の検討(2011年7月1日承認、CTD2.4-3.1.4)
- 社内資料:アカゲザルを用いたβ刺激剤のメサコリン誘発気道収縮に対する抑制作用(2011年7月1日承認、CTD2.4-3.1.4)
24. 文献請求先及び問い合わせ先
文献請求先
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金9:00〜17:30(祝祭日及び当社休日を除く)
製品情報問い合わせ先
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金9:00〜17:30(祝祭日及び当社休日を除く)
26. 製造販売業者等
26.1 製造販売(輸入)
ノバルティスファーマ株式会社
東京都港区虎ノ門1-23-1