医薬品情報
| 総称名 | コアベータ |
|---|---|
| 一般名 | ランジオロール塩酸塩 |
| 欧文一般名 | Landiolol Hydrochloride |
| 製剤名 | 注射用ランジオロール塩酸塩 |
| 薬効分類名 | 短時間作用型β1選択的遮断剤 |
| 薬効分類番号 | 2123 |
| ATCコード | C07AB14 |
| KEGG DRUG |
D01847
ランジオロール塩酸塩
|
| KEGG DGROUP |
DG01653
抗不整脈薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第2版)
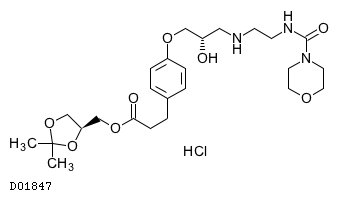
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| コアベータ静注用12.5mg | COREBETA for I.V.Injection | 小野薬品工業 | 2123404D2021 | 2616円/瓶 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 心原性ショックの患者[心機能を抑制し、症状が悪化するおそれがある。]
2.2 糖尿病性ケトアシドーシス、代謝性アシドーシスのある患者[アシドーシスによる心筋収縮力の抑制を増強するおそれがある。]
2.3 房室ブロック(II度以上)、洞不全症候群など徐脈性不整脈患者[刺激伝導系に対し抑制的に作用し、悪化させるおそれがある。]
2.4 肺高血圧症による右心不全のある患者[心機能を抑制し、症状が悪化するおそれがある。]
2.5 うっ血性心不全のある患者[心機能を抑制し、症状が悪化するおそれがある。]
2.7 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
コンピューター断層撮影による冠動脈造影における高心拍数時の冠動脈描出能の改善
5. 効能または効果に関連する注意
5.1 本剤は、コンピューター断層撮影(CT)検査室の入室後に患者の心拍数を確認し、心拍数の減少が必要な場合に限り使用すること。
5.2 心拍数90回/分を超える患者における有効性及び安全性は確認されていない。
5.3 心房細動を有する患者における有効性及び安全性は確認されていない。
6. 用法及び用量
ランジオロール塩酸塩として、1回0.125mg/kgを1分間で静脈内投与する。
7. 用法及び用量に関連する注意
7.1 本剤の静脈内投与終了の4〜7分後を目安に冠動脈CTを開始すること。
7.3 本剤投与に際しては、下記の体重別投与量表を参考にすること。
| 体重 | 投与量 | 体重 | 投与量 |
| 30kg | 3.0mL | 70kg | 7.0mL |
| 40kg | 4.0mL | 80kg | 8.0mL |
| 50kg | 5.0mL | 90kg | 9.0mL |
| 60kg | 6.0mL | 100kg | 10.0mL |
8. 重要な基本的注意
8.1 本剤投与前には、過度の低血圧ではないことを確認すること。[9.1.4参照]
8.2 冠動脈CTの前に硝酸薬を投与する場合は、硝酸薬投与による一過性の循環動態の変動が安定化し、過度の血圧低下等がないことを確認したうえで、本剤を投与することが望ましい。
8.3 本剤投与時には、心拍数をモニタリングし、本剤投与中に過度の心拍数減少が生じた場合は、本剤の投与を中止すること。
8.4 本剤投与による過度の血圧低下に注意し、冠動脈CT撮像後は、過度の血圧低下がないことを確認すること。[13.1参照]
8.5 本剤使用下でアナフィラキシー様反応が生じた場合、通常用量のアドレナリンによる治療に抵抗性を示す可能性もあることにも留意して、適切な処置を行うこと。[15.1.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 左室収縮機能障害のある患者
心機能を抑制し、症状が悪化するおそれがある。
9.1.2 気管支痙攣性疾患の患者
気管支筋収縮作用により、痙攣症状の誘発、悪化を起こすおそれがある。本剤はβ1受容体選択的遮断剤であるが、弱いながらもβ2受容体遮断作用も有する。[18.2.1参照]
9.1.3 コントロール不十分な糖尿病患者
低血糖症状としての頻脈等の交感神経系反応をマスクするおそれがある。
9.1.4 低血圧症の患者
心機能を抑制し、症状が悪化するおそれがある。[8.1参照]
9.1.5 重篤な血液障害のある患者
薬剤の代謝、排泄が影響を受けるおそれがある。[16.4参照]
9.1.6 末梢循環障害のある患者(壊疽、レイノー症候群、間歇性跛行等)
末梢血管の拡張を抑制し、症状が悪化するおそれがある。本剤はβ1受容体選択的遮断剤であるが、弱いながらもβ2受容体遮断作用も有する。[18.2.1参照]
9.1.7 褐色細胞腫又はパラガングリオーマの患者
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害患者
薬剤の排泄が影響を受けるおそれがある。[16.5参照]
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
十分に患者の状態を観察しながら投与すること。生理機能が低下していることが多く、本剤の作用が強く発現するおそれがある。
10. 相互作用
10.2 併用注意
| 交感神経系に対し抑制的に作用する他の薬剤 レセルピン等 | 交感神経系の過剰の抑制をきたすおそれがあるので、減量するなど慎重に投与すること。 | レセルピン等のカテコールアミン枯渇剤が投与されている時にβ遮断剤のカテコールアミン遮断作用が加わると交感神経活性が過度に低下するおそれがある。 |
| 血糖降下剤 インスリン等 | 低血糖症状(頻脈等)をマスクすることがあるので、血糖値に注意すること。 | 血糖値が低下するとカテコールアミンが副腎から分泌され、心拍数を増加させるが、心臓のβ1受容体が遮断されていると、心拍数の増加が起きず、頻脈のような低血糖症状がマスクされるおそれがある。 |
| カルシウム拮抗剤 ベラパミル ジルチアゼム等 | 相互に作用が増強されるおそれがある。うっ血性心不全のおそれのある患者、洞房ブロック、房室ブロックのある患者では重度の低血圧、徐脈、心不全が発現するおそれがあるので、減量するなど慎重に投与すること。 | カルシウム拮抗剤とβ遮断剤は共に心収縮力や刺激伝導系の抑制作用、血圧低下作用を有するため、これらの薬剤との併用により作用が増強するおそれがある。 |
| ジギタリス製剤 | 房室伝導時間が延長するおそれがあるので、減量するなど慎重に投与すること。 | ジギタリス製剤とβ遮断剤は共に房室伝導時間の延長作用を有するため、これらの薬剤との併用により作用が増強するおそれがある。 |
| クラスI抗不整脈剤 ジソピラミド プロカインアミド等 クラスIII抗不整脈剤 アミオダロン ニフェカラント等 | 過度の心機能抑制があらわれるおそれがあるので、減量するなど慎重に投与すること。 | クラスI抗不整脈剤及びクラスIII抗不整脈剤は刺激伝導系に対する抑制作用を有するので、これらの薬剤との併用で過度の心機能抑制作用が起こるおそれがある。 |
| クロニジン | クロニジン投与中止後のリバウンド現象(血圧上昇)を増強する可能性がある。冠動脈CT実施前の数日以内にクロニジンを投与中止した場合には、本剤の投与を慎重に行うこと。 | クロニジンを投与されている患者でクロニジンを中止すると、血中カテコールアミンが上昇し、血圧上昇をきたす。β遮断剤を投与すると、カテコールアミンによるα刺激作用が優位になり、血管収縮がさらに増強されるおそれがある。 |
| 交感神経刺激剤 アドレナリン等 [13.2参照] | 血管収縮により、血圧上昇をきたすことがあるので注意すること。 | α、β刺激作用を有する薬剤の場合には、本剤により交感神経刺激剤のβ刺激作用が抑制され、α刺激作用が優位となり、血管収縮が起こるおそれがある。 |
| コリンエステラーゼ阻害剤 ネオスチグミン ジスチグミン臭化物 エドロホニウム塩化物等 | 本剤の代謝を阻害し、作用が増強及び作用時間が延長するおそれがあるので、減量するなど慎重に投与すること。 | 本剤はエステラーゼで代謝されるため、これらの薬剤との併用により本剤の作用が増強及び作用時間が延長するおそれがある。 |
11. 副作用
11.2 その他の副作用
| 1%以上 | 1%未満 | |
| 皮膚 | 発疹、蕁麻疹 | |
| 循環器 | 血圧低下 | |
| 消化器 | 悪心 | |
| 呼吸器 | 鼻閉、くしゃみ | |
| 肝臓 | ALT上昇、AST上昇、ビリルビン上昇、γ-GTP上昇、Al-P上昇 | |
| 腎臓 | クレアチニン上昇 | |
| その他 | 白血球増加、血小板減少、総蛋白減少、カリウム上昇 |
13. 過量投与
13.1 症状
過度の血圧低下又は過度の徐脈をきたす。[8.4参照]
13.2 処置
直ちに本剤の投与を中止すること。更に、必要に応じて下記等の適切な処置を行うこと。[10.2参照]
血圧低下
輸液の投与等の処置を行う。更に、必要に応じて、昇圧剤を投与するが、交感神経刺激剤を用いる場合はα刺激作用が優位に発現することによる過度の昇圧に注意して投与すること。
徐脈
アトロピンを投与し、更に必要に応じてβ1刺激薬(ドブタミン等)や輸液等を投与する。
14. 適用上の注意
14.1 薬剤調製時の注意
10mg/mLを超える濃度で投与すると、局所反応や皮膚壊死が発現するおそれがあるので、十分に注意すること。本剤は、1バイアル(ランジオロール塩酸塩12.5mg)を1.25mL以上の生理食塩液等で溶解すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤と効能又は効果、用法及び用量が異なるが、同一の有効成分を含有する「オノアクト点滴静注用50mg・150mg」における重大な副作用として、ショック(過度の血圧低下)、心停止、完全房室ブロック、洞停止、高度徐脈、心不全が認められている。
15.1.2 β遮断剤(プロプラノロール塩酸塩、アテノロール等)服用中の患者では、他の薬剤によるアナフィラキシー反応がより重篤になることがあり、また、通常用量のアドレナリンによる治療に抵抗するとの報告、並びにグルカゴン静注が有効であったとの報告がある。[8.5参照]
16. 薬物動態
16.1 血中濃度
健康成人6例に0.5、1.0、1.5及び2.0mg/kgで1分間静脈内投与注)すると、全血中濃度−時間曲線下面積(AUC0-∞)はそれぞれ14.2、28.3、43.5及び68.9μg・min/mLである。また、投与終了後の消失半減期(T1/2)は3.5〜3.7分、全身クリアランス(CLtot)は31.1〜38.0mL/min/kgである。1)
| 投与量(mg/kg) | AUC0-∞(μg・min/mL) | T1/2(min) | CLtot(mL/min/kg) |
| 0.5 | 14.2±4.8 | 3.5±0.6 | 38.0±10.3 |
| 1.0 | 28.3±5.2 | 3.7±0.2 | 36.3±6.5 |
| 1.5 | 43.5±6.8 | 3.7±0.2 | 35.1±4.6 |
| 2.0 | 68.9±19.6 | 3.7±0.3 | 31.1±8.8 |
16.3 分布
ヒト血清に対する蛋白結合率は1.5〜7.0%である(in vitro、限外ろ過法)。2)
16.4 代謝
本剤はヒト肝臓及び血漿中で加水分解され、速やかに代謝される。肝代謝クリアランスは肝血流が律速と考えられ、全身クリアランスの約半分を占める。また、in vitroの血漿中代謝半減期は4.1分であり、血漿中での代謝の寄与も大きい。ヒト肝臓における主代謝酵素はカルボキシエステラーゼ、ヒト血漿中における主代謝酵素は擬コリンエステラーゼであると推定された。3)
また、本剤及びその代謝物(カルボン酸体、安息香酸体)はヒトのチトクロームP450の分子種(CYP1A2、CYP2C9、CYP2C19、CYP2D6及びCYP3A4)に対してほとんど阻害活性を示さなかった(in vitro)。3)[9.1.5、9.3.1参照]
また、本剤及びその代謝物(カルボン酸体、安息香酸体)はヒトのチトクロームP450の分子種(CYP1A2、CYP2C9、CYP2C19、CYP2D6及びCYP3A4)に対してほとんど阻害活性を示さなかった(in vitro)。3)[9.1.5、9.3.1参照]
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 肝障害患者
肝障害患者6例(Child-Pugh分類A:5例、B:1例)及び健康成人6例に0.06mg/kg/minで1分間投与後、0.02mg/kg/minで60分間静脈内持続投与注)したとき、全血中濃度のCmax及びAUC0-∞はそれぞれ1.42及び1.44倍、肝障害患者で高く推移したが、T1/2は4.0分であり、健康成人と差がないことが示された。4)[9.3.1参照]
| Cmax(ng/mL) | C61min(ng/mL) | AUC0-∞(μg・min/mL) | T1/2(min) | |
| 肝障害患者 | 942±140 | 866±54 | 52.4±5.2 | 4.0±0.4 |
| 健康成人 | 665±119 | 641±125 | 36.3±3.6 | 4.0±1.5 |
注)本剤の承認された用法及び用量は、1回0.125mg/kgを1分間で静脈内投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内後期第II相試験
(1)プラセボを対照とした二重盲検比較試験において、症状、理学的所見及び非侵襲的検査により虚血性心疾患が疑われ、冠動脈造影が必要で、冠動脈CT前の心拍数が70回/分以上、90回/分以下の患者を対象に、本剤0.125mg/kgを1分間で静脈内投与した。主要評価項目である冠動脈CTにおける冠動脈描出能(冠動脈狭窄の程度が診断可能な被験者の割合)において、本剤群はプラセボ群に対し有意な改善効果を示した。なお、本試験は64列CT(X線管球1回転当たり64スライスの断面を撮影できるCT)機器1機種を使用した。また、安全性評価対象61例中6例(9.8%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、血圧低下2例(3.3%)であった。5)
| 投与群 | 冠動脈描出能(診断可能な被験者の割合) |
| プラセボ群 | 25.9%(15/58例) |
| 本剤群 | 63.6%*(35/55例) |
(2)副次評価項目である冠動脈CTにおける撮影時の心拍数において、本剤群はプラセボ群に対し有意な低下を示した。投与30分後の心拍数においては、プラセボ群に対し有意な低下を認めなかった。5)[8.6参照]
| 心拍数(回/分) | |||
| 投与前 | 撮影時 | 30分後 | |
| プラセボ群(n=58) | 79.1±9.2 | 73.7±11.8 | 72.0±8.2 |
| 本剤群(n=55) | 78.3±10.1 | 62.6±7.8* | 70.3±8.0 |
(3)本剤0.125mg/kgの1分間静脈内投与による冠動脈CT及び心臓カテーテルを用いた冠動脈造影を施行し、両検査による診断結果を比較した。有意狭窄の検出に関する心臓カテーテルを用いた冠動脈造影を基準とした冠動脈CTの診断能(感度、特異度、陽性的中率及び陰性的中率)について、本剤群の診断能はプラセボ群と同程度の数値であったことから、本剤群は冠動脈CTの診断能に影響を与えないことが示された。5)
| プラセボ群 | 本剤群 | |
| 感度 | 100%(17/17) | 100%(30/30) |
| 特異度 | 98.0%(395/403) | 98.6%(479/486) |
| 陽性的中率 | 68.0%(17/25) | 81.1%(30/37) |
| 陰性的中率 | 100%(395/395) | 100%(479/479) |
17.1.2 国内第III相試験
(1)プラセボを対照とした二重盲検比較試験において、症状、理学的所見及び非侵襲的検査により虚血性心疾患が疑われ、冠動脈造影が必要で、冠動脈CT前の心拍数が70回/分以上、90回/分以下の患者を対象に、本剤0.125mg/kgを1分間で静脈内投与した。主要評価項目である冠動脈CTにおける冠動脈描出能(冠動脈狭窄の程度が診断可能な被験者の割合)において、本剤群はプラセボ群に対し有意な改善効果を示した。なお、本試験は64列、若しくは320列CT機器の5機種を使用した。また、安全性評価対象129例中8例(6.2%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、ALT上昇2例(1.6%)、ビリルビン上昇2例(1.6%)であった。6)
| 投与群 | 冠動脈描出能(診断可能な被験者の割合) |
| プラセボ群 | 38.2%(42/110例) |
| 本剤群 | 68.2%*(75/110例) |
17.1.3 国内第III相試験
非盲検一般臨床試験において、症状、理学的所見及び非侵襲的検査により虚血性心疾患が疑われ、冠動脈造影が必要で、冠動脈CT前の心拍数が70回/分以上、90回/分以下の患者を対象に、本剤0.125mg/kgを1分間で静脈内投与した。冠動脈CTにおける冠動脈描出能(冠動脈狭窄の程度が診断可能な被験者の割合)は56.0%(14/25例)であった。なお、本試験は16列CT機器の3機種を使用した成績である。また、安全性評価対象39例中に副作用(臨床検査値異常を含む)は認められなかった。7)
18. 薬効薬理
18.1 作用機序
主に心臓に存在するβ1受容体に作用し、交感神経終末及び副腎髄質より遊離されるノルアドレナリン及びアドレナリンによる心拍数増加作用に拮抗することで徐拍作用を発現し、冠動脈CTにおける冠動脈描出能の改善効果を示す。
18.2 薬理作用
(1)ランジオロール塩酸塩のβ1及びβ2受容体に対するKi値は、それぞれ62.1及び1,890nMである(in vitro)。8)
(2)ランジオロール塩酸塩のβ1(摘出心房筋)遮断作用及びβ2(気管平滑筋)遮断作用のpA2値は、それぞれ6.31及び3.91である(in vitro)。9)
(3)ランジオロール塩酸塩のα1及びα2受容体に対するKi値は、それぞれ81.5及び180.1μMであり、α受容体にはほとんど作用しない(in vitro)。9)
18.2.2 β遮断作用の持続性
イソプロテレノール投与による心拍数増加に対して、ランジオロール塩酸塩の急速静脈内投与は用量に応じた心拍数増加抑制作用を示し、抑制作用の消失半減期は9分から12分である(イヌ)。一方、同モデルにおけるプロプラノロール塩酸塩の急速静脈内投与では、心拍数増加を投与62分後においても有意に抑制していた。10)
18.2.3 その他の作用
19. 有効成分に関する理化学的知見
19.1. ランジオロール塩酸塩
22. 包装
5バイアル[1バイアル×5]
23. 主要文献
- 東 純一ほか, 臨床医薬, 30, 257-269, (2014)
- 恒川 健ほか, 薬物動態, 12, 31-41, (1997) »DOI
- 中出 進ほか, CYP分子種への影響(社内資料)
- 高畑武功ほか, Drugs R D, 6, 385-394, (2005) »PubMed
- 小野薬品工業:後期第II相二重盲検比較試験成績(社内資料;2011年7月1日承認、CTD 2.7.6.3)
- 平野雅春ほか, Clin.Drug Investig., 34, 53-62, (2014) »PubMed
- 平野雅春ほか, Drugs R D, 14, 185-194, (2014) »PubMed
- 榊原陵治ほか, β受容体に対するKi値(社内資料)
- 代谷 務ほか, 基礎と臨床, 31, 2913-2923, (1997)
- 井尾敏朗ほか, β遮断作用の持続性(社内資料)
- 村木克彦ほか, J.Pharmacol.Exp.Ther., 278, 555-563, (1996) »PubMed
- 代谷 務ほか, 基礎と臨床, 31, 2967-2975, (1997)
24. 文献請求先及び問い合わせ先
文献請求先
小野薬品工業株式会社
くすり相談室
〒541-8564
大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
製品情報問い合わせ先
小野薬品工業株式会社
くすり相談室
〒541-8564
大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
26. 製造販売業者等
26.1 製造販売
小野薬品工業株式会社
大阪市中央区久太郎町1丁目8番2号