医薬品情報
| 総称名 | ベタニス |
|---|---|
| 一般名 | ミラベグロン |
| 欧文一般名 | Mirabegron |
| 製剤名 | ミラベグロン錠 |
| 薬効分類名 | 選択的β3アドレナリン受容体作動性過活動膀胱治療剤 |
| 薬効分類番号 | 2590 |
| ATCコード | G04BD12 |
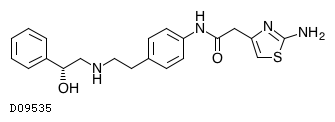
| KEGG DRUG |
D09535
ミラベグロン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年8月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ベタニス錠25mg | Betanis Tablets 25mg | アステラス製薬 | 2590014F1021 | 83.8円/錠 | 劇薬, 処方箋医薬品 |
| ベタニス錠50mg | Betanis Tablets 50mg | アステラス製薬 | 2590014F2028 | 141.7円/錠 | 劇薬, 処方箋医薬品 |
1. 警告
生殖可能な年齢の患者への本剤の投与はできる限り避けること。動物実験(ラット)で、精嚢、前立腺及び子宮の重量低値あるいは萎縮等の生殖器系への影響が認められ、高用量では発情休止期の延長、黄体数の減少に伴う着床数及び生存胎児数の減少が認められている。[9.4参照]
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
過活動膀胱における尿意切迫感、頻尿及び切迫性尿失禁
5. 効能または効果に関連する注意
5.1 本剤を適用する際、十分な問診により臨床症状を確認するとともに、類似の症状を呈する疾患(尿路感染症、尿路結石、膀胱癌や前立腺癌などの下部尿路における新生物等)があることに留意し、尿検査等により除外診断を実施すること。なお、必要に応じて専門的な検査も考慮すること。
5.2 下部尿路閉塞疾患(前立腺肥大症等)を合併している患者では、それに対する治療(α1遮断薬等)を優先させること。
6. 用法及び用量
通常、成人にはミラベグロンとして50mgを1日1回食後に経口投与する。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.1 過活動膀胱の適応を有する抗コリン剤と併用する際は尿閉などの副作用の発現に十分注意すること。[11.1.1参照]
8.2 現時点では、ステロイド合成・代謝系への作用を有する5α還元酵素阻害薬と併用した際の安全性及び臨床効果が確認されていないため併用は避けることが望ましい。
8.3 血圧の上昇があらわれることがあるので、本剤投与開始前及び投与中は定期的に血圧測定を行うこと。[11.1.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心血管系障害を有する患者
本剤の投与を開始する前に心電図検査を実施するなどし、心血管系の状態に注意をはらうこと。QT延長を生じるおそれがある。
9.1.2 QT延長又は不整脈の既往歴を有する患者
定期的に心電図検査を行うこと。QT延長を来すリスクが高いと考えられる。
9.1.3 クラスIA(キニジン、プロカインアミド等)又はクラスIII(アミオダロン、ソタロール等)の抗不整脈薬を投与中の患者を含むQT延長症候群患者
定期的に心電図検査を行うこと。QT延長を来すリスクが高いと考えられる。
9.1.4 重度の徐脈等の不整脈、急性心筋虚血等の不整脈を起こしやすい患者
心室頻拍(Torsades de Pointesを含む)、QT延長を起こすことがある。
9.1.5 低カリウム血症のある患者
心室頻拍(Torsades de Pointesを含む)、QT延長を起こすことがある。
9.1.6 緑内障の患者
定期的な眼科的診察を行うこと。眼圧の上昇を招き、症状を悪化させるおそれがある。
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者(Child-Pughスコア10以上)
9.3.2 中等度の肝機能障害のある患者(Child-Pughスコア7〜9)
9.3.3 軽度の肝機能障害のある患者
血中濃度が上昇するおそれがある。[16.6.2参照]
9.4 生殖能を有する者
生殖可能な年齢の患者への本剤の投与はできる限り避けること。動物実験(ラット)で、精嚢、前立腺及び子宮の重量低値あるいは萎縮等の生殖器系への影響が認められ、高用量では発情休止期の延長、黄体数の減少に伴う着床数及び生存胎児数の減少が認められている。[1.参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(ラット、ウサギ)で、胎児において着床後死亡率の増加、体重低値、肩甲骨等の屈曲及び波状肋骨の増加、骨化遅延(胸骨分節、中手骨、中節骨等の骨化数低値)、大動脈の拡張及び巨心の増加、肺副葉欠損が認められている。[2.3参照]
9.6 授乳婦
投与しないこと。動物実験(ラット)で乳汁移行が認められている。また、授乳期に本薬を母動物に投与した場合、出生児で生存率の低値及び体重増加抑制が認められている。[2.4参照]
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした国内の臨床試験は実施していない。
9.8 高齢者
10. 相互作用
相互作用序文
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2D6
薬物代謝酵素用語
P-糖蛋白
10.1 併用禁忌
| フレカイニド酢酸塩 (タンボコール) プロパフェノン塩酸塩 (プロノン) [2.6参照] | QT延長、心室性不整脈(Torsades de Pointesを含む)等を起こすおそれがある。 | ともに催不整脈作用があり、また本剤のCYP2D6阻害作用により、これらの薬剤の血中濃度が上昇する可能性がある。 |
10.2 併用注意
| カテコールアミン アドレナリン イソプレナリン 等 | 頻脈、心室細動発現の危険性が増大する。 | カテコールアミンの併用によりアドレナリン作動性神経刺激の増大が起こる。 |
| イトラコナゾール リトナビル アタザナビル インジナビル ネルフィナビル サキナビル クラリスロマイシン [16.7.1参照] | 心拍数増加等があらわれるおそれがある。 | これらの薬剤はCYP3A4を強く阻害し、また一部の薬剤はP-糖蛋白の阻害作用も有することから、併用により本剤の血中濃度が上昇する可能性がある。 |
| リファンピシン フェニトイン カルバマゼピン [16.7.2参照] | 本剤の作用が減弱する可能性がある。 | これらの薬剤はCYP3A4及びP-糖蛋白を誘導し、併用により本剤の血中濃度が低下する可能性がある。 |
| CYP2D6の基質 デキストロメトルファン フェノチアジン系抗精神病剤 ペルフェナジン ドネペジル 等 | これらの薬剤の作用を増強するおそれがある。 | 本剤のCYP2D6阻害作用により、これらの薬剤又はその活性代謝物の血中濃度が上昇する可能性がある。 |
| 三環系抗うつ剤 アミトリプチリン塩酸塩 ノルトリプチリン塩酸塩 イミプラミン塩酸塩 等 [16.7.4参照] | これらの薬剤の作用を増強するおそれがある。 | 本剤のCYP2D6阻害作用により、これらの薬剤又はその活性代謝物の血中濃度が上昇する可能性がある。 |
| メトプロロール [16.7.3参照] | メトプロロールの作用を増強するおそれがある。 | 本剤のCYP2D6阻害作用により、これらの薬剤又はその活性代謝物の血中濃度が上昇する可能性がある。 |
| ピモジド | QT延長、心室性不整脈(Torsades de Pointesを含む)等を起こすおそれがある。 | 本剤のCYP2D6阻害作用により、ピモジドの血中濃度が上昇する可能性があり、かつ本剤及びピモジドがともに催不整脈作用を有する。 |
| ジゴキシン [16.7.5参照] | 併用する場合には、ジゴキシンの血中濃度をモニタリングすることが望ましい。 | 本剤のP-糖蛋白阻害作用により、ジゴキシンの血中濃度が上昇する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 尿閉(頻度不明)[8.1参照]
11.1.2 高血圧(頻度不明)
収縮期血圧180mmHg以上又は拡張期血圧110mmHg以上に至った例も報告されている。[8.3参照]
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 血液及びリンパ系障害 | 血小板数増加、白血球数増加、血小板数減少、白血球数減少 | ||
| 心臓障害 | 右脚ブロック、動悸、上室性期外収縮、頻脈、心室性期外収縮、血圧上昇、心拍数増加 | 心房細動 | |
| 耳及び迷路障害 | 回転性めまい | ||
| 眼障害 | 霧視 | ||
| 胃腸障害 | 便秘、口内乾燥 | 腹部不快感、腹部膨満、下痢、十二指腸潰瘍、胃炎、口内炎 | 悪心、嘔吐、腹痛、上腹部痛、下腹部痛 |
| 全身障害及び投与局所様態 | 倦怠感、浮腫、口渇 | 胸部不快感、胸痛 | |
| 肝胆道系障害 | AST上昇、ALT上昇、γ-GTP上昇、Al-P上昇 | ビリルビン上昇 | |
| 感染症 | 尿沈渣異常 | 膀胱炎 | |
| 代謝及び栄養障害 | CK上昇 | CK減少、血中ブドウ糖増加、血中ブドウ糖減少、コレステロール上昇、尿酸上昇 | 食欲減退 |
| 神経系障害 | 浮動性めまい、頭痛 | 振戦、感覚鈍麻、傾眠 | |
| 腎及び尿路障害 | 尿中蛋白陽性 | 尿中ブドウ糖陽性、クレアチニン上昇、BUN上昇、BUN減少、残尿 | |
| 皮膚及び皮下組織障害 | 発疹、蕁麻疹 | そう痒症 | |
| 血管障害 | 高血圧 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は徐放性製剤であるため、割ったり、砕いたり、すりつぶしたりしないで、そのままかまずに服用するよう指導すること。割ったり、砕いたり、すりつぶしたりして服用すると、本剤の徐放性が失われ、薬物動態が変わるおそれがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性に本剤を空腹時注)単回経口投与したときのCmax及びAUCinfは、用量比を超えて上昇した。Tmax及びt1/2は各用量間でほぼ一定であった1)。
| 投与量(mg) | Cmax(ng/mL) | Tmax(h) | AUCinf※(ng・h/mL) | t1/2※(h) | CL/F※(L/h) |
| 50 | 31.01±18.06 | 3.5±1.4 | 292.24±76.93 | 36.4±11.8 | 183.49±58.11 |
| 100注) | 130.67±43.79 | 3.3±0.8 | 882.40±234.53 | 30.8±3.4 | 119.34±28.11 |
| 200注) | 164.51±82.99 | 2.8±1.3 | 1382.68±441.45 | 26.4±3.6 | 157.61±50.64 |
| 300注) | 548.52±92.50 | 3.7±1.0 | 3285.08±333.94 | 25.1±4.3 | 92.24±10.89 |
| 400注) | 720.14±264.40 | 4.0±1.3 | 4142.50±735.89 | 23.9±4.9 | 99.79±22.03 |
16.1.2 反復投与
健康成人男性に本剤100mg注)及び200mg注)を1日1回食後7日間反復投与したときの血漿中濃度は、投与開始後第4日目以降トラフ値はほぼ一定となり、7日以内に定常状態に達した。また、AUC24hは反復投与により、1.75〜2.12倍上昇することが示唆された1)。
| 投与量(mg) | 評価日(日) | Cmax(ng/mL) | Tmax(h) | AUC24h(ng・h/mL) | t1/2(h) | CL/F(L/h) |
| 100注) | 1 | 91.23±42.00 | 4.8±0.5 | 377.16±90.67 | 28.8±6.8 | 167.16±31.36 |
| 10 | 136.14±52.52 | 5.0±0.0 | 792.75±156.88 | 30.0±4.4 | 131.76±33.39 | |
| 200注) | 1 | 313.08±77.57 | 5.0±0.0 | 1102.22±284.28 | 27.4±7.7 | 127.95±27.23 |
| 10 | 290.94±90.64 | 5.0±0.5 | 1909.36±366.20 | 28.0±1.8 | 108.03±19.75 |
16.2 吸収
16.3 分布
ミラベグロン15mg注)を静脈内注)単回投与したときの分布容積は1643Lであった2)(外国人データ)。血漿蛋白結合率は76.3〜76.9%であり、主結合蛋白はアルブミンであった(in vitro試験)。
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 肝機能障害患者
16.6.3 性差
非高齢及び高齢外国健康成人男女に本剤25mg注)、50mg及び100mg注)を反復投与したときのCmax及びAUCtauは、男女間で差が認められ、男性被験者に比べ女性被験者で1.44倍及び1.38倍の高い値を示した7)(外国人データ)。
16.6.4 高齢者
16.7 薬物相互作用
16.7.1 ケトコナゾール
16.7.2 リファンピシン
16.7.3 メトプロロール
16.7.4 デシプラミン
16.7.5 ジゴキシン
16.7.6 トルテロジン
本剤50mgとトルテロジン4mgと併用したとき、トルテロジン及びその活性代謝物5-HMTのAUC24hはそれぞれ1.86倍及び1.25倍に、Cmaxはそれぞれ2.06倍及び1.36倍に上昇した15)。
注)本剤の承認された用法及び用量は、通常50mgを1日1回食後経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 二重盲検比較試験(国内第II相試験)
過活動膀胱患者を対象に本剤25mg注)、50mg、100mg注)又はプラセボを、1日1回食後に12週間経口投与したときの主要評価項目である24時間あたりの平均排尿回数の変化量及び副次的評価項目である24時間あたりの平均尿意切迫感回数の変化量、24時間あたりの平均尿失禁回数の変化量、24時間あたりの平均切迫性尿失禁回数の変化量の成績を次に示した。二重盲検比較試験の結果、主要評価項目である24時間あたりの平均排尿回数の変化量は本剤のいずれの投与量でもプラセボに比べ有意な改善が認められた16)。
| 投与群 | 症例数 | 投与前 | 変化量 | プラセボとの比較※ |
| プラセボ | 211 | 11.17±2.526 | −1.18±2.155 | − |
| ミラベグロン25mg注) | 209 | 11.47±2.835 | −1.94±2.158 | P<0.001 |
| ミラベグロン50mg | 208 | 11.77±2.606 | −2.12±2.383 | P<0.001 |
| ミラベグロン100mg注) | 207 | 11.20±2.761 | −1.97±1.970 | P<0.001 |
| 投与群 | 症例数 | 投与前 | 変化量 | プラセボとの比較※ |
| プラセボ | 211 | 4.57±3.160 | −1.83±2.965 | − |
| ミラベグロン25mg注) | 208 | 4.68±3.209 | −2.15±2.731 | −※※ |
| ミラベグロン50mg | 208 | 4.84±3.255 | −2.24±3.120 | P=0.084 |
| ミラベグロン100mg注) | 207 | 4.53±3.093 | −2.48±2.605 | P=0.011 |
| 投与群 | 症例数 | 投与前 | 変化量 | プラセボとの比較※ |
| プラセボ | 140 | 1.68±1.471 | −0.64±1.360 | − |
| ミラベグロン25mg注) | 134 | 2.20±2.499 | −1.29±1.938 | P<0.001 |
| ミラベグロン50mg | 144 | 2.00±2.228 | −1.20±1.455 | P<0.001 |
| ミラベグロン100mg注) | 150 | 1.86±1.666 | −1.28±1.355 | P<0.001 |
| 投与群 | 症例数 | 投与前 | 変化量 | プラセボとの比較※ |
| プラセボ | 132 | 1.55±1.376 | −0.68±1.358 | − |
| ミラベグロン25mg注) | 128 | 1.97±2.378 | −1.14±1.809 | P=0.006 |
| ミラベグロン50mg | 137 | 1.82±2.098 | −1.09±1.345 | P=0.008 |
| ミラベグロン100mg注) | 142 | 1.77±1.640 | −1.24±1.278 | P<0.001 |
副作用発現率(臨床検査値異常を含む)は、プラセボ群、本剤25mg注)群、50mg群、100mg注)群でそれぞれ212例中40例(18.9%)、210例中49例(23.3%)、208例中51例(24.5%)、208例中54例(26.0%)であった。本剤50mg群において発現率が2%以上であった副作用は、便秘5例(2.4%)、血中CK増加7例(2.4%)、γ-GTP増加11例(5.3%)、血中Al-P増加6例(2.9%)であった17)。
17.1.2 二重盲検比較試験(国内第III相試験)
過活動膀胱患者を対象に本剤50mg又はプラセボを、1日1回食後に12週間経口投与したときの主要評価項目である24時間あたりの平均排尿回数の変化量及び副次的評価項目である24時間あたりの平均尿意切迫感回数の変化量、24時間あたりの平均尿失禁回数の変化量、24時間あたりの平均切迫性尿失禁回数の変化量の成績を次に示した。二重盲検比較試験の結果、いずれの評価項目でもプラセボに比べ有意な改善が認められた18)。
| 投与群 | 症例数 | 投与前 | 変化量 | プラセボとの比較※ |
| プラセボ | 368 | 11.29±2.748 | −0.86±2.354 | − |
| ミラベグロン50mg | 369 | 11.15±2.650 | −1.67±2.212 | P<0.001 |
| 投与群 | 症例数 | 投与前 | 変化量 | プラセボとの比較※ |
| プラセボ | 368 | 4.42±2.989 | −1.37±3.191 | − |
| ミラベグロン50mg | 369 | 4.27±2.848 | −1.85±2.555 | P=0.025 |
| 投与群 | 症例数 | 投与前 | 変化量 | プラセボとの比較※ |
| プラセボ | 264 | 1.91±1.760 | −0.66±1.861 | − |
| ミラベグロン50mg | 266 | 1.99±2.054 | −1.12±1.475 | P=0.003 |
| 投与群 | 症例数 | 投与前 | 変化量 | プラセボとの比較※ |
| プラセボ | 258 | 1.67±1.366 | −0.60±1.745 | − |
| ミラベグロン50mg | 254 | 1.78±1.752 | −1.01±1.338 | P=0.008 |
副作用発現率(臨床検査値異常を含む)は、本剤50mg群で379例中93例(24.5%)、プラセボ群で379例中91例(24.0%)であった。また、本剤50mg群において発現率が2%以上であった副作用は、379例中、便秘13例(3.4%)、口内乾燥10例(2.6%)、ALT増加9例(2.4%)、血中CK増加10例(2.6%)、γ-GTP増加15例(4.0%)、血中Al-P増加10例(2.6%)であった18)。
17.1.3 国内長期投与試験
過活動膀胱患者を対象に本剤50mgを1日1回食後に52週間経口投与した。また、本剤50mgを8週間投与した後、治験担当医師が効果不十分で安全性に問題なしと判断し、被験者も増量を希望した場合、100mg注)へ増量することを可能とした。最終評価時の24時間あたりの平均排尿回数の変化量、24時間あたりの平均尿意切迫感回数の変化量、24時間あたりの平均尿失禁回数の変化量、24時間あたりの平均切迫性尿失禁回数の変化量の成績を次に示した。いずれの評価項目でも本剤50mg維持例及び100mg注)増量例ともに改善が認められ、最終評価時まで減弱することなく維持された19)。
| 投与群 | 症例数 | 投与前 | 変化量 |
| ミラベグロン50mg維持例 | 146 | 11.11±2.600 | −2.16±2.673 |
| ミラベグロン100mg注)増量例 | 50 | 11.27±2.702 | −1.57±2.341 |
| 投与群 | 症例数 | 投与前 | 変化量 |
| ミラベグロン50mg維持例 | 146 | 4.79±2.993 | −3.31±2.948 |
| ミラベグロン100mg注)増量例 | 50 | 5.43±3.512 | −2.72±2.884 |
| 投与群 | 症例数 | 投与前 | 変化量 |
| ミラベグロン50mg維持例 | 104 | 1.95±1.632 | −1.30±1.400 |
| ミラベグロン100mg注)増量例 | 45 | 2.40±2.259 | −1.56±2.143 |
| 投与群 | 症例数 | 投与前 | 変化量 |
| ミラベグロン50mg維持例 | 103 | 1.79±1.581 | −1.32±1.401 |
| ミラベグロン100mg注)増量例 | 44 | 2.11±2.076 | −1.33±1.909 |
副作用発現率(臨床検査値異常を含む)は、本剤50mg維持例で152例中51例(33.6%)、100mg注)増量例で50例中15例(30.0%)であった。また、本剤50mg維持例において発現率が2%以上の副作用は、152例中、便秘9例(5.9%)、血圧上昇5例(3.3%)、白血球数減少4例(2.6%)であった20)。
17.3 その他
17.3.1 QT/QTc評価試験
外国健康成人男女(48例)を対象に、QT/QTc評価試験を実施した結果、女性被験者のQTcは本剤100mg注)及び200mg注)投与時に延長する傾向が認められた。外国健康成人男女(352例)を対象に、QT/QTc評価試験(追加試験)を実施した結果、200mg注)投与において女性被験者で延長する傾向が認められた21)22)(外国人データ)。
| 薬剤 | 性別 | 投与後経過時間※(h) | QTc※※(ms) | 90%信頼区間 | |
| 下限 | 上限 | ||||
| ミラベグロン100mg注) | 男性 | 2 | 4.21 | 1.57 | 6.86 |
| 女性 | 3 | 7.48 | 4.50 | 10.46 | |
| ミラベグロン200mg注) | 男性 | 2 | 6.62 | 3.97 | 9.27 |
| 女性 | 3 | 15.05 | 12.08 | 18.01 | |
| モキシフロキサシン400mg | 男性 | 2 | 10.36 | 7.71 | 13.01 |
| 女性 | 3 | 13.10 | 10.16 | 16.04 | |
| 薬剤 | 性別 | 投与後経過時間※(h) | QTc※※(ms) | 90%信頼区間 | |
| 下限 | 上限 | ||||
| ミラベグロン50mg | 男性 | 4 | 2.96 | 0.92 | 5.00 |
| 女性 | 3.5 | 4.49 | 2.17 | 6.81 | |
| ミラベグロン100mg注) | 男性 | 4 | 4.63 | 2.81 | 6.45 |
| 女性 | 4 | 7.70 | 5.68 | 9.72 | |
| ミラベグロン200mg注) | 男性 | 4 | 7.33 | 5.23 | 9.42 |
| 女性 | 5 | 10.42 | 7.40 | 13.44 | |
| モキシフロキサシン400mg | 男性 | 4.5 | 9.60 | 7.84 | 11.35 |
| 女性 | 3 | 9.54 | 7.22 | 11.85 | |
注)本剤の承認された用法及び用量は、通常50mgを1日1回食後経口投与である。
18. 薬効薬理
18.1 作用機序
膀胱平滑筋のβ3アドレナリン受容体を刺激し、膀胱を弛緩させることで蓄尿機能を亢進し、過活動膀胱における尿意切迫感、頻尿及び切迫性尿失禁を改善する。
18.2 β3アドレナリン受容体に対する刺激作用
ヒトβ3アドレナリン受容体を発現させた細胞において、濃度依存的な細胞内cAMP濃度上昇作用を示した。ヒトβ1及びβ2アドレナリン受容体を発現させた細胞においては、細胞内cAMP濃度上昇作用をほとんど示さなかった23)(in vitro試験)。
18.3 膀胱弛緩作用
18.4 膀胱内圧に対する作用
麻酔ラットにおいて、静止時膀胱内圧低下作用を示した26)。
18.5 膀胱機能に対する作用
19. 有効成分に関する理化学的知見
19.1. ミラベグロン
20. 取扱い上の注意
PTP品はアルミ袋により品質保持をはかっているので、アルミ袋開封後は湿気を避けて保存すること。ボトル品は乾燥剤で品質保持をはかっているので、蓋を開けたままにしないこと。
22. 包装
<ベタニス錠25mg>
100錠(10錠×10、乾燥剤入り)
<ベタニス錠50mg>
100錠(10錠×10、乾燥剤入り)、500錠(10錠×50、乾燥剤入り)、500錠(バラ、乾燥剤入り)
23. 主要文献
- Iitsuka,H.et al., Clin.Drug Investig., 34 (1), 27-35, (2014) »PubMed »DOI
- 社内報告書:健康成人・IVIVC試験(2011年7月1日承認CTD2.7.6.6)
- Iitsuka,H.et al., Clin.Ther., 37 (5), 1031-1044, (2015) »PubMed »DOI
- Takusagawa,S.et al., Mol.Pharma., 10 (5), 1783-1794, (2013)
- Takusagawa,S.et al., Xenobiotica, 42 (10), 957-967, (2012) »PubMed »DOI
- Konishi,K.et al., Eur.J.Drug Metab.Pharmacokinet., 43 (3), 301-309, (2018) »PubMed »DOI
- Krauwinkel,W.et al., Clin.Ther., 34 (10), 2144-2160, (2012) »PubMed »DOI
- Takusagawa,S.et al., Xenobiotica, 42 (12), 1187-1196, (2012) »PubMed »DOI
- Takusagawa,S., Drug Metab.Dispos., 40 (4), 815-824, (2012) »PubMed »DOI
- Dickinson,J.et al., Clin.Drug Investig., 33 (1), 11-23, (2013) »PubMed »DOI
- 社内報告書:過活動膀胱患者・第III相二重盲検比較試験(2011年7月1日承認CTD2.7.6.27、CTD2.7.2.3.2.2)
- Lee,J.et al., Clin.Drug Investig., 33 (6), 429-440, (2013) »PubMed »DOI
- Krauwinkel,W.et al., Eur.J.Drug Metab.Pharmacokinet., 39 (1), 43-52, (2014) »PubMed »DOI
- Groen-Wijnberg,M.et al., Eur.J.Drug Metab.Pharmacokinet., 42 (3), 417-429, (2017) »PubMed »DOI
- Nomura,Y.et al., Drug Metab.Pharmacokinet., 31 (6), 411-416, (2016) »PubMed »DOI
- 社内報告書:過活動膀胱患者・第II相二重盲検比較試験(2011年7月1日承認CTD2.7.6.26)
- 社内報告書:過活動膀胱患者・第II相二重盲検比較試験
- Yamaguchi,O.et al., BJU Int., 113 (6), 951-960, (2014) »PubMed »DOI
- 社内報告書:過活動膀胱患者・長期投与試験(2011年7月1日承認CTD2.7.6.28)
- 社内報告書:過活動膀胱患者・長期投与試験
- 社内報告書:海外健康成人・QT/QTc試験(2011年7月1日承認CTD2.7.6.24)
- Malik,M.et al., Clin.Pharmacol.Ther., 92 (6), 696-706, (2012) »PubMed »DOI
- Hatanaka,T.et al., Naunyn-Schmiedeberg's Arch.Pharmacol., 386 (3), 247-253, (2013) »PubMed
- 社内報告書:ラット摘出膀胱組織内cAMP濃度・薬理試験(2011年7月1日承認CTD2.6.2.2.2.1)
- Takasu,T.et al., J.Pharmacol.Exp.Ther., 321 (2), 642-647, (2007) »PubMed »DOI
- Hatanaka,T.et al., Naunyn-Schmiedeberg's Arch.Pharmacol., 386 (1), 71-78, (2013) »PubMed »DOI
- Hatanaka,T.et al., Naunyn-Schmiedeberg's Arch.Pharmacol., 386 (11), 1001-1008, (2013) »PubMed »DOI
24. 文献請求先及び問い合わせ先
文献請求先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
製品情報問い合わせ先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
26. 製造販売業者等
26.1 製造販売
アステラス製薬株式会社
東京都中央区日本橋本町2丁目5番1号