医薬品情報
| 総称名 | プロイメンド |
|---|---|
| 一般名 | ホスアプレピタントメグルミン |
| 欧文一般名 | Fosaprepitant Meglumine |
| 製剤名 | 注射用ホスアプレピタントメグルミン |
| 薬効分類名 | 選択的NK1受容体拮抗型制吐剤 |
| 薬効分類番号 | 2391 |
| ATCコード | A04AD12 |
| KEGG DRUG |
D06597
ホスアプレピタントメグルミン
|
| KEGG DGROUP |
DG00066
アプレピタント
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(再審査結果)(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| プロイメンド点滴静注用150mg | PROEMEND for I.V.Infusion | 小野薬品工業 | 2391405D1020 | 9630円/瓶 | 処方箋医薬品注) |
2. 禁忌
4. 効能または効果
抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)(遅発期を含む)
5. 効能または効果に関連する注意
6. 用法及び用量
<成人及び12歳以上の小児>
他の制吐剤との併用において、通常、成人及び12歳以上の小児にはホスアプレピタントとして150mgを抗悪性腫瘍剤投与1日目に1回、点滴静注する。
<生後6ヵ月以上の乳幼児及び12歳未満の小児>
他の制吐剤との併用において、通常、生後6ヵ月以上の乳幼児及び12歳未満の小児にはホスアプレピタントとして3.0mg/kgを抗悪性腫瘍剤投与1日目に1回、点滴静注する。ただし、ホスアプレピタントとして150mgを超えないこと。
7. 用法及び用量に関連する注意
7.1 本剤は、原則としてコルチコステロイド及び5-HT3受容体拮抗型制吐剤と併用して使用すること。ただし、コルチコステロイドの用量については、本剤又は活性本体アプレピタントとコルチコステロイドの薬物相互作用を考慮して適宜減量すること。[10.2、16.7.5、17.1.1-17.1.3参照]
7.2 本剤は、投与速度の増加及び投与濃度の上昇により、注射部位障害が発現しやすくなるため、本剤1バイアル(ホスアプレピタントとして150mg)を5mLの生理食塩液で溶解し、下記のとおり点滴静注すること。[14.1.1参照]
<成人及び12歳以上の小児>
最終容量が100〜250mL(最終濃度として0.6〜1.5mg/mL)となるように生理食塩液で希釈し、抗悪性腫瘍剤の投与1時間前に30分間かけて点滴静注する。
<生後6ヵ月以上の乳幼児及び12歳未満の小児>
3.0mg/kgに相当する量を最終濃度が0.6〜1.5mg/mLとなるように生理食塩液で希釈し、抗悪性腫瘍剤の投与1時間30分前に60分間かけて点滴静注する。
8. 重要な基本的注意
8.1 本剤の活性本体アプレピタントはCYP3A4に対する用量依存的阻害作用を有し、抗悪性腫瘍剤を含めて併用薬剤と相互作用を起こすことがあるため、十分注意して投与すること。[10.2参照]
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 重度の肝障害患者
本剤の活性本体アプレピタントは主として肝で代謝されるため、血中濃度が過度に上昇するおそれがある。また、重度肝機能不全(Child-Pughスコア>9)患者での使用経験はない。[16.6.3参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。本剤の活性本体アプレピタントはラット、ウサギにおいて胎盤を通過することが報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラットにおいて本剤の活性本体アプレピタントは乳汁中に移行することが報告されている。
9.7 小児等
低出生体重児、新生児又は生後6ヵ月未満の乳児を対象とした臨床試験は実施していない。[17.1.3参照]
9.8 高齢者
一般に高齢者では生理機能が低下している。なお、健康な高齢者は本剤の活性本体アプレピタントの血漿中濃度(AUC、Cmax)が非高齢者に比べて若干高くなるとの報告がある。[16.6.1参照]
10. 相互作用
相互作用序文
本剤の活性本体アプレピタントはCYP3A4の基質であり、軽度から中程度のCYP3A4阻害(用量依存的)及び誘導作用を有し、CYP2C9の誘導作用も有する。[16.4参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2C9
10.1 併用禁忌
| ピモジド オーラップ錠1mg、3mg、細粒1% [2.2参照] | 左記薬剤の血中濃度上昇により、QT延長、心室性不整脈等の重篤な副作用を起こすおそれがある。 | 本剤の活性本体アプレピタントの用量依存的なCYP3A4阻害作用によって、左記薬剤の血中濃度上昇を来すことがあり、重篤又は生命を脅かす事象の原因となるおそれがある。 |
10.2 併用注意
| CYP3A4を阻害する薬剤 イトラコナゾール、エリスロマイシン、クラリスロマイシン、リトナビル等 [16.7.1参照] | 本剤と強力なCYP3A4阻害剤(例:ケトコナゾール)との併用は慎重に行うこと。 | 本剤の活性本体アプレピタントはCYP3A4の基質であるため、CYP3A4活性を阻害する薬剤と併用することによってアプレピタントの血中濃度が上昇する場合がある。 |
| ジルチアゼム [16.7.4参照] | 本剤とジルチアゼムとの併用投与によって、両薬剤への曝露が増大する可能性がある。 | 本剤の活性本体アプレピタント及びジルチアゼムの代謝が競合的に阻害される。 |
| CYP3A4を誘導する薬剤 リファンピシン、カルバマゼピン、フェニトイン等 [16.7.2参照] | 本剤の作用が減弱するおそれがある。 | 本剤の活性本体アプレピタントはCYP3A4の基質であるため、これらの薬剤によりアプレピタントの代謝が促進される場合がある。 |
| CYP3A4で代謝される薬剤 デキサメタゾン、メチルプレドニゾロン、ミダゾラム等 [7.1、8.1、16.7.3、16.7.5、16.7.6参照] | これらの薬剤の効果が増強されるおそれがある。なお、デキサメタゾンを併用する場合は、デキサメタゾンの用量を減量するなど用量に注意すること。 | 本剤の活性本体アプレピタントの用量依存的なCYP3A4阻害作用によって、これらの薬剤の代謝が阻害される場合がある。 |
| CYP2C9で代謝される薬剤 ワルファリン、トルブタミド、フェニトイン等 [8.2、16.7.7、16.7.8参照] | これらの薬剤の効果が減弱されるおそれがある。 | 本剤の活性本体アプレピタントのCYP2C9誘導作用により、これらの薬剤の代謝が促進される場合がある。 |
| ホルモン避妊法 エチニルエストラジオール等 [16.7.9参照] | これらの薬剤の効果が減弱されるおそれがあるので、本剤の投与期間中及び最終投与から1ヵ月間は、代りの避妊法又は補助的避妊法を用いる必要がある。 | 機序は解明されていないが、本剤の活性本体アプレピタントとの併用によりこれらの薬剤の代謝が亢進することが報告されている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
発熱、紅斑、そう痒感、眼充血、口内炎等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.2 穿孔性十二指腸潰瘍(頻度不明)
11.1.3 ショック、アナフィラキシー(いずれも頻度不明)
全身発疹、潮紅、血管浮腫、紅斑、呼吸困難、意識消失、血圧低下等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。[2.1参照]
11.2 その他の副作用
| 5〜10%未満 | 5%未満 | 頻度不明 | |
| 皮膚 | 発疹 | そう痒、紅斑、皮膚病変、光線過敏症、ざ瘡、多汗症、脂性肌、蕁麻疹 | |
| 精神神経系 | 頭痛 | めまい、眠気、不眠症、不安、多幸症、異常な夢、認知障害、失見当識 | |
| 循環器 | 潮紅 | 徐脈、動悸、頻脈、不整脈、ほてり、血圧上昇 | |
| 消化器 | 便秘 | 下痢、腹痛、腹部不快感、口内炎 | 悪心、嘔吐、鼓腸、消化不良、おくび、胃炎、腸炎、胃食道逆流性疾患、口内乾燥、食欲不振、腹部膨満 |
| 呼吸器 | しゃっくり | 咳嗽 | 咽頭炎、後鼻漏、くしゃみ、咽喉刺激感 |
| 肝臓 | ALTの上昇 | AST、アルカリホスファターゼ、γ-GTP、ビリルビンの上昇 | |
| 腎臓 | 蛋白尿、尿糖 | BUN上昇、クレアチニン上昇、頻尿、多尿、排尿困難、血尿 | |
| 血液 | リンパ球数減少 | 貧血、好中球数減少、白血球数減少、血小板数減少、単球数減少 | |
| 筋骨格系 | 筋痙攣、筋痛、四肢痛 | ||
| 注射部 | 疼痛、そう痒感、紅斑、硬結、腫脹 | 血栓性静脈炎 | |
| その他 | 倦怠感、浮腫、味覚異常、低ナトリウム血症 | 胸部不快感、疲労、無力症、嗜眠、発熱、耳鳴、疼痛、粘膜の炎症、体重増加、体重減少、多飲症、高血糖、口渇、脱水、アルブミン減少、低カリウム血症、低クロール血症、結膜炎、ブドウ球菌感染症、カンジダ症 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤1バイアル(ホスアプレピタントとして150mg)を5mLの生理食塩液で溶解すること。溶解時は、泡立つため2〜3回静かに転倒混和すること。[7.2参照]
14.1.2 本剤は非臨床試験(in vitro)において1.5mg/mLを超える濃度で溶血が報告されているので、最終濃度として0.6〜1.5mg/mLとなるよう生理食塩液で調製すること。調製した輸液は2〜3回静かに転倒混和すること。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 本剤の活性本体アプレピタントを用いたラットの2年間投与がん原性試験において、雌雄ラットの125mg/kg1日2回投与群以上で甲状腺濾胞細胞腺腫の発生率の増加、雄ラットの125mg/kg1日2回投与群以上で甲状腺濾胞細胞腺癌の発生率の増加、雄ラットの125mg/kg1日2回投与群及び雌ラットの5mg/kg1日2回投与群以上で肝細胞腺腫の発生率の増加、雌ラットの125mg/kg1日2回投与群以上で肝細胞癌の発生率の増加が認められたとの報告がある。
また、マウスの2年間投与がん原性試験において、雌マウスの500mg/kg/日群以上で肝細胞腺腫の発生率の増加、雄マウスの1,000mg/kg/日群以上及び雌マウスの500mg/kg/日群以上で肝細胞癌の発生率の増加が認められたとの報告がある。
また、マウスの2年間投与がん原性試験において、雌マウスの500mg/kg/日群以上で肝細胞腺腫の発生率の増加、雄マウスの1,000mg/kg/日群以上及び雌マウスの500mg/kg/日群以上で肝細胞癌の発生率の増加が認められたとの報告がある。
15.2.2 新生児の雌雄イヌに4週間反復静脈内投与したところ、4mg/kg投与群以上で子宮重量の高値を伴う子宮角から体部にかけての内膜及び筋層の肥厚、子宮頸部筋層の肥厚、膣粘膜固有層及び粘膜下層の浮腫、体重増加抑制、6mg/kg投与群で精巣重量の低値を伴うライディヒ細胞の小型化、体重増加抑制が認められたが、組織構造の破壊を伴うものではなかったとの報告がある。
また、本剤の活性本体アプレピタントを新生児の雌雄ラットに7週間反復経口投与したところ、10mg/kg1日2回投与群以上で包皮分離の遅延及び膣開口の早期化が認められたが、これら動物の生殖行動、受胎能力、妊娠機能、生殖器の病理学的検査において変化はなく、生殖能への影響はなかったとの報告がある。
また、本剤の活性本体アプレピタントを新生児の雌雄ラットに7週間反復経口投与したところ、10mg/kg1日2回投与群以上で包皮分離の遅延及び膣開口の早期化が認められたが、これら動物の生殖行動、受胎能力、妊娠機能、生殖器の病理学的検査において変化はなく、生殖能への影響はなかったとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
<健康成人>
健康成人男女15例に本剤150mgを30分間かけて静脈内投与した時、ホスアプレピタントは活性本体であるアプレピタントに速やかに代謝され、アプレピタントのCmax、AUC0-∞及び消失半減期(T1/2)はそれぞれ5,440ng/mL、59,600ng・hr/mL及び14時間であった。1)
| ホスアプレピタント | アプレピタント | |||
| AUC0-∞(ng・hr/mL) | T1/2(hr) | Cmax(ng/mL) | AUC0-∞(ng・hr/mL) | T1/2(hr) |
| 3260±520 | 0.036±0.006 | 5440±2200 | 59600±22900 | 14±6 |
<小児>
12歳以上18歳以下の小児悪性腫瘍患者11例に本剤150mgを30分間かけて静脈内投与した時、アプレピタントのCmax、AUC0-∞及び消失半減期(T1/2)はそれぞれ4,070ng/mL、61,100ng・hr/mL及び10.1時間であった。生後6ヵ月以上12歳未満の小児悪性腫瘍患者15例に本剤3.0mg/kgを60分間かけて静脈内投与した時、アプレピタントのCmax、AUC0-∞及び消失半減期(T1/2)はそれぞれ3,020ng/mL、35,200ng・hr/mL及び5.69時間であった。2)
| Cmax(ng/mL) | AUC0-∞(ng・hr/mL) | T1/2(hr) | |
| 12歳以上18歳以下 | 4070±1580 | 61100±29200 | 10.1±4.17 |
| 生後6ヵ月以上12歳未満 | 3020±1110 | 35200±14700 | 5.69±1.40 |
16.3 分布
16.3.1 蛋白結合率
ホスアプレピタントの血漿蛋白結合率は、99.6〜99.8%であった(in vitro、平衡透析法)。また、アプレピタントの血漿蛋白結合率は、99.6〜99.7%であった(in vitro、限外ろ過法)。
16.3.2 P-糖蛋白質
アプレピタントはP-糖蛋白質の基質である。また、アプレピタントは10μmol/Lの濃度において、P-糖蛋白質の基質であるビンブラスチンの輸送を36%阻害した(in vitro)。
16.4 代謝
ホスアプレピタントは、体内で速やかに活性本体であるアプレピタントに代謝される。
健康成人男性に[14C]ホスアプレピタント100mgを15分間かけて静脈内投与した時、投与72時間までの血漿中放射能の約19%がアプレピタントであり、ヒト血漿中には12種類の代謝物が同定されている。なお、アプレピタントはモルホリン環及びその側鎖の酸化によって大部分が代謝される(外国人データ)。
ヒト肝ミクロソームを用いた試験では、アプレピタントは主としてCYP3A4によって代謝され、一部はCYP1A2及びCYP2C19によっても代謝されるが、CYP2D6、CYP2C9、又はCYP2E1の代謝を受けない(in vitro)。3)
また、アプレピタントはCYP3A4の阻害・誘導作用及びCYP2C9の誘導作用を有する。[10.参照]
健康成人男性に[14C]ホスアプレピタント100mgを15分間かけて静脈内投与した時、投与72時間までの血漿中放射能の約19%がアプレピタントであり、ヒト血漿中には12種類の代謝物が同定されている。なお、アプレピタントはモルホリン環及びその側鎖の酸化によって大部分が代謝される(外国人データ)。
ヒト肝ミクロソームを用いた試験では、アプレピタントは主としてCYP3A4によって代謝され、一部はCYP1A2及びCYP2C19によっても代謝されるが、CYP2D6、CYP2C9、又はCYP2E1の代謝を受けない(in vitro)。3)
また、アプレピタントはCYP3A4の阻害・誘導作用及びCYP2C9の誘導作用を有する。[10.参照]
16.5 排泄
健康成人男性に[14C]ホスアプレピタント100mgを15分間かけて静脈内投与した時、投与後28日間で投与量の57.0%及び45.0%がそれぞれ尿及び糞中に排泄された(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 高齢者
健康な高齢者(65歳以上)16例にアプレピタントを1日目に125mg、2〜5日目に80mg経口投与した時、AUCは非高齢者に比べて1日目に1.21倍、5日目に1.36倍に上昇した(外国人データ)。[9.8参照]
16.6.2 腎障害患者
健康成人16例及び腎障害患者16例(重度腎障害者8例、血液透析を必要とする末期腎疾患患者8例)にアプレピタント240mgを経口投与した時、健康成人に比べて重度腎障害者及び末期腎疾患患者のAUCは、それぞれ0.79倍及び0.58倍に低下したが、血漿蛋白非結合型未変化体のAUCは腎障害患者と健康成人で同程度であった。また、血液透析はアプレピタントのAUCに影響を及ぼさなかった(外国人データ)。4)
16.6.3 肝障害患者
健康成人20例及び肝障害患者20例(軽度肝障害者10例、中等度肝障害者10例)にアプレピタントを1日目に125mg、2〜3日目に80mg経口投与した時、健康成人に比べて軽度肝障害者及び中等度肝障害者のAUCは、1日目に0.89倍及び1.10倍、3日目に0.64倍及び1.18倍であった(外国人データ)。[9.3.1参照]
16.7 薬物相互作用
16.7.1 ケトコナゾール
健康成人11例に対して、ケトコナゾール400mgを1日1回10日間反復投与し、投与5日目にアプレピタント125mgを経口投与した時、アプレピタントのAUC及びCmaxは単独投与時に比べて、それぞれ4.78倍及び1.52倍に上昇した(外国人データ)。[10.2参照]
16.7.2 リファンピシン
健康成人11例に対して、リファンピシン600mgを1日1回14日間反復投与し、投与9日目にアプレピタント375mgを経口投与した時、アプレピタントのAUC及びCmaxは単独投与時に比べて、それぞれ0.09倍及び0.38倍に低下した(外国人データ)。[10.2参照]
16.7.3 ミダゾラム
16.7.4 ジルチアゼム
軽度から中等度の高血圧症患者9例に対して、ジルチアゼム120mgを反復投与時に、ホスアプレピタント100mgを静脈内投与した時、アプレピタントのAUCは単独投与時に比べて1.45倍に、ジルチアゼムのAUCはジルチアゼム単独投与時に比べて1.40倍に上昇した。同様に、アプレピタントの錠剤300mg(アプレピタントカプセル230mgと同程度のAUCが得られる)を経口投与した時、アプレピタントのAUCは単独投与時に比べて2.00倍に、ジルチアゼムのAUCはジルチアゼム単独投与時に比べて1.66倍に上昇した(外国人データ)。[10.2参照]
16.7.5 デキサメタゾン
・健康成人11例に対して、本剤150mgを1日目に静脈内投与し、デキサメタゾン8mgを1〜3日目に経口投与した時、デキサメタゾンのAUCは本剤非併用時に比べて1日目に2.01倍、2日目に1.86倍に上昇し、3日目に1.18倍であった(外国人データ)。5)[7.1、10.2参照]
・日本人の悪性腫瘍患者440例から得られた一人あたり約2点の血漿中濃度データ(計847点)を対象とした母集団薬物動態解析の結果、抗悪性腫瘍剤及びグラニセトロンの投与に加え、アプレピタント125mgを経口投与し、デキサメタゾンリン酸エステル6mgを静脈内投与した時のデキサメタゾンのクリアランスは、アプレピタント非併用時に比べて0.53倍に低下した。6)
16.7.6 メチルプレドニゾロン
16.7.7 ワルファリン
16.7.8 トルブタミド
16.7.9 エチニルエストラジオール・ノルエチステロン
健康成人女性19例に対して、経口避妊剤(エチニルエストラジオール・ノルエチステロン)を21日間反復投与時に、8日目からのデキサメタゾン及びオンダンセトロンの投与に加え、アプレピタントを8日目に125mg、9〜10日目に80mg経口投与した時、経口避妊剤単独投与時に比べて、10日目にエチニルエストラジオールのAUCは0.81倍に低下し、ノルエチステロンのAUCは1.05倍であった。また、併用投与時には9日目から21日目にかけて、エチニルエストラジオール及びノルエチステロンの血漿中濃度のトラフ値が、最大でそれぞれ0.36倍及び0.40倍に低下した(外国人データ)。[10.2参照]
16.7.10 その他の薬剤
(1)オンダンセトロン
健康成人15例に対して、デキサメタゾンの投与に加え、アプレピタントを1日目に375mg、2〜5日目に250mg経口投与し、オンダンセトロン32mgを1日目に静脈内投与した時、オンダンセトロンのAUCはアプレピタント非併用時に比べて1.15倍であった(外国人データ)。10)
(2)グラニセトロン
健康成人17例に対して、アプレピタントを1日目に125mg、2〜3日目に80mg経口投与し、グラニセトロン2mgを1日目に経口投与した時、グラニセトロンのAUCは単独投与時に比べて1.10倍であった(外国人データ)。10)
(3)パロキセチン
健康成人18例に対して、アプレピタントの錠剤100mg(アプレピタントカプセル85mgと同程度のAUCが得られる)を1日1回4日間、5日目から錠剤200mg(アプレピタントカプセル170mgと同程度のAUCが得られる)を1日1回10日間とパロキセチン(20mgを1日1回14日間)を併用投与した時、アプレピタントのAUCは単独投与時に比べて0.73倍に、パロキセチンのAUCはパロキセチン単独投与時に比べて0.74倍に低下した(外国人データ)。
(4)ジゴキシン
健康成人11例に対して、ジゴキシン0.25mgを1日1回13日間反復投与時に、アプレピタントを7日目に125mg、8〜11日目に80mg経口投与した時、ジゴキシンのAUC及びCmaxは単独投与時に比べて、7日目に0.99倍及び1.04倍、11日目に0.93倍及び1.02倍であり、尿中排泄量は併用投与時と単独投与時で同様であった(外国人データ)。11)
(5)ドセタキセル
悪性腫瘍患者10例に対して、アプレピタントを1日目に125mg、2〜3日目に80mg経口投与し、ドセタキセル60〜100mg/m2を1日目に静脈内投与した時、ドセタキセルのAUC及びCmaxは単独投与時に比べて、それぞれ0.96倍及び0.95倍であった(外国人データ)。12)
(6)ビノレルビン
悪性腫瘍患者12例に対して、デキサメタゾン及びオンダンセトロンの投与に加え、アプレピタントを1日目に125mg、2〜3日目に80mg経口投与し、ビノレルビン25〜30mg/m2を1日目、8日目及び15日目に静脈内投与した時、ビノレルビンのAUC及び投与終了時の血漿中濃度はビノレルビン単独投与時に比べて、1日目に1.01倍及び1.16倍、8日目に1.00倍及び1.18倍であった(外国人データ)。13)
注)本剤の承認された用法及び用量は「成人及び12歳以上の小児:他の制吐剤との併用において、通常、成人及び12歳以上の小児にはホスアプレピタントとして150mgを抗悪性腫瘍剤投与1日目に1回、点滴静注する。」、「生後6ヵ月以上の乳幼児及び12歳未満の小児:他の制吐剤との併用において、通常、生後6ヵ月以上の乳幼児及び12歳未満の小児にはホスアプレピタントとして3.0mg/kgを抗悪性腫瘍剤投与1日目に1回、点滴静注する。ただし、ホスアプレピタントとして150mgを超えないこと。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(成人)
国内で実施された第III相二重盲検比較試験において、抗悪性腫瘍剤投与からの各期間における嘔吐なし、かつ救済治療なしの症例を有効とした有効率は以下のとおりである。14)また、安全性評価対象となった174例中46例(26.4%)に副作用(臨床検査値の異常を含む)が認められた。主な副作用は、便秘16例(9.2%)、ALT上昇12例(6.9%)、しゃっくり10例(5.7%)、注入部位疼痛・滴下投与部位痛9例(5.2%)、AST上昇8例(4.6%)、γ-GTP上昇6例(3.4%)、尿蛋白5例(2.9%)及び注入部位紅斑4例(2.3%)等であった。[5.、7.1参照]
| 主要評価項目 | 副次評価項目 | ||
| 抗悪性腫瘍剤注1)投与からの時間 | 全期間(0〜120時間) | 急性期(0〜24時間) | 遅発期(24<〜120時間) |
| 本剤群注2) | 64.2%*(111/173例) | 93.6%*(162/173例) | 64.7%*(112/173例) |
| 標準治療群注3) | 47.3%(79/167例) | 80.8%(135/167例) | 48.8%(81/166例) |
17.1.2 海外第III相試験(成人)
海外で実施された第III相二重盲検比較試験において、抗悪性腫瘍剤投与からの各期間における嘔吐なし、かつ救済治療なしの症例を有効とした有効率は以下のとおりである。15)また、安全性評価対象となった1143例中87例(7.6%)に副作用(臨床検査値の異常を含む)が認められた。主な副作用は、便秘23例(2.0%)、しゃっくり18例(1.6%)であった。[5.、7.1参照]
| 主要評価項目 | 副次評価項目 | ||
| 抗悪性腫瘍剤注4)投与からの時間 | 全期間(0〜120時間) | 急性期(0〜24時間) | 遅発期(24<〜120時間) |
| 本剤群注5) | 71.9%(795/1106例) | 89.0%(963/1082例) | 74.3%(822/1106例) |
| アプレピタント群注6) | 72.3%(820/1134例) | 88.0%(974/1107例) | 74.2%(841/1133例) |
17.1.3 国内第III相試験(小児)
生後6ヵ月以上18歳以下の小児を対象に国内で実施された臨床試験において、抗悪性腫瘍剤投与からの各期間における嘔吐なし、かつ救済治療なしの症例を有効とした有効率は以下のとおりである。また、生後6ヵ月以上18歳以下の小児の安全性評価対象となった27例中4例(14.8%)に副作用(臨床検査値の異常を含む)が認められた。主な副作用は、上腹部痛1例(3.7%)、リンパ球数減少1例(3.7%)、尿中ブドウ糖陽性1例(3.7%)、頭痛1例(3.7%)、しゃっくり1例(3.7%)であった。2)[5.、7.1、9.7参照]
| 抗悪性腫瘍剤注7)投与からの時間 | 全期間(0〜120時間) | 急性期(0〜24時間) | 遅発期(24<〜120時間) |
| 本剤群注8)(生後6ヵ月以上18歳以下) | 40.7%(11/27例) | 81.5%(22/27例) | 44.4%(12/27例) |
| 12歳以上18歳以下 | 25.0%(3/12例) | 75.0%(9/12例) | 25.0%(3/12例) |
| 生後6ヵ月以上12歳未満 | 53.3%(8/15例) | 86.7%(13/15例) | 60.0%(9/15例) |
18. 薬効薬理
18.1 作用機序
ホスアプレピタントは、静脈内投与後速やかに活性本体であるアプレピタントに代謝される。1)アプレピタントは選択的ニューロキニン1(NK1)受容体拮抗型制吐剤である。
18.2 ホスアプレピタントの薬理作用
18.2.1 ニューロキニン1(NK1)受容体に対する結合阻害活性
ホスアプレピタントはチャイニーズハムスター卵巣由来細胞株に発現させたヒトNK1受容体に対する125I-サブスタンスPの結合を阻害し、そのIC50値は2.1nmol/Lであった(in vitro)。16)
18.3 活性本体であるアプレピタントの薬理作用
18.3.1 ニューロキニン1(NK1)受容体拮抗作用
(1)NK1受容体に対する親和性
アプレピタントはチャイニーズハムスター卵巣由来細胞株に発現させたヒトNK1受容体に対する125I-サブスタンスPの結合を阻害し、そのIC50値は0.1nmol/L、Kd値は86pmol/L(Hill係数=1.1)であった(in vitro)。17)
(2)各種NK受容体作動薬誘発反応に対する作用
アプレピタントはサブスタンスP-O-メチルエステル(NK1受容体作動薬)誘発回腸縦走筋収縮に対し拮抗作用を示し、そのKa値は0.09±0.02nmol/L(n=3)であった。一方、(Nle10)-ニューロキニンA〔4-10〕(NK2受容体作動薬)誘発による気管収縮、及びセンクタイド(NK3受容体作動薬)誘発による上頸神経節脱分極反応に対し、1μmol/Lの濃度において作用を示さなかった(in vitro)。17)
18.3.2 シスプラチン誘発嘔吐抑制作用
(1)シスプラチン誘発嘔吐反応に対する作用
シスプラチンで誘発した雄フェレットの嘔吐反応を誘発4時間後まで観察した。シスプラチン投与3分前に静脈内投与あるいは1時間前に経口投与することにより、アプレピタントは嘔吐反応を用量依存的に抑制し、静脈内投与では1mg/kg以上の用量で、また経口投与では3mg/kgの用量で嘔吐反応をほぼ完全に抑制した。18)
(2)シスプラチン誘発急性並びに遅発性嘔吐反応に対する作用
シスプラチンで誘発した雄フェレットの急性嘔吐反応(誘発24時間まで)並びに遅発性嘔吐反応(誘発24時間以後72時間まで)を観察した。シスプラチン投与2時間前に経口投与することにより、アプレピタントは初回嘔吐反応発現までの時間を延長するとともに嘔吐回数を抑制し、16mg/kgの用量で急性及び遅発性嘔吐反応をほぼ完全に抑制した。18)
(3)シスプラチン誘発嘔吐反応に対するデキサメタゾン及びオンダンセトロン(5-HT3受容体拮抗型制吐剤)との併用効果
アプレピタント0.1mg/kg静脈内投与と、デキサメタゾン20mg/kg静脈内投与あるいはオンダンセトロン0.1mg/kg静脈内投与との併用により、シスプラチン投与後に観察される雄フェレットのレッチング及び嘔吐回数は減少し、それぞれの単独投与よりも低値を示した。18)
18.3.3 アポモルヒネ及びモルヒネ誘発嘔吐抑制作用
フェレットにおけるアポモルヒネあるいはモルヒネ皮下投与誘発の中枢性嘔吐反応を、アプレピタントは3mg/kg単回経口投与で抑制した。19)
19. 有効成分に関する理化学的知見
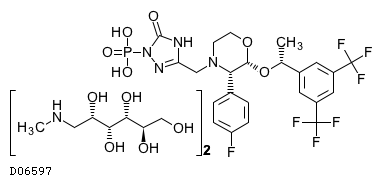
19.1. ホスアプレピタントメグルミン
22. 包装
5バイアル
23. 主要文献
- 小野薬品工業:海外成人第I相試験(社内資料;2011年9月26日承認、CTD2.7.2.2)
- 小野薬品工業:国内小児癌患者PK試験&第III相一般臨床試験(社内資料;2016年3月18日承認、CTD2.7.6.7)
- Sanchez R.I.et al., Drug Metab.Dispos., 32, 1287-1292, (2004)
- Bergman A.J.et al., Clin.Pharmacokinet., 44, 637-647, (2005)
- Marbury T.C.et al., J.Clin.Pharmacol., 51, 1712-1720, (2011)
- 中出 進ほか, Cancer Chemother.Pharmacol., 63, 75-83, (2008) »PubMed
- McCrea J.B.et al., Clin.Pharmacol.Ther., 74, 17-24, (2003)
- Depre M.et al., Eur.J.Clin.Pharmacol., 61, 341-346, (2005)
- Shadle C.R.et al., J.Clin.Pharmacol., 44, 215-223, (2004)
- Blum R.A.et al., Clin.Ther., 25, 1407-1419, (2003)
- Feuring M.et al., J.Clin.Pharmacol., 43, 912-917, (2003)
- Nygren P.et al., Cancer Chemother.Pharmacol., 55, 609-616, (2005)
- Loos W.J.et al., Cancer Chemother.Pharmacol., 59, 407-412, (2007)
- 齋藤 博ほか, Ann.Oncol., 24, 1067-1073, (2013) »PubMed
- Grunberg S.et al., J.Clin.Oncol., 29, 1495-1501, (2011)
- 小野薬品工業:ホスアプレピタントNK1受容体拮抗作用(社内資料;2011年9月26日承認、CTD2.6.2.2)
- 小野薬品工業:アプレピタントNK1受容体拮抗作用(社内資料;2009年10月16日承認、CTD2.6.2.2)
- Tattersall F.D.et al., Neuropharmacology, 39, 652-663, (2000)
- 小野薬品工業:アポモルヒネ及びモルヒネ誘発嘔吐抑制作用(社内資料;2009年10月16日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
小野薬品工業株式会社
くすり相談室
〒541-8564
大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
製品情報問い合わせ先
小野薬品工業株式会社
くすり相談室
〒541-8564
大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
26. 製造販売業者等
26.1 製造販売
小野薬品工業株式会社
大阪市中央区久太郎町1丁目8番2号