医薬品情報
| 総称名 | イコサペント酸エチル |
|---|---|
| 一般名 | イコサペント酸エチル |
| 欧文一般名 | Ethyl Icosapentate |
| 薬効分類名 | EPA製剤 |
| 薬効分類番号 | 2189 3399 |
| KEGG DRUG |
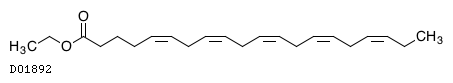
D01892
イコサペント酸エチル
|
| KEGG DGROUP |
DG01946
脂質低下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年11月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| イコサペント酸エチルカプセル300mg「サワイ」 (後発品) | ETHYL ICOSAPENTATE Capsules[SAWAI] | メディサ新薬 | 3399004M1336 | 14.6円/カプセル |
2. 禁忌
次の患者には投与しないこと
2.1 出血している患者(血友病、毛細血管脆弱症、消化管潰瘍、尿路出血、喀血、硝子体出血等)[止血が困難となるおそれがある。]
2.2 ミフェプリストン・ミソプロストールを投与中の患者[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
<高脂血症>
適用の前に十分な検査を実施し、高脂血症であることを確認した上で本剤の適用を考慮すること。
6. 用法及び用量
<閉塞性動脈硬化症に伴う潰瘍、疼痛および冷感の改善>
イコサペント酸エチルとして、通常、成人1回600mg(2カプセル)を1日3回、毎食直後に経口投与する。
なお、年齢、症状により、適宜増減する。
なお、年齢、症状により、適宜増減する。
<高脂血症>
イコサペント酸エチルとして、通常、成人1回900mg(3カプセル)を1日2回又は1回600mg(2カプセル)を1日3回、食直後に経口投与する。
ただし、トリグリセリドの異常を呈する場合には、その程度により、1回900mg(3カプセル)、1日3回まで増量できる。
ただし、トリグリセリドの異常を呈する場合には、その程度により、1回900mg(3カプセル)、1日3回まで増量できる。
8. 重要な基本的注意
<閉塞性動脈硬化症に伴う潰瘍、疼痛および冷感の改善>
8.1 治療にあたっては経過を十分に観察し、本剤で効果がみられない場合には、投与を中止し、他の療法に切り替えること。また、本剤投与中は定期的に血液検査を行うことが望ましい。
<高脂血症>
8.2 あらかじめ高脂血症治療の基本である食事療法を行い、更に運動療法や高血圧・喫煙等の虚血性心疾患のリスクファクターの軽減等も十分に考慮すること。
8.3 投与中は血中脂質値を定期的に検査し、治療に対する反応が認められない場合には投与を中止すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 出血を助長するおそれのある患者
(1)月経期間中の患者
(2)出血傾向のある患者
(3)手術を予定している患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
10. 相互作用
10.1 併用禁忌
| ミフェプリストン・ミソプロストール メフィーゴパック [2.2参照] | ミフェプリストン・ミソプロストールによる子宮出血の程度が悪化するおそれがある。 | イコサペント酸エチルの抗血小板作用により出血が増強するおそれがある。 |
10.2 併用注意
| 抗凝固剤 ワルファリンカリウム 等 血小板凝集を抑制する薬剤 アスピリン インドメタシン チクロピジン塩酸塩 シロスタゾール 等 | 出血傾向をきたすおそれがある。 | イコサペント酸エチルは抗血小板作用を有するので、抗凝固剤、血小板凝集を抑制する薬剤との併用により相加的に出血傾向が増大すると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害(頻度不明)、黄疸(頻度不明)
AST、ALT、Al-P、γ-GTP、LDH、ビリルビン等の上昇を伴う肝機能障害、黄疸があらわれることがある。
11.1.2 心房細動(頻度不明)、心房粗動(頻度不明)
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒感等 | |
| 出血傾向 | 皮下出血 | 血尿、歯肉出血、眼底出血、鼻出血、消化管出血等 |
| 血液 | 貧血等 | |
| 消化器 | 悪心、胸やけ、腹部不快感、下痢、便秘、腹部膨満感、腹痛 | 嘔吐、食欲不振、口内炎、口渇、鼓腸等 |
| 肝臓 | AST・ALT・Al-P・γ-GTP・LDH・ビリルビンの上昇等の肝機能障害 | |
| 腎臓 | BUN・クレアチニンの上昇 | |
| 呼吸器 | 咳嗽、呼吸困難 | |
| 精神神経系 | 頭痛・頭重感、ふらつき、しびれ | めまい、眠気、不眠 |
| 筋骨格系 | 関節痛、筋肉痛、四肢痛、筋痙攣(こむら返り等) | |
| その他 | 浮腫、尿酸上昇、CKの上昇、動悸 | 顔面潮紅、ほてり、発熱、頻尿、全身倦怠感、血圧上昇、女性化乳房、耳鳴、発汗、ざ瘡 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は空腹時に投与すると吸収が悪くなるので食直後に服用させること。
14.1.3 本剤は噛まずに服用させること。
15. その他の注意
15.1 臨床使用に基づく情報
コントロール不良の高血圧症を有し、他の抗血小板剤を併用した症例において、脳出血があらわれたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
健康成人男性各群8例にイコサペント酸エチル1回900mg、1日2回(朝・夕)又は1回600mg、1日3回(朝・昼・夕)、食直後に8日間反復経口投与注1)したときの薬物動態は類似しており、血漿中EPAの濃度は投与日数に従い徐々に上昇し、いずれの群においても投与5〜6日目に定常状態に達した4)。
16.1.2 生物学的同等性試験
イコサペント酸エチルカプセル300mg「サワイ」とエパデールカプセル300を健康成人男子にそれぞれ6カプセル(イコサペント酸エチルとして1,800mg注2))食後単回経口投与(クロスオーバー法)し、血漿中イコサペント酸濃度を測定した。投与前値で補正した値より得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された5)。
| Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC0-48hr(μg・hr/mL) | |
| イコサペント酸エチルカプセル300mg「サワイ」 | 121±54 | 5.4±0.8 | 28.8±19.5 | 1303±504 |
| エパデールカプセル300 | 114±43 | 5.7±0.9 | 23.5±7.8 | 1350±316 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 組織分布
雌雄ラットに14C標識EPA-Eを単回経口投与したときの組織内分布率は、観察期間を通じて肝、白色脂肪、筋肉及び皮膚で高値であった6)。
16.3.2 血漿蛋白結合率
雄ラット及び雄イヌに14C標識EPA-Eを単回経口投与したときの血漿蛋白結合率は、86.7〜98.8%及び96.7〜98.7%であった6)。
16.5 排泄
雄ラットに14C標識EPA-Eを経口投与したところ、投与168時間までの尿中への排泄は2.7%、糞中へは16.7%であった。なお、呼気中へ放射活性の44.4%が排泄された6)。
注1)閉塞性動脈硬化症に伴う潰瘍、疼痛および冷感の改善において本剤の承認された用法は、1日3回、毎食直後に経口投与である。
注2)高脂血症において本剤の承認された1回用量は、900mgまでである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<高脂血症>
17.1.1 国内第III相試験
トリグリセリドが高値の患者476例を対象として、イコサペント酸エチル1回900mg、1日2回(朝・夕)又は1回600mg、1日3回(朝・昼・夕)、食直後に12週間経口投与した二重盲検比較試験を行った。1日2回投与群(230例、血清トリグリセリドの投与前値256.7mg/dL)及び1日3回投与群(224例、血清トリグリセリドの投与前値249.4mg/dL)の最終評価時の血清トリグリセリド変化率は、それぞれ−12.62%及び−10.65%であり、事前に設定した非劣性限界値10%を下回ったことから、1日2回投与群の1日3回投与群に対する有効性(血清トリグリセリド変化率)の非劣性が確認された。
副作用発現頻度は、1日2回投与群3.7%(9/241例)、1日3回投与群3.8%(9/235例)であった。主な副作用は、便秘、消化不良及びALT上昇であった4)。
副作用発現頻度は、1日2回投与群3.7%(9/241例)、1日3回投与群3.8%(9/235例)であった。主な副作用は、便秘、消化不良及びALT上昇であった4)。
17.2 製造販売後調査等
17.2.1 市販後調査:JELIS
既に食事指導を行い、血清総コレステロール値が250mg/dL以上で、HMG-CoA還元酵素阻害剤による治療が必要とされる高脂血症患者(安定している虚血性心疾患合併患者を含む)19,466例を、HMG-CoA還元酵素阻害剤(プラバスタチン10mg/日又はシンバスタチン5mg/日)とイコサペント酸エチル1,800mg/日の併用による治療(イコサペント酸エチル群)又はHMG-CoA還元酵素阻害剤のみによる治療(対照群)に無作為に割り付けた。非盲検下で平均4.6年追跡した有効性評価対象18,645例(イコサペント酸エチル群:9,326例、対照群:9,319例)において、心血管イベント(突然心臓死、致死性及び非致死性心筋梗塞、不安定狭心症、心血管再建術)は、イコサペント酸エチル群で262例(2.8%)、対照群で324例(3.5%)に認められ、ハザード比は0.81(95%信頼区間:0.69-0.95、以下同様)であり、イコサペント酸エチル群で有意に減少した。心血管死(突然心臓死又は致死性心筋梗塞)は、イコサペント酸エチル群で29例(0.3%)、対照群で31例(0.3%)、ハザード比は0.94(0.57-1.56)、総死亡は、イコサペント酸エチル群で286例(3.1%)、対照群で265例(2.8%)、ハザード比は1.09(0.92-1.28)であり、いずれも有意差は認められなかった7)。
18. 薬効薬理
18.1 作用機序
18.2 抗血小板作用
18.2.1 各種血栓性、動脈硬化性疾患患者において、種々の凝集惹起剤による血小板凝集を抑制し、血小板粘着能も同様に抑制する11)。
18.2.2 主として血小板膜リン脂質中のEPA含量を増加させ、血小板膜からのアラキドン酸代謝を競合的に阻害することによりトロンボキサンA2産生を抑制し、血小板凝集を抑制すると考えられる12)。
18.2.3 コラーゲンによる血小板凝集を抑制する12)(ウサギ、ex vivo)。
18.2.4 ウサギにおいて、コラーゲン、ADP、アラキドン酸による血小板凝集を抑制する12)(in vitro)。
18.2.5 ラット胸部大動脈血管壁でのプロスタサイクリン様物質産生の不変ないし増加が認められている13)。
18.3 動脈の伸展性保持作用
18.3.1 高コレステロール食飼育ウサギにおける摘出大動脈の伸展性の低下に対して抑制作用を示し、普通食飼育ウサギの大動脈と同等の伸展性を保つ14)。
18.3.2 高コレステロール食飼育ウサギの胸部大動脈及び大腿動脈の脈波速度(PWV)の増大を抑制し、そのPWV値は普通食飼育ウサギとほぼ同程度である15)。
18.3.3 高コレステロール食飼育ウサギ大動脈の中膜平滑筋細胞密度及びエラスチン含量の低下、並びに平滑筋中の遊離コレステロールの蓄積を抑制する15)。
18.4 各種動脈閉塞性病態モデルに及ぼす作用
18.5 血清脂質低下作用
19. 有効成分に関する理化学的知見
19.1. イコサペント酸エチル
20. 取扱い上の注意
開封後は、高温・湿気・光を避けて保存すること。高温・高湿下ではカプセルが軟化することがある。
22. 包装
PTP
100カプセル(10Cap×10)
23. 主要文献
- Bhatt,D.L.et al., N.Engl.J.Med., 380 (1), 11-22, (2019) »PubMed
- Miyauchi,K.et al., Circulation., 150 (6), 425-434, (2024) »PubMed
- Nicholls,S.J.et al., JAMA., 324 (22), 2268-2280, (2020) »PubMed
- 村さきかがり他, Prog.Med., 32 (9), 1941-1946, (2012)
- 社内資料:生物学的同等性試験
- 石黒淳三他, 薬物動態, 2 (6), 683-702, (1987) »DOI
- Yokoyama,M.et al., Lancet, 369 (9567), 1090-1098, (2007) »PubMed
- 作用機序(エパデールEMカプセル:2022年6月20日承認、申請資料概要2.6.1)
- Mizuguchi,K.et al., Eur.J.Pharmacol., 231 (1), 121-127, (1993) »PubMed
- Mizuguchi,K.et al., Eur.J.Pharmacol., 235 (2-3), 221-227, (1993) »PubMed
- 五島雄一郎他, 臨床医薬, 8 (6), 1293-1309, (1992)
- Sato,M.et al., Biol.Pharm.Bull., 16 (4), 362-367, (1993) »PubMed
- Hamazaki,T.et al., Prostaglandins, 23 (4), 557-567, (1982) »PubMed
- 溝田雅洋他, 日本薬理学雑誌, 91 (4), 255-266, (1988) »PubMed
- Sato,M.et al., J.Cardiovasc.Pharmacol., 22 (1), 1-9, (1993) »PubMed
- Yamaguchi,K.et al., Prostaglandins Leukotrienes Med., 28 (1), 35-43, (1987) »PubMed
- 溝田雅洋他, 日本薬理学雑誌, 91 (2), 81-89, (1988) »PubMed
- 秦葭哉他, 老年医学, 30 (5), 819-852, (1992)
- 秦葭哉他, 老年医学, 30 (5), 799-818, (1992)
- 高久史麿他, 臨床医薬, 7 (11), 2567-2589, (1991)
- 田村泰他, 臨床医薬, 7 (8), 1817-1834, (1991)
- 松沢佑次他, 臨床医薬, 7 (8), 1801-1816, (1991)
- 都島基夫他, 臨床医薬, 7 (8), 1783-1799, (1991)
- Mizuguchi,K.et al., Jpn.J.Pharmacol., 59 (3), 307-312, (1992) »PubMed
- 水口清他, 動脈硬化, 18 (5), 471, (1990)
- 矢野崇他, 動脈硬化, 18 (5), 535, (1990)
- 水口清他, 動脈硬化, 18 (5), 536, (1990)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
メディサ新薬株式会社
大阪市淀川区宮原5丁目2-27
26.2 発売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30