医薬品情報
| 総称名 | リピディル |
|---|---|
| 一般名 | フェノフィブラート |
| 欧文一般名 | Fenofibrate |
| 薬効分類名 | 高脂血症治療剤 |
| 薬効分類番号 | 2183 |
| ATCコード | C10AB05 |
| KEGG DRUG |
D00565
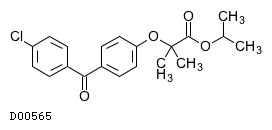
フェノフィブラート
|
| KEGG DGROUP |
DG01946
脂質低下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年11月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リピディル錠53.3mg | LIPIDIL TABLETS | あすか製薬 | 2183006F3023 | 15.1円/錠 | 処方箋医薬品注) |
| リピディル錠80mg | LIPIDIL TABLETS | あすか製薬 | 2183006F4020 | 19.8円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
高脂血症(家族性を含む)
5. 効能または効果に関連する注意
5.1 適用の前に十分な検査を実施し、高脂血症の診断が確立した患者に対してのみ本剤の適用を考慮すること。
5.2 総コレステロールのみが高い高脂血症(IIa型)に対し、第一選択薬とはしないこと。
5.3 カイロミクロンが高い高脂血症(I型)に対する効果は検討されていない。
6. 用法及び用量
通常、成人にはフェノフィブラートとして1日1回106.6mg〜160mgを食後経口投与する。なお、年齢、症状により適宜減量する。1日160mgを超える用量は投与しないこと。
7. 用法及び用量に関連する注意
7.1 総コレステロール及びトリグリセライドの両方が高い高脂血症(IIb及びIII型)には、1日投与量を106.6mgより開始すること。なお、これらの高脂血症患者において、高血圧、喫煙等の虚血性心疾患のリスクファクターを有し、より高い治療目標値を設定する必要のある場合には1日投与量を159.9mg〜160mg注)とすること。
注)159.9mgは53.3mg錠を3錠、160mgは80mg錠を2錠用いる。
7.2 トリグリセライドのみが高い高脂血症(IV及びV型)には、1日投与量53.3mgにおいても低下効果が認められているので、1日投与量を53.3mgより開始すること。
7.3 肝機能検査に異常のある患者又は肝障害の既往歴のある患者には、1日投与量を53.3mgより開始すること。[9.3.2参照]
7.4 急激な腎機能の悪化を伴う横紋筋融解症があらわれることがあるので、投与にあたっては患者の腎機能を検査し、血清クレアチニン値が2.5mg/dL以上の場合には投与を中止し、血清クレアチニン値が1.5mg/dL以上2.5mg/dL未満の場合は53.3mgから投与を開始するか、投与間隔を延長して使用すること。[2.3、9.2.1、9.2.2、11.1.1参照]
7.5 本剤はフェノフィブラートの吸収を高めるため、固体分散体化した製剤であり、本剤106.6mg(53.3mg製剤2錠)は微粉化フェノフィブラートカプセル製剤134mgと、また本剤160mg(80mg製剤2錠)は微粉化フェノフィブラートカプセル製剤200mgと生物学的に同等である。[16.1参照]
8. 重要な基本的注意
8.1 あらかじめ高脂血症の基本である食事療法を行い、更に運動療法や、高血圧、喫煙等の虚血性心疾患のリスクファクターの軽減等も十分に考慮すること。
8.2 投与中は血清脂質値を定期的に検査し、本剤の効果が認められない場合には漫然と投与せず、中止すること。
8.3 本剤は肝機能及び肝機能検査値に影響を及ぼし、AST、ALT、γ-GTP、LDH、ALPの上昇、黄疸、並びに肝炎があらわれることがあるので、肝機能検査は投与開始3カ月後までは毎月、その後は3カ月ごとに行うこと。[11.1.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 胆石の既往歴のある患者
胆石形成が報告されている。
9.2 腎機能障害患者
9.2.1 血清クレアチニン値が2.5mg/dL以上又はクレアチニンクリアランスが40mL/min未満の腎機能障害のある患者
9.2.2 血清クレアチニン値が1.5mg/dL以上2.5mg/dL未満又はクレアチニンクリアランスが40mL/min以上60mL/min未満の腎機能障害のある患者
9.2.3 腎機能に関する臨床検査値に異常が認められる患者
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。[2.5参照]
9.6 授乳婦
投与しないこと。動物(ラット)で乳汁中への移行が報告されている。[2.5参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
9.8.1 53.3mgから開始するなど投与量に十分注意すること。特に腎機能については投与中も血清クレアチニン値を定期的に確認するなど注意すること。一般に肝・腎機能が低下していることが多く、また、体重が少ない傾向があるなど副作用が発現しやすい。
9.8.2 スルホニル尿素系血糖降下薬(グリベンクラミド等)との併用により低血糖症(冷汗、強い空腹感、動悸等)があらわれるとの報告がある。[10.2参照]
10. 相互作用
10.2 併用注意
| 抗凝血剤 ワルファリン | プロトロンビン時間を測定して抗凝血剤の用量を調節し、慎重に投与すること。 | 抗凝血剤の作用を増強する。 |
| HMG-CoA還元酵素阻害薬 プラバスタチンナトリウム シンバスタチン フルバスタチンナトリウム 等 [9.2.3参照] | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。 | 危険因子:腎機能に関する臨床検査値に異常が認められる患者 |
| スルホニル尿素系血糖降下薬 グリベンクラミド グリメピリド 等 [9.8.2参照] | 低血糖症(冷汗、強い空腹感、動悸等)があらわれるとの報告があるので、併用する場合には、血糖値その他患者の状態を十分観察しながら投与すること。 | 血糖降下作用が増強される。 |
| 陰イオン交換樹脂剤 コレスチラミン | 陰イオン交換樹脂剤投与前1時間あるいは投与後4〜6時間以上間隔をあけて投与すること。 | 吸収が遅延あるいは減少する可能性がある。 |
| シクロスポリン | 外国において重症な腎機能障害が報告されているので、腎機能検査等に注意し、慎重に投与すること。 | 併用により腎機能への影響を増大させる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 横紋筋融解症(頻度不明)
11.1.2 肝障害(頻度不明)
11.1.3 膵炎(頻度不明)
重度の腹痛、嘔気、嘔吐、アミラーゼ上昇、リパーゼ上昇等を特徴とする膵炎があらわれることがある。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 肝臓 | 肝機能検査値異常(AST上昇、ALT上昇、ALP上昇、LDH上昇、γ-GTP上昇等) | 肝腫大 | ||
| 皮膚 | 発疹、そう痒感、蕁麻疹 | 脱毛、光線過敏症 | 多形紅斑 | |
| 消化器 | 嘔気、嘔吐、便秘、下痢、食欲不振、心窩部痛、胃部不快感 | 腹痛、口渇、腹部膨満感 | 口内炎、鼓腸、胸やけ | |
| 腎臓 | 腎機能検査値異常(BUN上昇、クレアチニン上昇等) | |||
| 筋肉 | CK上昇 | 脱力感 | 筋肉痛、筋痙攣、こわばり感 | |
| 血液 | 貧血(赤血球減少、ヘモグロビン減少、ヘマトクリット値減少)、白血球増多、白血球減少、好酸球増多、血小板増加 | 血小板減少 | ||
| 精神神経系 | 頭痛、めまい | ふらつき | ||
| 胆管系 | 胆石症、胆のう炎 | |||
| その他 | 抗核抗体陽性 | 全身倦怠感、動悸 | 腫脹、下肢痛、味覚異常 | 浮腫、発熱、勃起障害、頻尿、血中ホモシステイン増加、しびれ感、ほてり |
13. 過量投与
13.1 処置
本剤は蛋白結合率が高いため、血液透析によって除去できない。[16.3参照]
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は空腹時に投与すると吸収が悪くなるため食後に服用するよう指導すること。[16.2参照]
15. その他の注意
15.1 臨床使用に基づく情報
外国における「軽度の脂質代謝異常を有する2型糖尿病患者」を対象とした無作為化試験の結果、本剤投与群において膵炎及び静脈血栓塞栓症(肺塞栓症、深部静脈血栓症)の危険性がプラセボ投与群より高くなるとの報告がある1)。
15.2 非臨床試験に基づく情報
マウスの長期投与試験で雄の中間投与量群(60mg/kg)以上において肝細胞癌が、ラットの長期投与試験では、雄の中間投与量群(45mg/kg)以上において肝細胞癌と膵腺房細胞腫瘍及び精巣間細胞腫瘍が認められた。雌のラットとマウスでは、高投与量群(ともに200mg/kg)で肝細胞癌が認められた。
16. 薬物動態
16.1 血中濃度
本剤53.3mg及び80mgは、それぞれ微粉化フェノフィブラートカプセル製剤67mg及び100mgと生物学的に同等である。
健康成人男性に本剤106.6mg(53.3mg製剤2錠)又は本剤160mg(80mg製剤2錠)を食後単回経口投与したとき、活性代謝物であるフェノフィブリン酸の薬物動態パラメータ及び血漿中濃度は以下のとおりであった2)3)。[7.5参照]
健康成人男性に本剤106.6mg(53.3mg製剤2錠)又は本剤160mg(80mg製剤2錠)を食後単回経口投与したとき、活性代謝物であるフェノフィブリン酸の薬物動態パラメータ及び血漿中濃度は以下のとおりであった2)3)。[7.5参照]
| \投与量 | 本剤106.6mg (53.3mg×2錠) | 微粉化フェノフィブラートカプセル製剤134mg (67mg×2カプセル) |
| Cmax(μg/mL) | 8.993±1.017 | 9.186±1.930 |
| AUC0-96hr(μg・hr/mL) | 152.24±33.42 | 155.21±38.18 |
| Tmax(hr) | 3.40±0.94 | 4.30±0.73 |
| T1/2(hr) | 20.36±3.72 | 21.01±4.06 |
| \投与量 | 本剤160mg (80mg×2錠) | 微粉化フェノフィブラートカプセル製剤200mg (100mg×2カプセル) |
| Cmax(μg/mL) | 11.796±1.550 | 12.256±3.074 |
| AUC0-96hr(μg・hr/mL) | 207.12±42.11 | 216.68±54.09 |
| Tmax(hr) | 3.16±1.01 | 4.89±1.88 |
| T1/2(hr) | 22.54±3.24 | 24.49±4.26 |
16.2 吸収
16.3 分布
16.4 代謝
ヒト血漿中には主にフェノフィブリン酸が存在し、また、ヒト尿中にはフェノフィブリン酸とその還元体が主にグルクロン酸抱合体として排泄された6)。
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
軽度注1)及び中等度注2)の腎障害患者6例(各3例)に本剤80mgに相当する用量を朝食後30分に単回経口投与したとき、活性代謝物であるフェノフィブリン酸の薬物動態パラメータは、以下のとおりであった9)。[9.2.1、9.2.2参照]
注1)血清クレアチニン値1.5〜2.5mg/dL又はクレアチニンクリアランス40〜60mL/min
注2)血清クレアチニン値2.5〜4.0mg/dL又はクレアチニンクリアランス20〜40mL/min
| 腎障害患者の障害度 | AUC0-∞(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) |
| 軽度 | 202.7±82.3 | 8.2±4.2 | 6.0±1.2 | 25.5±2.2 |
| 中等度 | 266.9±71.2 | 6.5±1.7 | 6.7±0.7 | 35.1±5.7 |
16.7 薬物相互作用
ヒト肝ミクロソームを用いてフェノフィブリン酸のCYPの阻害について検討した結果、フェノフィブリン酸はCYP1A1、1A2、2A6、2B6、2C19、2D6、2E1及び3A4による代謝は阻害しなかったが、CYP2C9による代謝を阻害し、そのIC50は112μMであった10)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(二重盲検群間比較試験)
高脂血症患者236例を対象に、フェノフィブラートカプセル製剤とクリノフィブラート錠の有効性及び安全性を比較する二重盲検群間比較試験を実施した。本剤159.9mg〜160mgに相当する用量を1日1回夕食後に12週間経口投与したとき、改善率(中等度改善以上)はフェノフィブラートカプセル製剤群76.6%(85/111例)、クリノフィブラート錠群35.1%(40/114例)であり、両群間に有意差が認められた(p<0.001)。
投与前に血清脂質が異常値注)であった症例の血清脂質の投与12週の変化率(%)は以下のとおりであり、各指標の変化率は、フェノフィブラートカプセル製剤群がクリノフィブラート錠群よりも有意に大きかった(HDLコレステロールのみp<0.05/3、他はp<0.001/3)。
投与前に血清脂質が異常値注)であった症例の血清脂質の投与12週の変化率(%)は以下のとおりであり、各指標の変化率は、フェノフィブラートカプセル製剤群がクリノフィブラート錠群よりも有意に大きかった(HDLコレステロールのみp<0.05/3、他はp<0.001/3)。
| 総コレステロール | トリグリセライド | LDLコレステロール | HDLコレステロール | |
| フェノフィブラートカプセル製剤群 | −17.1±1.4(n=78) | −46.8±4.3(n=50) | −24.8±2.2(n=50) | 26.1±5.1(n=20) |
| クリノフィブラート錠群 | −5.0±1.2(n=82) | −12.3±5.5(n=52) | −8.5±1.5(n=54) | 9.8±2.8(n=31) |
フェノフィブラートカプセル製剤群の副作用発現頻度は8.6%(10/116例)で、主な副作用は胃部不快感3.4%(4例)、胃もたれ、嘔気、嘔吐、軟便各0.9%(1例)等の消化器症状であった。臨床検査値異常の発現頻度は35.3%(41/116例)であり、主な臨床検査値異常はAST上昇、ALT上昇、γ-GTP上昇等であった11)。
17.1.2 国内第III相試験(二重盲検群間比較試験)
高脂血症患者203例を対象に、フェノフィブラートカプセル製剤とベザフィブラート徐放錠の有効性及び安全性を比較する二重盲検群間比較試験を実施した。本剤159.9mg〜160mgに相当する用量を1日1回夕食後に12週間経口投与したとき、改善率(中等度改善以上)はフェノフィブラートカプセル製剤群81.9%(86/105例)、ベザフィブラート徐放錠群74.7%(71/95例)であり、両群間に有意差は認められなかった(χ2検定)。
投与前に血清脂質が異常値注)であった症例の血清脂質の投与12週の変化率(%)は以下のとおりであり、各指標について、両群間に有意差は認められなかった。
投与前に血清脂質が異常値注)であった症例の血清脂質の投与12週の変化率(%)は以下のとおりであり、各指標について、両群間に有意差は認められなかった。
| 総コレステロール | トリグリセライド | LDLコレステロール | HDLコレステロール | |
| フェノフィブラートカプセル製剤群 | −15.2±1.6(n=71) | −41.8±4.5(n=57) | −24.5±2.3(n=47) | 25.7±4.8(n=36) |
| ベザフィブラート徐放錠群 | −10.3±1.3(n=69) | −34.6±4.7(n=47) | −17.6±2.4(n=43) | 21.5±4.1(n=28) |
フェノフィブラートカプセル製剤群の副作用発現頻度は3.8%(4/106例)で、副作用は胃部不快感、便秘各1.9%(2例)等の消化器症状であった。臨床検査値異常の発現頻度は41.5%(44/106例)であり、主な臨床検査値異常はγ-GTP上昇、AST上昇、ALT上昇等であった12)。
注)総コレステロール:220mg/dL以上、トリグリセライド:150mg/dL以上、LDLコレステロール:160mg/dL以上、HDLコレステロール:40mg/dL未満
17.1.3 国内長期投与試験
17.1.4 特殊な高脂血症に対する試験
(1)家族性複合型高脂血症
家族性複合型高脂血症患者を対象に、本剤159.9mg〜160mgに相当する用量を1日1回6カ月間投与したとき、改善率は90.5%(19/21例)であった。副作用発現頻度は13.0%(3/23例)で、発現した副作用は肝腫大、嘔気、脱力感、全身倦怠感各4.3%(1例)であった15)。
(2)糖尿病を伴う高脂血症
コントロール良好な糖尿病を伴う高脂血症患者を対象に、本剤159.9mg〜160mgに相当する用量を1日1回6カ月間投与したとき、改善率は85.7%(18/21例)であった。また、インスリン基礎値及び糖負荷後のインスリン値が低下した。副作用発現頻度は9.5%(2/21例)で、発現した副作用は胃痛、嘔気、全身倦怠感各4.8%(1例)であった16)。
(3)高尿酸血症を伴う高脂血症
18. 薬効薬理
18.1 作用機序
核内受容体peroxisome proliferator-activated receptor α(PPARα)を活性化して種々の蛋白質の発現を調節することにより脂質代謝を総合的に改善させ、血清コレステロール濃度と血清トリグリセライド濃度を低下させるとともに、血清HDLコレステロールを上昇させる19)20)21)。
18.1.1 コレステロール低下作用
18.1.2 トリグリセライド低下作用
(1)リポ蛋白リパーゼ活性を亢進させ、トリグリセライド消失速度を上昇させる(ラット)22)。
(2)肝臓でのトリグリセライド生合成を抑制する(ラット)23)。
(3)VLDLトリグリセライドの分泌を抑制する(ラット)24)。
18.1.3 HDLコレステロール上昇作用
18.2 血清脂質改善作用
19. 有効成分に関する理化学的知見
19.1. フェノフィブラート
20. 取扱い上の注意
20.1 光により微黄色に変化することがあるので、開封後は遮光して保存すること。
20.2 開封後は湿気を避けて保存すること。
22. 包装
<リピディル錠53.3mg>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
<リピディル錠80mg>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
23. 主要文献
- Keech,A.et al., Lancet., 366, 1849-1861, (2005) »PubMed
- 社内資料:薬物動態比較試験、健康成人、フェノフィブラート53.3mg錠と微粉化フェノフィブラート67mgカプセル
- 社内資料:薬物動態比較試験、健康成人、フェノフィブラート80mg錠と微粉化フェノフィブラート100mgカプセル
- 社内資料:食事の影響に関する試験、健康成人、フェノフィブラート80mg錠
- 社内資料:蛋白結合率、健康成人、フェノフィブラートカプセル製剤
- 社内資料:代謝、健康成人、フェノフィブラートカプセル製剤
- 社内資料:排泄、健康成人、微粉化フェノフィブラートカプセル製剤
- Brodie,R.R.et al., Arzneim.-Forsch.(Drug Res.)., 26 (5), 896-901, (1976)
- 中谷矩章他, 薬理と治療, 23 (6), 1617-1626, (1995)
- 社内資料:フェノフィブリン酸のCYP阻害試験
- 馬渕 宏他, 臨床評価, 23 (2), 247-305, (1995)
- 秦 葭哉他, Geriat.Med., 33 (6), 765-822, (1995)
- 板倉弘重他, Prog.Med., 17 (3), 635-659, (1997)
- 五島雄一郎他, Geriat.Med., 33 (7), 909-938, (1995)
- 馬渕 宏他, Prog.Med., 15 (Suppl.1), 1047-1067, (1995)
- 藤島正敏他, Prog.Med., 15 (Suppl.1), 1069-1086, (1995)
- 鹿住 敏他, 臨床評価, 23 (3), 523-551, (1995)
- 赤岡家雄他, Prog.Med., 15 (Suppl.1), 1088-1109, (1995)
- Schoonjans,K.et al., EMBO J., 15 (19), 5336-5348, (1996) »PubMed
- Staels,B.et al., J.Clin.Invest., 95 (2), 705-712, (1995) »PubMed
- Schoonjans,K.et al., J.Lipid Res., 37 (5), 907-925, (1996) »PubMed
- 荒川礼二郎他, 薬理と治療, 23 (Suppl.4), S1055-1061, (1995)
- 永山 隆他, 薬理と治療, 23 (Suppl.4), S1071-1082, (1995)
- 永山 隆他, 薬理と治療, 23 (Suppl.4), S1063-1070, (1995)
- Vu-Dac,N.et al., J.Biol.Chem., 269 (49), 31012-31018, (1994) »PubMed
- Vu-Dac,N.et al., J.Clin.Invest., 96 (2), 741-750, (1995) »PubMed
- 佐々木淳他, 臨床評価, 23 (3), 553-579, (1995)
- 土屋亜紀子他, 薬理と治療, 23 (Suppl.4), S1041-1046, (1995)
- 永山 隆他, 薬理と治療, 23 (Suppl.4), S1047-1054, (1995)
24. 文献請求先及び問い合わせ先
文献請求先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
製品情報問い合わせ先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
26. 製造販売業者等
26.1 製造販売元
あすか製薬株式会社
東京都港区芝浦二丁目5番1号
26.2 販売元
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号