医薬品情報
| 総称名 | オキファスト |
|---|---|
| 一般名 | オキシコドン塩酸塩水和物 |
| 欧文一般名 | Oxycodone Hydrochloride Hydrate |
| 製剤名 | オキシコドン塩酸塩水和物注射液 |
| 薬効分類名 | がん疼痛治療用注射剤 |
| 薬効分類番号 | 8119 |
| ATCコード | N02AA05 |
| KEGG DRUG |
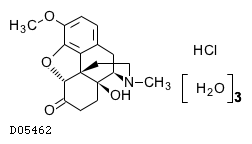
D05462
オキシコドン塩酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年11月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オキファスト注10mg | OXIFAST Injection | シオノギファーマ | 8119400A1025 | 281円/管 | 劇薬, 麻薬, 処方箋医薬品注) |
| オキファスト注50mg | OXIFAST Injection | シオノギファーマ | 8119400A2021 | 1373円/管 | 劇薬, 麻薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重篤な呼吸抑制のある患者、重篤な慢性閉塞性肺疾患の患者[呼吸抑制を増強する。][11.1.3参照]
2.2 気管支喘息発作中の患者[呼吸を抑制し、気道分泌を妨げる。]
2.3 慢性肺疾患に続発する心不全の患者[呼吸抑制や循環不全を増強する。][9.1.2参照]
2.4 痙攣状態(てんかん重積症、破傷風、ストリキニーネ中毒)にある患者[脊髄の刺激効果があらわれる。][9.1.14参照]
2.5 麻痺性イレウスの患者[消化管運動を抑制する。][11.1.6参照]
2.6 急性アルコール中毒の患者[呼吸抑制を増強する。]
2.7 アヘンアルカロイドに対し過敏症の患者
2.8 出血性大腸炎の患者[腸管出血性大腸菌(O157等)や赤痢菌等の重篤な細菌性下痢のある患者では、症状の悪化、治療期間の延長を来すおそれがある。][9.1.1参照]
2.9 ナルメフェン塩酸塩水和物を投与中又は投与中止後1週間以内の患者[10.1参照]
4. 効能または効果
中等度から高度の疼痛を伴う各種癌における鎮痛
6. 用法及び用量
通常、成人にはオキシコドン塩酸塩(無水物)として1日7.5〜250mgを持続静脈内又は持続皮下投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
7. 用法及び用量に関連する注意
<持続投与時>
7.1 初回投与
本剤の投与開始前のオピオイド鎮痛薬による治療の有無を考慮して初回投与量を設定することとし、既に治療されている場合にはその投与量及び鎮痛効果の持続を考慮して副作用の発現に注意しながら適宜投与量を調節すること。
7.1.1 オピオイド鎮痛薬を使用していない患者には、疼痛の程度に応じてオキシコドン塩酸塩として7.5〜12.5mgを1日投与量とすることが望ましい。
7.1.2 モルヒネ注射剤の持続静脈内投与を本剤に変更する場合には、モルヒネ注射剤1日投与量の1.25倍量を1日投与量の目安とすることが望ましい。
7.1.3 経口オキシコドン製剤から本剤へ変更する場合には、オキシコドン製剤1日投与量の0.75倍量を1日投与量の目安とすることが望ましい。
7.1.4 経皮フェンタニル貼付剤から本剤へ変更する場合には、経皮フェンタニル貼付剤剥離後にフェンタニルの血中濃度が50%に減少するまで17時間以上かかることから、剥離直後の本剤の使用は避け、本剤の使用を開始するまでに、フェンタニルの血中濃度が適切な濃度に低下するまでの時間をあけるとともに、本剤の低用量から投与することを考慮すること。
7.2 増量
本剤投与開始後は患者の状態を観察し、適切な鎮痛効果が得られ副作用が最小となるよう用量調整を行うこと。鎮痛効果が不十分な場合は、レスキュー薬の投与量を考慮して前日の1日投与量の25〜50%増を目安として増量を行うこと。[8.4参照]
7.3 減量
7.4 投与の中止
<臨時追加投与(レスキュー薬の投与)として本剤を使用する場合>
7.5 疼痛が増強した場合や鎮痛効果が得られている患者で突発性の疼痛が発現した場合は、本剤の1日投与量の1/24量(1時間量相当分)を目安に早送りによる投与又は追加の静脈内投与を行い、鎮痛を図ること。ただし、レスキュー薬としての投与を連続して行う場合は、呼吸抑制等の副作用の発現に注意すること。
8. 重要な基本的注意
8.1 連用により薬物依存を生じることがあるので、観察を十分に行い、慎重に投与すること。[11.1.2参照]
8.2 眠気、眩暈が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
8.3 本剤を投与する場合には、便秘に対する対策として緩下剤、嘔気・嘔吐に対する対策として制吐剤の併用を、また、鎮痛効果が得られている患者で通常とは異なる強い眠気がある場合には、過量投与の可能性を念頭において本剤の減量を考慮するなど、本剤投与時の副作用に十分注意すること。[13.1、13.2参照]
8.4 本剤を増量する場合には、副作用に十分注意すること。[7.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 細菌性下痢のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。治療期間の延長を来すおそれがある。[2.8参照]
9.1.2 心機能障害あるいは低血圧のある患者
循環不全を増強するおそれがある。[2.3参照]
9.1.3 呼吸機能障害のある患者
呼吸抑制を増強するおそれがある。[11.1.3参照]
9.1.4 脳に器質的障害のある患者
呼吸抑制や頭蓋内圧の上昇を起こすおそれがある。
9.1.5 ショック状態にある患者
循環不全や呼吸抑制を増強するおそれがある。[11.1.1参照]
9.1.6 代謝性アシドーシスのある患者
呼吸抑制を起こしたときアシドーシスを増悪させるおそれがある。
9.1.7 甲状腺機能低下症(粘液水腫等)の患者
呼吸抑制や昏睡を起こすおそれがある。
9.1.8 副腎皮質機能低下症(アジソン病等)の患者
呼吸抑制作用に対し、感受性が高くなっている。
9.1.9 薬物・アルコール依存又はその既往歴のある患者
依存性を生じやすい。[9.1.10参照]
9.1.10 薬物、アルコール等による精神障害のある患者
症状が増悪するおそれがある。[9.1.9参照]
9.1.11 衰弱者
呼吸抑制作用に対し、感受性が高くなっている。
9.1.12 前立腺肥大による排尿障害、尿道狭窄、尿路手術術後の患者
排尿障害を増悪することがある。
9.1.13 器質的幽門狭窄又は最近消化管手術を行った患者
消化管運動を抑制する。
9.1.14 痙攣の既往歴のある患者
痙攣を誘発するおそれがある。[2.4参照]
9.1.15 胆嚢障害、胆石症又は膵炎の患者
オッジ筋を収縮させ症状が増悪することがある。
9.1.16 重篤な炎症性腸疾患のある患者
連用した場合、巨大結腸症を起こすおそれがある。
9.2 腎機能障害患者
排泄が遅延し副作用があらわれるおそれがある。[16.6.1参照]
9.3 肝機能障害患者
代謝が遅延し副作用があらわれるおそれがある。[16.6.2参照]
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。オキシコドンでは催奇形作用は認められていないが、類薬のモルヒネの動物試験(マウス、ラット)で催奇形作用が報告されている。
9.5.2 分娩前に投与した場合、出産後新生児に退薬症候(多動、神経過敏、不眠、振戦等)があらわれることがある。
9.5.3 分娩時の投与により、新生児に呼吸抑制があらわれることがある。
9.6 授乳婦
本剤投与中は授乳を避けさせること。ヒト母乳中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら、慎重に投与すること。一般に生理機能が低下しており、特に呼吸抑制の感受性が高い。
10. 相互作用
相互作用序文
本剤は、主として薬物代謝酵素CYP3A4及び一部CYP2D6で代謝される。[16.4.2参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2D6
10.1 併用禁忌
| ナルメフェン塩酸塩水和物 セリンクロ [2.9参照] | 本剤の鎮痛作用を減弱させることがある。また、退薬症候を起こすことがある。 | μオピオイド受容体拮抗作用により、本剤の作用が競合的に阻害される。 |
10.2 併用注意
| 中枢神経抑制剤 フェノチアジン誘導体、バルビツール酸誘導体等 吸入麻酔剤 MAO阻害剤 三環系抗うつ剤 β遮断剤 アルコール | 臨床症状:呼吸抑制、低血圧及び顕著な鎮静又は昏睡が起こることがある。 措置方法:減量するなど慎重に投与すること。 | 相加的に中枢神経抑制作用を増強させる。 |
| クマリン系抗凝血剤 ワルファリンカリウム | クマリン系抗凝血剤の作用が増強されることがあるので投与量を調節するなど慎重に投与すること。 | 機序は不明である。 |
| 抗コリン作用を有する薬剤 フェノチアジン系薬剤、三環系抗うつ剤等 | 臨床症状:麻痺性イレウスに至る重篤な便秘又は尿貯留が起こることがある。 | 相加的に抗コリン作用を増強させる。 |
| ブプレノルフィン、ペンタゾシン等 | 本剤の鎮痛作用を減弱させることがある。また、退薬症候を起こすことがある。 | ブプレノルフィン、ペンタゾシン等は本剤の作用するμ受容体の部分アゴニストである。 |
| CYP3A4阻害作用を有する薬剤 ボリコナゾール、イトラコナゾール、フルコナゾール、リトナビル、クラリスロマイシン等 [16.7.1-16.7.3参照] | 本剤の血中濃度が上昇し、副作用が発現するおそれがあるので、観察を十分に行い、慎重に投与すること。 | CYP3A4を介する本剤の代謝が阻害される。 |
| CYP3A4誘導作用を有する薬剤 リファンピシン、カルバマゼピン、フェニトイン等 [16.7.4参照] | 本剤の血中濃度が低下し、作用が減弱する可能性がある。なお、これらの薬剤の中止後に、本剤の血中濃度が上昇し、副作用が発現するおそれがあるので、観察を十分に行い、慎重に投与すること。 | CYP3A4を介する本剤の代謝が促進される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
顔面蒼白、血圧低下、呼吸困難、頻脈、全身発赤、血管浮腫、蕁麻疹等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。[9.1.5参照]
11.1.2 依存性(頻度不明)
11.1.3 呼吸抑制(3%未満)
11.1.4 錯乱(1%未満)、譫妄(3%未満)
11.1.5 無気肺、気管支痙攣、喉頭浮腫(いずれも頻度不明)
11.1.6 麻痺性イレウス、中毒性巨大結腸(いずれも頻度不明)
炎症性腸疾患の患者に投与した場合、中毒性巨大結腸があらわれるとの報告がある。[2.5参照]
11.1.7 肝機能障害(5%未満)
AST、ALT、Al-P等の著しい上昇を伴う肝機能障害があらわれることがある。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 過敏症 | 発疹 | 蕁麻疹 | |
| 循環器 | 低血圧、血圧変動 | 不整脈、起立性低血圧、失神 | |
| 精神神経系 | 眠気・傾眠(23.8%) | 眩暈、頭痛・頭重感、不眠、悪夢、筋れん縮、発汗、焦燥 | 幻覚、意識障害、しびれ、不安、異夢、興奮、視調節障害、縮瞳、神経過敏、感覚異常、痙攣、振戦、筋緊張亢進、健忘、抑うつ、感情不安定、多幸感、思考異常、構語障害、痛覚過敏注)、アロディニア |
| 消化器 | 便秘(23.8%)、嘔気(22.8%)、嘔吐(19.8%) | 下痢、食欲不振、腹痛 | 胃不快感、おくび、鼓腸、味覚異常、嚥下障害、口渇、オッジ筋の機能不全 |
| 投与部位 | 発赤 | 腫脹、硬結、疼痛、そう痒感等の注射部位反応 | |
| その他 | そう痒感、呼吸困難、倦怠感、脱水 | 発熱、悪寒、頭蓋内圧の亢進、脱力感、胸部圧迫感、排尿障害、尿閉、無月経、性欲減退、勃起障害、浮腫、皮膚乾燥、血管拡張(顔面潮紅、熱感) |
13. 過量投与
13.1 症状
13.2 処置
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 オピオイド製剤のがん疼痛における臨床使用方法としては、経口投与又は直腸内投与が不可能なとき、初めて注射を用いる。
14.1.2 静注する場合には緩徐に行うことが望ましい。急速静注により、アナフィラキシー、重篤な呼吸抑制、低血圧、末梢循環虚脱、心停止が起こるおそれがある。[13.1参照]
14.2 薬剤交付時の注意
16. 薬物動態
16.1 血中濃度
16.1.1 持続静脈内投与及び持続皮下投与の定常状態時
日本人がん疼痛患者に本剤を持続静脈内投与(69例)及び持続皮下投与(19例)したときの、定常状態におけるオキシコドン及びノルオキシコドンの血漿中濃度と投与量の関係を図16-1及び図16-2に示す1)。
図16-1 持続静脈内投与時の定常状態における血漿中濃度と投与量の関係
オキシコドン
69例
ノルオキシコドン
69例
図16-2 持続皮下投与時の定常状態における血漿中濃度と投与量の関係
オキシコドン
19例
ノルオキシコドン
19例
16.1.2 急速単回静脈内投与時注
日本人がん疼痛患者7例にオキシコドン塩酸塩注射液2mgを急速静脈内投与注したときのオキシコドン及びノルオキシコドンの血漿中濃度の推移を図16-3に、薬物動態パラメータを表16-1に示す。オキシコドンに対するオキシモルフォンのCmax及びAUC0-lastの平均値の比はそれぞれ1%未満であった1)。
図16-3 急速静脈内投与(2mg)時注のオキシコドン及びノルオキシコドンの血漿中濃度推移
| 投与量 | 例数 | Cmax(ng/mL) | AUC0-6hr(ng・hr/mL) | AUC0-inf(ng・hr/mL) | T1/2(hr) | |
| 2mg | 7※ | オキシコドン | 18.5±4.11 | 37.11±10.65 | 54.38±25.19 | 3.26±0.774 |
| ノルオキシコドン | 1.69±0.528 | 8.928±2.772 | 33.02±18.47 | 12.1±5.81 |
注)本剤の承認用法は持続静脈内投与及び持続皮下投与である。
16.3 分布
16.3.1 体組織への移行
[3H]-オキシコドン塩酸塩水和物をラットに経口投与したとき、速やかに全身に分布し、ほとんどの組織で投与約1時間後に最高濃度を示し、その後速やかに低下した。作用部位である脳内における消失は、他の組織に比べて緩やかであった。なお、投与72時間後すべての組織において残留することはなかった2)。
16.3.2 母乳中への移行
オキシコドン塩酸塩とアセトアミノフェンの合剤を授乳婦6例に経口投与したとき、母乳への移行が認められ、そのときの投与0.25〜12時間後におけるオキシコドン塩酸塩濃度の乳汁/血漿中濃度の平均比率は3.4であった3)(外国人データ)。
16.4 代謝
16.4.1 ヒトにおけるオキシコドンの主代謝経路は、N-脱メチル化反応によるノルオキシコドンへの代謝であり、O-脱メチル化反応によるオキシモルフォンへの代謝及びグルクロン酸抱合代謝を受けることが知られている4)。
16.5 排泄
健康成人9例にオキシコドン塩酸塩0.28mg/kgを経口投与したとき、投与後24時間までの尿中に投与量の5.5±2.5%(平均値±標準偏差)が未変化体として、また、2.3±5.5%がオキシコドンの抱合体として排泄された。また、尿中にはノルオキシコドンとオキシモルフォン抱合体も排泄された5)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎障害者
16.6.2 肝障害者
16.6.3 高齢者
健康高齢者(65〜79歳)、健康非高齢者(21〜45歳)各14例にオキシコドン塩酸塩徐放錠20mgを空腹時単回経口投与したとき、薬物動態に関しては高齢者と非高齢者との間に差は認められなかった8)(外国人データ)。
16.7 薬物相互作用
16.7.1 ボリコナゾール(100〜200mg/日、経口投与)とオキシコドン塩酸塩(24〜48mg/日、持続皮下投与)を4日間併用した症例(1例)の定常状態時におけるオキシコドンの血漿中濃度は、測定した全症例の平均の3.57倍であった9)(国内における臨床試験成績)。
また、ボリコナゾール〔400mg/日(2日目のみ600mg/日)〕の経口投与中にオキシコドン塩酸塩(10mg)を単回経口投与した場合、オキシコドンのCmaxが1.72倍、AUCが3.61倍上昇したとの報告がある10)(外国人データ)。[10.2参照]
また、ボリコナゾール〔400mg/日(2日目のみ600mg/日)〕の経口投与中にオキシコドン塩酸塩(10mg)を単回経口投与した場合、オキシコドンのCmaxが1.72倍、AUCが3.61倍上昇したとの報告がある10)(外国人データ)。[10.2参照]
16.7.2 リトナビル(600mg/日)の経口投与中にオキシコドン塩酸塩(10mg)を単回経口投与した場合、オキシコドンのCmaxが1.74倍、AUCが2.95倍上昇したとの報告がある11)(外国人データ)。[10.2参照]
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(オープンラベル試験)
承認時における一般臨床試験での中等度から高度のがん疼痛を有する患者に対する臨床試験成績の概要を以下に示す9)。
(1)疼痛コントロール達成率
オピオイド系鎮痛剤による先行治療のない群及び先行治療のある群の、本剤投与による疼痛コントロール達成率は表17-1のとおりであった。
| 投与開始前の疼痛治療 | 静脈内投与 | 皮下投与 | ||
| 達成例数/評価対象例数 | 達成率(%) | 達成例数/評価対象例数 | 達成率(%) | |
| オピオイド系鎮痛剤非使用例 | 10/12 | 83.3 | 1/2 | − |
| オピオイド系鎮痛剤からの切替え例 | 47/58 | 81.0 | 13/17 | 76.5 |
| 合計 | 57/70 | 81.4 | 14/19 | 73.7 |
(2)疼痛強度改善率
本剤投与開始前及び投与終了時の疼痛強度が「なし」又は「軽度」であった例数の評価対象例数に対する割合は、表17-2のとおりであった。
| 観測時期 | 静脈内投与 | 皮下投与 | ||
| 改善例数/評価対象例数 | 改善率(%) | 改善例数/評価対象例数 | 改善率(%) | |
| 投与開始前 | 31/70<34/75> | 44.3<45.3> | 10/19<14/23> | 52.6<60.9> |
| 投与終了時 | 61/68<57/65> | 89.7<87.7> | 15/19<17/20> | 78.9<85.0> |
(3)臨時追加投与(レスキュードーズ)前後の疼痛強度改善率
本剤のレスキュードーズ前後の疼痛強度が「なし」又は「軽度」であった件数の評価対象件数に対する割合は、表17-3のとおりであった。
| 観測時期 | 静脈内投与 | 皮下投与 | ||
| 改善件数/評価対象件数 | 改善率(%) | 改善件数/評価対象件数 | 改善率(%) | |
| レスキュードーズ前 | 69/383 | 18.0 | 21/105 | 20.0 |
| レスキュードーズ後 | 288/382 | 75.4 | 73/105 | 69.5 |
18. 薬効薬理
18.1 作用機序
モルヒネと同様にμオピオイド受容体を介して鎮痛作用を示すものと考えられる。
18.2 薬理作用
鎮痛作用についてモルヒネ硫酸塩を対照薬として検討した。
マウスのHot plate法、Tail pressure法、酢酸ライジング法及びラットのTail flick法(いずれも経口投与)を用いて検討した結果、オキシコドン塩酸塩はモルヒネ硫酸塩よりED50値で3〜6倍、効力比で3〜5倍強い鎮痛作用を示した14)。
マウスのHot plate法、Tail pressure法、酢酸ライジング法及びラットのTail flick法(いずれも経口投与)を用いて検討した結果、オキシコドン塩酸塩はモルヒネ硫酸塩よりED50値で3〜6倍、効力比で3〜5倍強い鎮痛作用を示した14)。
| 試験法 | 動物種 | ED50(95%信頼限界)mg/kg | |
| オキシコドン塩酸塩 | モルヒネ硫酸塩 | ||
| Hot plate法 | マウス | 3.2(0.9-5.3) | 15.6(8.6-21.9) |
| Tail pressure法 | マウス | 3.5(2.7-4.5) | 8.9(4.8-12.7) |
| 酢酸ライジング法 | マウス | 2.3(1.6-4.0) | 7.0(4.6-15.6) |
| Tail flick法 | ラット | 3.8(1.8-5.5) | 21.6(19.2-24.2) |
19. 有効成分に関する理化学的知見
19.1. オキシコドン塩酸塩水和物
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
<オキファスト注10mg>
10管[1mL×10]
<オキファスト注50mg>
5管[5mL×5]
23. 主要文献
- 社内資料:国内第III相試験、静脈内及び皮下投与時の薬物動態(2012/1/18承認、申請資料概要2.7.2.2)
- 社内資料:ラットにおける組織分布(2003/4/16承認、オキシコンチン錠申請資料概要ヘ.2.(2)1))
- Marx,C.M.et al., Drug Intell.Clin.Pharm., 20, 474, (1986)
- 社内資料:肝代謝酵素(2003/4/16承認、オキシコンチン錠申請資料概要ヘ.2.(3))
- Poyhia,R.et al., Br.J.Clin.Pharmacol., 33, 617-621, (1992) »PubMed
- 社内資料:腎機能障害者における薬物動態(2003/4/16承認、オキシコンチン錠申請資料概要ヘ.3.(1)6))
- 社内資料:肝機能障害者における薬物動態(2003/4/16承認、オキシコンチン錠申請資料概要ヘ.3.(1)7))
- 社内資料:高齢者における薬物動態(2003/4/16承認、オキシコンチン錠申請資料概要ヘ.3.(1)5))
- 社内資料:国内第III相試験、有効性及び安全性の概要(2012/1/18承認、申請資料概要2.5.4.3、2.5.4.4、2.5.5.5)
- Hagelberg,N.M.et al., Eur.J.Clin.Pharmacol., 65, 263-271, (2009) »PubMed
- Nieminen,T.H.et al., Eur.J.Clin.Pharmacol., 66, 977-985, (2010) »PubMed
- Liukas,A.et al., J.Clin.Psychopharmacol., 31, 302-308, (2011) »PubMed
- Nieminen,T.H.et al., Anesthesiology., 110, 1371-1378, (2009) »PubMed
- 社内資料:マウス、ラットにおける鎮痛作用(2003/4/16承認、オキシコンチン錠申請資料概要ホ.1.(1))
24. 文献請求先及び問い合わせ先
文献請求先
塩野義製薬株式会社
医薬情報センター
〒541-0045
大阪市中央区道修町3丁目1番8号
電話:0120-956-734
FAX:06-6202-1541
製品情報問い合わせ先
塩野義製薬株式会社
医薬情報センター
〒541-0045
大阪市中央区道修町3丁目1番8号
電話:0120-956-734
FAX:06-6202-1541
25. 保険給付上の注意
本剤は厚生労働省告示第107号(平成18年3月6日付)に基づき、投与量は1回14日分を限度とされている。
26. 製造販売業者等
26.1 製造販売元
シオノギファーマ株式会社
大阪府摂津市三島2丁目5番1号
26.2 販売元
塩野義製薬株式会社
大阪市中央区道修町3丁目1番8号
26.3 提携
ムンディファーマB.V.