医薬品情報
| 総称名 | ロサルタンK |
|---|---|
| 一般名 | ロサルタンカリウム |
| 欧文一般名 | Losartan Potassium |
| 薬効分類名 | A-IIアンタゴニスト |
| 薬効分類番号 | 2149 |
| ATCコード | C09CA01 |
| KEGG DRUG |
D00357
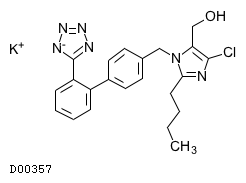
ロサルタンカリウム
|
| KEGG DGROUP |
DG01495
アンジオテンシンII受容体拮抗薬
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ロサルタンK錠25mg「オーハラ」 (後発品) | LOSARTAN POTASSIUM TABLETS 25mg「OHARA」 | 大原薬品工業 | 2149039F1074 | 10.4円/錠 | 処方箋医薬品注) |
| ロサルタンK錠50mg「オーハラ」 (後発品) | LOSARTAN POTASSIUM TABLETS 50mg「OHARA」 | 大原薬品工業 | 2149039F2070 | 14.7円/錠 | 処方箋医薬品注) |
| ロサルタンK錠100mg「オーハラ」 (後発品) | LOSARTAN POTASSIUM TABLETS 100mg「OHARA」 | 大原薬品工業 | 2149039F3069 | 25.3円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<高血圧及び蛋白尿を伴う2型糖尿病における糖尿病性腎症>
高血圧及び蛋白尿(尿中アルブミン/クレアチニン比300mg/g以上)を合併しない患者における本剤の有効性及び安全性は確認されていない。
6. 用法及び用量
<高血圧症>
通常、成人にはロサルタンカリウムとして25〜50mgを1日1回経口投与する。なお、年齢、症状により適宜増減するが、1日100mgまで増量できる。
<高血圧及び蛋白尿を伴う2型糖尿病における糖尿病性腎症>
通常、成人にはロサルタンカリウムとして50mgを1日1回経口投与する。なお、血圧値をみながら1日100mgまで増量できる。ただし、過度の血圧低下を起こすおそれのある患者等では25mgから投与を開始する。
7. 用法及び用量に関連する注意
<高血圧及び蛋白尿を伴う2型糖尿病における糖尿病性腎症>
本剤を投与後、血清クレアチニン値が前回の検査値と比較して30%(あるいは1mg/dL)以上増加した場合、及び糸球体ろ過値、1/血清クレアチニン値の勾配等で評価した腎機能障害の進展速度が加速された場合は、減量あるいは投与中止を考慮すること。
8. 重要な基本的注意
<効能共通>
8.1 一過性の血圧低下(ショック症状、意識消失、呼吸困難等を伴う)を起こすおそれがあるので、本剤投与中は定期的(投与開始時:2週間ごと、安定後:月1回程度)に血圧のモニタリングを実施すること。
8.2 降圧作用に基づくめまい、ふらつきがあらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
8.3 手術前24時間は投与しないことが望ましい。アンジオテンシンII受容体拮抗剤投与中の患者は、麻酔及び手術中にレニン・アンジオテンシン系の抑制作用による高度な血圧低下を起こすおそれがある。
8.4 本剤を含むアンジオテンシンII受容体拮抗剤投与中にまれに肝炎等の重篤な肝障害があらわれたとの報告がある。肝機能検査を実施するなど、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
<高血圧及び蛋白尿を伴う2型糖尿病における糖尿病性腎症>
8.5 貧血があらわれやすいので、本剤投与中は定期的(投与開始時:2週間ごと、安定後:月1回程度)に血液検査を実施するなど観察を十分に行うこと。
8.6 血清カリウム上昇及び血清クレアチニン上昇があらわれやすいので、本剤投与中は定期的(投与開始時:2週間ごと、安定後:月1回程度)に血清カリウム値及び血清クレアチニン値のモニタリングを実施すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 両側性腎動脈狭窄のある患者又は片腎で腎動脈狭窄のある患者
治療上やむを得ないと判断される場合を除き、使用は避けること。腎血流量の減少や糸球体ろ過圧の低下により急速に腎機能を悪化させるおそれがある。
9.1.2 高カリウム血症の患者
治療上やむを得ないと判断される場合を除き、使用は避けること。高カリウム血症を増悪させるおそれがある。
また、腎機能障害、コントロール不良の糖尿病等により血清カリウム値が高くなりやすい患者では、血清カリウム値に注意すること。[9.2.1参照]
また、腎機能障害、コントロール不良の糖尿病等により血清カリウム値が高くなりやすい患者では、血清カリウム値に注意すること。[9.2.1参照]
9.1.3 脳血管障害のある患者
過度の降圧が脳血流不全を惹起し、病態を悪化させるおそれがある。
9.1.4 厳重な減塩療法中の患者
本剤の投与を低用量から開始し、増量する場合は徐々に行うこと。一過性の血圧低下を起こすおそれがある。[11.1.5参照]
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害(血清クレアチニン2.5mg/dL以上)のある患者
投与量を減らすなど慎重に投与すること。高カリウム血症があらわれやすい。また、腎機能の悪化が起きるおそれがある。[9.1.2参照]
9.2.2 血液透析中の患者
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
9.3.2 肝機能障害又はその既往のある患者(ただし、重篤な肝障害のある患者を除く)
外国において、健康成人と比較して軽・中等度のアルコール性肝硬変患者ではロサルタンの消失速度が遅延し、ロサルタン及びカルボン酸体の血漿中濃度がそれぞれ約5倍及び約2倍に上昇することが報告されている。[9.3.1参照]
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性
妊娠していることが把握されずアンジオテンシン変換酵素阻害剤又はアンジオテンシンII受容体拮抗剤を使用し、胎児・新生児への影響(腎不全、頭蓋・肺・腎の形成不全、死亡等)が認められた例が報告されている1)2)。
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]
(1)本剤投与開始前に妊娠していないことを確認すること。本剤投与中も、妊娠していないことを定期的に確認すること。投与中に妊娠が判明した場合には、直ちに投与を中止すること。
(2)次の事項について、本剤投与開始時に患者に説明すること。また、投与中も必要に応じ説明すること。
・妊娠中に本剤を使用した場合、胎児・新生児に影響を及ぼすリスクがあること。
・妊娠が判明した又は疑われる場合は、速やかに担当医に相談すること。
・妊娠を計画する場合は、担当医に相談すること。
9.5 妊婦
9.6 授乳婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
9.8.1 一般に生理機能が低下しているので、患者の状態に注意すること。
9.8.2 低用量から投与を開始するなど慎重に投与すること。一般に過度の降圧は好ましくないとされている。脳梗塞等が起こるおそれがある。
9.8.3 高齢者での体内薬物動態試験で、ロサルタン及びカルボン酸体の血漿中濃度が非高齢者に比べて高かった。[16.6.3参照]
10. 相互作用
相互作用序文
本剤は、薬物代謝酵素チトクロームP450 2C9(CYP2C9)及び3A4(CYP3A4)により活性代謝物であるカルボン酸体に代謝される。
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| アリスキレン ラジレス (糖尿病患者に使用する場合。ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く。) [2.4参照] | 非致死性脳卒中、腎機能障害、高カリウム血症及び低血圧のリスク増加が報告されている。 | レニン・アンジオテンシン系阻害作用が増強される可能性がある。 |
10.2 併用注意
| カリウム保持性利尿剤: スピロノラクトン トリアムテレン等 カリウム補給剤: 塩化カリウム アンジオテンシン変換酵素阻害剤 トリメトプリム含有製剤: スルファメトキサゾール・トリメトプリム | 血清カリウム上昇、高カリウム血症を起こすおそれがある。 | カリウム貯留作用が増強するおそれがある。腎機能障害のある患者には特に注意すること。 また、本剤とアンジオテンシン変換酵素阻害剤及びカリウム保持性利尿剤の3剤併用の場合には特に注意すること。 |
| 利尿降圧剤: フロセミド トリクロルメチアジド等 [11.1.5参照] | 一過性の血圧低下を起こすおそれがある。本剤の投与を低用量から開始し、増量する場合は徐々に行うこと。 | 利尿降圧剤で治療を受けている患者にはレニン活性が亢進している患者が多く、本剤が奏効しやすい。 |
| アリスキレン | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。eGFRが60mL/min/1.73m2未満の腎機能障害のある患者へのアリスキレンとの併用については、治療上やむを得ないと判断される場合を除き避けること。 | レニン・アンジオテンシン系阻害作用が増強される可能性がある。 |
| アンジオテンシン変換酵素阻害剤 | 急性腎障害、高カリウム血症のリスクが増加するとの報告がある。また、低血圧を起こすおそれがある。 | レニン・アンジオテンシン系阻害作用が増強される可能性がある。 |
| 非ステロイド性消炎鎮痛剤: インドメタシン等 | 降圧作用が減弱されるおそれがある。 | プロスタグランジンの合成阻害作用により、本剤の降圧作用を減弱させる可能性がある。 |
| 非ステロイド性消炎鎮痛剤: インドメタシン等 | 腎機能が悪化している患者では、さらに腎機能が悪化するおそれがある。 | プロスタグランジンの合成阻害作用により、腎血流量が低下するためと考えられる。 |
| リチウム: 炭酸リチウム | リチウム中毒が報告されている。血中リチウム濃度に注意すること。 | 本剤のナトリウム排泄作用により、リチウムの蓄積が起こると考えられている。 |
| グレープフルーツジュース | 降圧作用が減弱されるおそれがある。本剤の投与中はグレープフルーツジュースの摂取は避けること。 | グレープフルーツジュースに含まれる成分のCYP3A4阻害作用によりロサルタンの活性代謝物の血中濃度が低下するため、本剤の降圧作用が減弱されるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
不快感、口内異常感、発汗、蕁麻疹、呼吸困難、全身潮紅、浮腫等があらわれることがある。
11.1.2 血管性浮腫(頻度不明)
顔面、口唇、咽頭、舌等の腫脹があらわれることがある。また、腹痛、嘔気、嘔吐、下痢等を伴う腸管血管性浮腫があらわれることがある。
11.1.3 急性肝炎又は劇症肝炎(いずれも頻度不明)
11.1.4 腎不全(頻度不明)
11.1.5 ショック、失神、意識消失(いずれも頻度不明)
11.1.6 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれた場合には、投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎障害の発症に注意すること。
11.1.7 高カリウム血症(頻度不明)
11.1.8 不整脈(頻度不明)
心室性期外収縮、心房細動等の不整脈があらわれることがある。
11.1.9 汎血球減少、白血球減少、血小板減少(いずれも頻度不明)
11.1.10 低血糖(頻度不明)
脱力感、空腹感、冷汗、手の震え、集中力低下、痙攣、意識障害等があらわれた場合には、投与を中止し、適切な処置を行うこと。糖尿病治療中の患者であらわれやすい。
11.1.11 低ナトリウム血症(頻度不明)
倦怠感、食欲不振、嘔気、嘔吐、痙攣、意識障害等を伴う低ナトリウム血症があらわれることがある。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 精神神経系 | 頭痛、めまい、不眠、浮遊感 | 耳鳴、眠気 |
| 循環器系 | 低血圧、起立性低血圧、胸痛 | 調律障害(頻脈等)、動悸 |
| 消化器 | 口角炎、嘔吐・嘔気、胃不快感、胃潰瘍 | 口内炎、下痢、口渇 |
| 肝臓 | 肝機能障害(AST上昇、ALT上昇、LDH上昇等) | 黄疸 |
| 腎臓 | BUN上昇、クレアチニン上昇 | |
| 皮膚 | 発疹、そう痒 | 蕁麻疹、多形紅斑、光線過敏、紅皮症、紅斑 |
| 血液 | 赤血球減少、ヘマトクリット低下、好酸球増多 | 貧血 |
| その他 | ほてり、倦怠感、無力症/疲労、浮腫、筋肉痛、総コレステロール上昇、CK上昇、血中尿酸値上昇 | 咳嗽、発熱、味覚障害、しびれ感、眼症状(かすみ、異和感等)、関節痛、筋痙攣、女性化乳房、勃起不全 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人にロサルタンカリウム25及び50mgを空腹時に1回経口投与した場合、ロサルタン及びカルボン酸体の血漿中濃度はそれぞれ投与約1時間及び約3時間でピークに達し、半減期は約2時間及び約4時間であり、カルボン酸体のAUC(血漿中濃度曲線下面積)はロサルタンの約7倍であった5)。
16.1.2 反復投与
健康成人にロサルタンカリウム100mgを1日1回7日間連続経口投与した場合の血漿中濃度から、ロサルタン及びカルボン酸体の蓄積性は認められなかった6)。
16.1.3 生物学的同等性試験
<ロサルタンK錠25mg「オーハラ」>
ロサルタンK錠25mg「オーハラ」とニューロタン錠25mgを、クロスオーバー法によりそれぞれ1錠(ロサルタンカリウムとしてそれぞれ25mg)健康成人男子に絶食単回経口投与して血漿中活性代謝物(カルボン酸体注))濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲であり、両剤の生物学的同等性が確認された7)。
| n | AUC0→48 (ng・hr/mL) | Cmax (ng/mL) | tmax (hr) | t1/2 (hr) | |
| ロサルタンK錠25mg「オーハラ」 | 24 | 1573.57±404.82 | 194.83±56.37 | 4.6±1.2 | 3.3±0.7 |
| ニューロタン錠25mg | 24 | 1626.60±396.42 | 200.67±59.17 | 4.5±1.0 | 3.3±0.7 |
血漿中カルボン酸体濃度の推移
<ロサルタンK錠50mg「オーハラ」>
ロサルタンK錠50mg「オーハラ」とニューロタン錠50mgを、クロスオーバー法によりそれぞれ1錠(ロサルタンカリウムとしてそれぞれ50mg)健康成人男子に絶食単回経口投与して血漿中活性代謝物(カルボン酸体注))濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲であり、両剤の生物学的同等性が確認された7)。
| n | AUC0→48 (ng・hr/mL) | Cmax (ng/mL) | tmax (hr) | t1/2 (hr) | |
| ロサルタンK錠50mg「オーハラ」 | 24 | 3255.94±856.44 | 527.67±128.98 | 3.1±0.8 | 3.3±0.7 |
| ニューロタン錠50mg | 24 | 3162.67±900.52 | 510.11±136.49 | 3.3±1.1 | 3.4±0.6 |
血漿中カルボン酸体濃度の推移
<ロサルタンK錠100mg「オーハラ」>
ロサルタンK錠100mg「オーハラ」とニューロタン錠100mgを、クロスオーバー法によりそれぞれ1錠(ロサルタンカリウムとしてそれぞれ100mg)健康成人男子に絶食単回経口投与して血漿中活性代謝物(カルボン酸体注))濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲であり、両剤の生物学的同等性が確認された7)。
| n | AUC0→48 (ng・hr/mL) | Cmax (ng/mL) | tmax (hr) | t1/2 (hr) | |
| ロサルタンK錠100mg「オーハラ」 | 24 | 7450.64±2142.74 | 1403.31±315.48 | 2.5±0.7 | 5.9±1.5 |
| ニューロタン錠100mg | 24 | 7276.85±2060.65 | 1367.59±324.07 | 2.4±0.7 | 6.5±2.1 |
血漿中カルボン酸体濃度の推移
注)イミダゾール環の5-ヒドロキシメチル基の酸化物
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、血液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
健康成人にロサルタンカリウム100mgを食後及び空腹時に1回経口投与した場合、吸収速度は食後投与で低下したが、吸収量の減少は僅かであった5)。
16.4 代謝
健康成人にロサルタンカリウム25、50、100又は200mg注)を1回経口投与した場合、速やかに吸収され、主に肝臓において主代謝物であるカルボン酸体(イミダゾール環の5-ヒドロキシメチル基の酸化物)に変換される5)。
16.5 排泄
健康成人にロサルタンカリウム25、50、100又は200mg注)を1回経口投与した場合、投与後30時間までのロサルタン及びカルボン酸体の尿中排泄率は各投与量のそれぞれ3.2〜4.1%及び6.1〜7.9%であった5)。
16.6 特定の背景を有する患者
16.6.1 腎障害患者
腎障害を伴う高血圧症患者に、ロサルタンカリウム50mgを食後1回経口投与した場合、血清クレアチニン値の高い群ほどロサルタン並びにカルボン酸体の最高血漿中濃度(Cmax)及びAUCは大きな値を示した。血清クレアチニン値3.0mg/dL以上の群では1.5mg/dL未満の群に比較してロサルタンのCmax及びAUCは2.4及び2.2倍に、カルボン酸体では1.6及び2.0倍の値を示した8)。
16.6.2 透析患者
16.6.3 高齢者
注1)本剤の承認された1回用量は25〜100mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<高血圧症>
17.1.1 国内臨床試験
軽・中等症本態性高血圧症患者を対象とした二重盲検比較試験において、降圧効果に関するエナラプリルマレイン酸塩との同等性が検証され、ロサルタンカリウムの有用性が認められている13)。
17.1.2 海外第III相試験
アンジオテンシン変換酵素(ACE)阻害剤による咳の既往を有する患者を対象とした二重盲検比較試験で、リシノプリル投与群の咳の再発現率(71.7%)は、ヒドロクロロチアジド投与群(34.1%)及びロサルタン投与群(29.2%)より有意に高く、ロサルタン投与群はヒドロクロロチアジド投与群と同程度であった14)。
<高血圧及び蛋白尿を伴う2型糖尿病における糖尿病性腎症>
17.1.3 国際共同第III相試験
国際共同試験として実施された二重盲検比較試験(RENAAL試験)において1,513例(日本人96例を含む)が評価された。本試験の主要エンドポイントは、血清クレアチニン値倍増、末期腎不全(透析あるいは腎移植の必要性)及び死亡の複合エンドポイントであった。ロサルタンカリウム(327例)は、プラセボ(359例)に比べて、主複合エンドポイントに到達するリスクを16.1%軽減(p=0.022)させた。さらに、ロサルタンカリウム治療群において、血清クレアチニン値倍増で25.3%(p=0.006)、末期腎不全で28.6%(p=0.002)、末期腎不全又は死亡で19.9%(p=0.009)、血清クレアチニン値倍増又は末期腎不全で21.0%(p=0.010)のリスク軽減が認められた。エンドポイント構成要素である全原因による死亡率については、両治療群間で有意な差はみられなかった。本試験の二次エンドポイントは、尿蛋白の変化量、腎症の悪化率、心血管系疾患の罹病率及び死亡率の複合(心不全による入院、心筋梗塞、血行再建術、脳卒中、不安定狭心症による入院又は心血管系疾患による死亡)であった。ロサルタンカリウムを平均3.4年以上投与された群において、尿蛋白量が平均で34.3%低下(p<0.001)した。また、ロサルタンカリウムは、血清クレアチニン値の逆数の傾きにより評価される腎機能低下率を13.9%(p=0.003)低下させた(低下率の中央値18.5%、p=0.01)。一方、心血管系疾患の罹病率及び死亡率の複合エンドポイントでは、ロサルタンカリウム治療群(247例)とプラセボ群(268例)との間に有意な差はみられなかったが、これは本試験がこのような効果に対する検出力を持ち合わせていなかったためである。なお、本試験におけるロサルタンカリウムの忍容性は良好であり、副作用による中止例の割合はプラセボ群と同等であった15)16)。
副作用は751例(日本人44例を含む)中129例(17.2%)に認められた。主な副作用は、めまい34例(4.5%)、高カリウム血症28例(3.7%)、低血圧19例(2.5%)、無力症/疲労12例(1.6%)であった。また、臨床検査値の異常変動は、111例(14.8%)に認められた。主な臨床検査値の異常変動は、血清カリウム上昇89例(11.9%)、クレアチニン上昇30例(4.0%)、BUN上昇10例(1.3%)であった16)。
副作用は751例(日本人44例を含む)中129例(17.2%)に認められた。主な副作用は、めまい34例(4.5%)、高カリウム血症28例(3.7%)、低血圧19例(2.5%)、無力症/疲労12例(1.6%)であった。また、臨床検査値の異常変動は、111例(14.8%)に認められた。主な臨床検査値の異常変動は、血清カリウム上昇89例(11.9%)、クレアチニン上昇30例(4.0%)、BUN上昇10例(1.3%)であった16)。
18. 薬効薬理
18.1 作用機序
ロサルタンカリウムは経口投与後速やかに吸収され、その一部が主代謝物であるカルボン酸体に変換される。ロサルタン及びカルボン酸体は、いずれも生理的昇圧物質であるアンジオテンシンII(A-II)に対して、その受容体において特異的に拮抗し、降圧効果を発揮する17)。
18.2 アンジオテンシン受容体拮抗作用
18.3 降圧作用
18.4 腎保護作用
19. 有効成分に関する理化学的知見
19.1. ロサルタンカリウム
20. 取扱い上の注意
開封後は湿気を避けて保存すること。
22. 包装
<ロサルタンK錠25mg「オーハラ」>
(PTP)
100錠(10錠×10×1袋)
(バラ)
500錠
<ロサルタンK錠50mg「オーハラ」>
(PTP)
100錠(10錠×10×1袋)
(バラ)
500錠
<ロサルタンK錠100mg「オーハラ」>
(PTP)
100錠(10錠×10×1袋)
23. 主要文献
- 阿部真也他, 周産期医学, 47 (10), 1353-1355, (2017)
- 齊藤大祐他, 鹿児島産科婦人科学会雑誌, 29, 49-54, (2021)
- Spence SG,et al., Teratology, 51 (6), 383-397, (1995) »PubMed
- Spence SG,et al., Teratology, 51 (6), 367-382, (1995) »PubMed
- 中島光好他, 臨床薬理, 26 (3), 671-684, (1995) »DOI
- 中島光好他, 臨床薬理, 26 (3), 685-696, (1995) »DOI
- 米納誠他, 新薬と臨床, 61 (3), 671-691, (2012)
- 猿田享男他, 臨床医薬, 10, 157-171, (1994)
- 多川斉他, 臨牀透析, 11 (2), 247-264, (1995)
- 本態性高血圧症患者(ニューロタン錠:2006年4月20日承認、申請資料概要ヘ.2.1)
- 海外での成績(ニューロタン錠:2006年4月20日承認、申請資料概要ヘ.3.3)
- 加齢の影響(ニューロタン錠:2006年4月20日承認、申請資料概要ヘ.1.1.1)
- 吉永馨他, 医学のあゆみ, 172 (12), 785-823, (1995)
- Lacourciere Y,et al., J Hypertens., 12 (12), 1387-1393, (1994) »PubMed
- Brenner BM,et al., N Engl J Med., 345 (12), 861-869, (2001) »PubMed
- RENAAL試験(ニューロタン錠:2006年4月20日承認、申請資料概要ト.1)
- 第十八改正日本薬局方解説書, C-6319-C-6323, (2021), (廣川書店)
- Chiu AT,et al., J Pharmacol Exp Ther., 252 (2), 711-718, (1990) »PubMed
- Wong PC,et al., J Pharmacol Exp Ther., 255 (1), 211-217, (1990) »PubMed
- Wong PC,et al., J Pharmacol Exp Ther., 252 (2), 719-725, (1990) »PubMed
- Mizuno K,et al., Eur J Pharmacol., 215, 305-308, (1992) »PubMed
- 岡田恵他, 基礎と臨床, 28 (13), 4063-4073, (1994)
- Wong PC,et al., Hypertension, 15 (5), 459-468, (1990) »PubMed
- Wong PC,et al., J Pharmacol Exp Ther., 252 (2), 726-732, (1990) »PubMed
- Bovee KC,et al., Am J Hypertens., 4, 327S-333S, (1991)
- Okada M,et al., Hypertens Res., 16, 49-55, (1993)
- Anderson S,et al., Am J Physiol., 265, F477-F486, (1993)
- Remuzzi A,et al., J Am Soc Nephrol., 4 (1), 40-49, (1993) »PubMed
- Sasaki M,et al., Life Sci., 75 (7), 869-880, (2004) »PubMed
- Pollock DM,et al., J Pharmacol Exp Ther., 267, 657-663, (1993) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
大原薬品工業株式会社
お客様相談室
〒104-6591
東京都中央区明石町8-1聖路加タワー36階
電話:0120-419-363
FAX:03-6740-7703
製品情報問い合わせ先
大原薬品工業株式会社
お客様相談室
〒104-6591
東京都中央区明石町8-1聖路加タワー36階
電話:0120-419-363
FAX:03-6740-7703
26. 製造販売業者等
26.1 製造販売元
大原薬品工業株式会社
滋賀県甲賀市甲賀町鳥居野121-15