医薬品情報
| 総称名 | キックリン |
|---|---|
| 一般名 | ビキサロマー |
| 欧文一般名 | Bixalomer |
| 製剤名 | ビキサロマーカプセル |
| 薬効分類名 | 高リン血症治療剤(リン酸結合性ポリマー) |
| 薬効分類番号 | 2190 |
| KEGG DRUG |
D09586
ビキサロマー
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年4月 改訂(第4版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| キックリンカプセル250mg | Kiklin Capsules 250mg | アステラス製薬 | 2190032M1027 | 18.3円/カプセル | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
慢性腎臓病患者における高リン血症の改善
5. 効能または効果に関連する注意
本剤は血中リンの排泄を促進する薬剤ではないため、食事療法等によるリン摂取制限を考慮すること。
6. 用法及び用量
通常、成人には、ビキサロマーとして1回500mgを開始用量とし、1日3回食直前に経口投与する。以後、症状、血清リン濃度の程度により適宜増減するが、最高用量は1日7,500mgとする。
7. 用法及び用量に関連する注意
7.1
<透析患者の場合>
投与量は、血清リン濃度が3.5〜6.0mg/dLとなるよう、以下の基準を目安に適宜増減する。
| 血清リン濃度 | 投与量増減方法 |
| 6.0mg/dLを超える | 1回250〜500mg(1〜2カプセル)増量する |
| 3.5〜6.0mg/dL | 投与量を維持する |
| 3.5mg/dL未満 | 1回250〜500mg(1〜2カプセル)減量する |
<保存期慢性腎臓病患者の場合>
投与量は、血清リン濃度を各施設の基準値内に維持するよう適宜増減する。増量幅はビキサロマーとして1回あたりの用量で500mgまでとする。
7.2 本剤投与開始時又は用量変更時には、1〜2週間後を目安に血清リン濃度の確認を行うことが望ましい。
7.3 増量を行う場合は1週間以上の間隔をあけて行うこと。
8. 重要な基本的注意
8.1 腸管穿孔、腸閉塞があらわれることがあるので、下記の点に留意すること。
8.2 本剤は、定期的に血清リン、血清カルシウム及び血清PTH濃度を測定しながら投与すること。血清リン、血清カルシウム及び血清PTH濃度の管理目標値及び測定頻度は、学会のガイドライン等、最新の情報を参考にすること。低カルシウム血症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤やカルシウム製剤の投与を考慮し、カルシウム受容体作動薬が使用されている場合には、カルシウム受容体作動薬の減量等も考慮すること。また、二次性副甲状腺機能亢進症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤、カルシウム製剤、カルシウム受容体作動薬の投与あるいは他の適切な治療法を考慮すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 便秘のある患者
9.1.2 腸管狭窄のある患者
9.1.3 腸管憩室のある患者
9.1.4 腹部手術歴のある患者
9.1.5 痔疾患のある患者
症状を悪化させるおそれがある。
9.1.6 消化管潰瘍又はその既往歴のある患者
症状を悪化又は再発させるおそれがある。
9.1.7 重度の消化管運動障害を有する患者
症状を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
消化器症状等の副作用の発現に注意すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| エナラプリル アトルバスタチン バルサルタン [16.7.1参照] | 本剤とこれらの薬剤を併用した場合の血中濃度は、エナラプリルでは約80%に、アトルバスタチンでは約70〜80%に、バルサルタンでは約30〜40%にそれぞれ低下した。これらの薬剤の作用を減弱させるおそれがあるので、併用する場合にはこれらの薬剤の作用を観察すること。 | 本剤はリン酸結合性ポリマーであり、同時に服用した場合、これらの薬剤の吸収を遅延あるいは減少させる。 |
| カンデサルタン シレキセチル テルミサルタン オルメサルタン メドキソミル イルベサルタン | In vitro試験で、本剤とこれらの薬剤の吸着が認められており、これらの薬剤の作用を減弱させるおそれがあるので、併用する場合にはこれらの薬剤の作用を観察すること。 | 本剤はリン酸結合性ポリマーであり、同時に服用した場合、これらの薬剤の吸収を遅延あるいは減少させる。 |
| シプロフロキサシン | 他のリン酸結合性ポリマーで、同時に服用した場合、シプロフロキサシンのバイオアベイラビリティが低下したとの報告がある。シプロフロキサシンの作用を減弱させるおそれがあるので、併用する場合にはこの薬剤の作用を観察すること。 | 本剤はリン酸結合性ポリマーであり、同時に服用した場合、これらの薬剤の吸収を遅延あるいは減少させる。 |
| 甲状腺ホルモン製剤 レボチロキシン 等 | 他のリン酸結合性ポリマーとレボチロキシンとの併用患者において、甲状腺刺激ホルモン(TSH)濃度が上昇したとの報告がある。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 腸管穿孔、腸閉塞(いずれも頻度不明)
11.1.2 虚血性腸炎(1%未満)
病態が進行し腸管穿孔等の重篤な状態に至らぬよう、異常が認められた場合には、投与を中止し、適切な処置を行うこと。[11.1.1参照]
11.1.3 消化管出血、消化管潰瘍(各1%未満)
吐血、下血及び食道、胃、十二指腸、結腸、直腸等の潰瘍があらわれることがある。
11.1.4 便秘・便秘増悪(15%以上)
11.1.5 憩室炎(頻度不明)
11.1.6 肝機能障害(頻度不明)
AST、ALT、γ-GTPの著しい上昇を伴う肝機能障害の発現が報告されている。
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 消化器 | 硬便、腹部不快感、腹部膨満、悪心 | 下痢、嘔吐、腹痛、胃炎、痔核、便潜血陽性 | |
| 皮膚 | そう痒症 | 発疹 | |
| 血液 | 血中副甲状腺ホルモン増加 | ||
| 精神神経系 | 下肢静止不能症候群 | ||
| その他 | 口渇、回転性めまい |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.2 吸収
16.5 排泄
16.7 薬物相互作用
16.7.1 エナラプリル、アトルバスタチン及びバルサルタン
16.7.2 その他の薬剤
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(血液透析患者)
多施設共同、ランダム化、セベラマー塩酸塩対照非盲検、非劣性検証試験を実施した。高リン血症を合併する血液透析中の慢性腎不全患者104例(本剤54例、セベラマー塩酸塩50例)を対象として本剤1日1,500mgから投与を開始し、1日7,500mgまでの範囲で適宜増減し、12週間投与した。投与開始時の血清リン濃度(平均値±標準偏差)は、7.85±1.539mg/dLであった。投与開始時の血清リン濃度を共変量とした主解析では、投与終了時の血清リン濃度(調整済み平均±標準誤差)は、5.87±0.154mg/dLと低下が認められた。また、血清補正カルシウム濃度は、投与開始時(平均値±標準偏差)8.66±0.661mg/dL、投与終了時(平均値±標準偏差)8.89±0.641mg/dLと大きな変化は認められなかった8)。本試験における副作用は29.1%(16/55例)に認められた。主な副作用は便秘18.2%(10/55例)、硬便5.5%(3/55例)であった。
17.1.2 国内長期投与試験(血液透析患者)
多施設共同、非盲検、非対照試験を実施した。高リン血症を合併する血液透析中の慢性腎不全患者243例を対象として本剤1日1,500mgから投与を開始し、1日7,500mgまでの範囲で適宜増減を行い、48週間投与した。この結果、血清リン濃度の低下が維持された。血清リン濃度は、投与開始時(平均値±標準偏差)7.71±1.275mg/dL、投与終了時(平均値±標準偏差)5.77±1.377mg/dLであった9)。副作用発現率は29.4%(73/248例)であった。主な副作用は便秘21.0%(52/248例)、腹部不快感1.2%(3/248例)、硬便1.2%(3/248例)であった。長期投与により副作用の発現率が増加する傾向はみられなかった。
17.1.3 国内一般臨床試験(腹膜透析患者)
多施設共同、非盲検、非対照試験を実施した。高リン血症を合併する腹膜透析中の慢性腎不全患者34例を対象として本剤1日1,500mgから投与を開始し、1日7,500mgまでの範囲で適宜増減し、12週間投与した。この結果、血清リン濃度が投与開始時(平均値±標準偏差)7.77±1.199mg/dLから治療期終了時(平均値±標準偏差)6.40±1.098mg/dLへと低下した10)。副作用発現率は40.0%(14/35例)であった。主な副作用は便秘が11.4%(4/35例)、そう痒症が8.6%(3/35例)であった。
17.1.4 国内第III相試験(保存期慢性腎臓病患者)
多施設共同、ランダム化、プラセボ対照二重盲検試験を実施した。高リン血症を合併する保存期慢性腎臓病患者162例(本剤80例、プラセボ82例)を対象として本剤1日1,500mgから投与を開始し、1日7,500mgまでの範囲で適宜増減し、プラセボを対照に12週間投与した。この結果、本剤投与群で投与開始時の血清リン濃度(平均値±標準偏差)は5.26±0.87mg/dLであり、投与終了時の血清リン濃度(平均値±標準偏差)は4.49±0.93mg/dLへと低下が認められた。プラセボ投与群では、投与開始時の血清リン濃度(平均値±標準偏差)は5.29±1.07mg/dL、投与終了時の血清リン濃度(平均値±標準偏差)は5.49±1.23mg/dLであった。投与終了時(治療期12週又は投与中止時)の血清リン濃度の治療期開始日(0週)からの変化量について、投与群を因子、0週の血清リン濃度の値及びeGFR(mL/min/1.73m2)カテゴリを説明変数とした共分散分析を行った結果、本剤群はプラセボ群と比較して統計的に有意な差が認められた11)。本試験における副作用は31.3%(25/80例)に認められた。主な副作用は便秘16.3%(13/80例)、腹部不快感、腹部膨満、腹痛、悪心、各2.5%(2/80例)であった。重篤な副作用は、胃食道炎及び上部消化管出血(各1例)であった。
17.1.5 国内長期投与試験(保存期慢性腎臓病患者)
多施設共同、非盲検、非対照試験を実施した。高リン血症を合併する保存期慢性腎臓病患者105例を対象として本剤1日1,500mgから投与を開始し、1日7,500mgまでの範囲で適宜増減を行い、48週間投与した。血清リン濃度は、投与開始時(平均値±標準偏差)5.15±0.83mg/dL、48週時(平均値±標準偏差)4.58±0.68mg/dL、投与終了時(平均値±標準偏差)4.96±0.98mg/dLであった12)。副作用発現率は31.4%(33/105例)であった。主な副作用は便秘18.1%(19/105例)、腹部膨満、悪心の各1.9%(2/105例)であった。重篤な副作用は、胃潰瘍及び結腸癌(各1例、同一被験者)であった。
18. 薬効薬理
18.1 作用機序
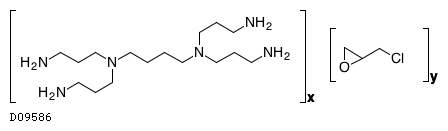
ビキサロマーはアミン機能性リン酸結合性ポリマーであり、消化管内でリン酸と結合して糞中へのリン排泄を促進することにより、消化管からのリン吸収を抑制し血中リン濃度を低下させる。
18.2 血漿リン濃度及びCa×P積低下作用
18.3 血管石灰化抑制作用
ビタミンD負荷アデニン誘発慢性腎臓病ラットにおいて、ビキサロマーは2%の混餌投与により、大動脈中カルシウム量を有意に低下させた15)。
18.4 二次性副甲状腺機能亢進症改善作用
18.5 腎性骨異栄養症進展抑制作用
アデニン誘発慢性腎臓病ラットにおいて、ビキサロマーは3%の混餌投与により、大腿骨の空隙面積率及び線維化面積率を低下させた。類骨面積率に対しては、ビキサロマー投与による有意な変化は認められなかった18)。
18.6 血液pH、重炭酸イオン濃度に対する作用
アデニン誘発慢性腎臓病ラットにおいて、ビキサロマーは3%の混餌投与により、血液pH及び血液重炭酸イオン濃度の低下を改善した19)。
19. 有効成分に関する理化学的知見
19.1. ビキサロマー
22. 包装
100カプセル(10カプセル×10、乾燥剤入り)、500カプセル(10カプセル×50、乾燥剤入り)
23. 主要文献
- 社内報告書:海外健康成人・マスバランス試験(2012年3月30日承認 CTD2.7.6.2)
- 社内報告書:健康成人・エナラプリルとの薬物相互作用試験(2012年3月30日承認 CTD2.7.6.6)
- 社内報告書:健康成人・アトルバスタチンとの薬物相互作用試験(2012年3月30日承認 CTD2.7.6.7)
- 社内報告書:健康成人・バルサルタンとの薬物相互作用試験(2012年3月30日承認 CTD2.7.6.8)
- 社内報告書:海外健康成人・ワルファリンとの薬物相互作用試験(2012年3月30日承認 CTD2.7.6.3)
- 社内報告書:海外健康成人・ジゴキシンとの薬物相互作用試験(2012年3月30日承認 CTD2.7.6.4)
- 社内報告書:海外健康成人・シナカルセトとの薬物相互作用試験(2012年3月30日承認 CTD2.7.6.5)
- Akizawa,T.et al., Ther.Apher.Dial., 18 (2), 122-131, (2014) »PubMed »DOI
- Akizawa,T.et al., Ther.Apher.Dial., 17 (6), 612-619, (2013) »PubMed »DOI
- 社内報告書:腹膜透析患者・腹膜透析患者対象一般臨床試験(2012年3月30日承認 CTD2.7.6.16)
- Akizawa,T.et al., Ther.Apher.Dial., 20 (6), 588-597, (2016) »PubMed »DOI
- Akizawa,T.et al., Ther.Apher.Dial., 21 (2), 173-179, (2017) »PubMed »DOI
- 社内報告書:in vivo薬理試験(2012年3月30日承認 CTD2.6.2.2.1.1.1)
- 社内報告書:in vivo薬理試験(2012年3月30日承認 CTD2.6.2.2.1.1.2)
- 社内報告書:in vivo薬理試験(2012年3月30日承認 CTD2.6.2.2.1.3.1)
- 社内報告書:in vivo薬理試験(2012年3月30日承認 CTD2.6.2.2.1.2.1)
- 社内報告書:in vivo薬理試験(2012年3月30日承認 CTD2.6.2.2.1.2.2)
- 社内報告書:in vivo薬理試験(2012年3月30日承認 CTD2.6.2.2.1.4.2)
- 社内報告書:in vivo薬理試験(2012年3月30日承認 CTD2.6.2.2.1.5.1)
24. 文献請求先及び問い合わせ先
文献請求先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
製品情報問い合わせ先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
26. 製造販売業者等
26.1 製造販売
アステラス製薬株式会社
東京都中央区日本橋本町2丁目5番1号