医薬品情報
| 総称名 | カルボプラチン |
|---|---|
| 一般名 | カルボプラチン |
| 欧文一般名 | Carboplatin |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01XA02 |
| KEGG DRUG |
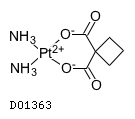
D01363
カルボプラチン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| カルボプラチン注射液50mg「日医工」 | 日医工 | 4291403A1126 | 1401円/瓶 | 毒薬, 処方箋医薬品注) | |
| カルボプラチン注射液150mg「日医工」 | 日医工 | 4291403A2122 | 3417円/瓶 | 毒薬, 処方箋医薬品注) | |
| カルボプラチン注射液450mg「日医工」 (後発品) | 日医工 | 4291403A3129 | 4966円/瓶 | 毒薬, 処方箋医薬品注) |
1. 警告
1.1 本剤を含むがん化学療法は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本療法が適切と判断される症例についてのみ実施すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
1.2 本剤を含む小児悪性固形腫瘍に対するがん化学療法は、小児のがん化学療法に十分な知識・経験を持つ医師のもとで実施すること。
2. 禁忌
次の患者には投与しないこと
2.1 重篤な骨髄抑制のある患者[骨髄抑制は用量規制因子であり、感染症又は出血を伴い、重篤化する可能性がある。]
2.2 本剤又は他の白金を含む薬剤に対し、重篤な過敏症の既往歴のある患者
2.3 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
○以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
5. 効能または効果に関連する注意
<切除不能な進行・再発の悪性胸膜中皮腫>
ペムブロリズマブ(遺伝子組換え)及びペメトレキセドナトリウムと併用する際の用法及び用量は、ペムブロリズマブ(遺伝子組換え)の電子添文を参照すること。
6. 用法及び用量
<頭頸部癌、肺小細胞癌、睾丸腫瘍、卵巣癌、子宮頸癌、悪性リンパ腫、非小細胞肺癌>
通常、成人にはカルボプラチンとして、1日1回300〜400mg/m2(体表面積)を投与し、少なくとも4週間休薬する。これを1クールとし、投与を繰り返す。なお、投与量は、年齢、疾患、症状により適宜増減する。
<乳癌>
トラスツズマブ(遺伝子組換え)及びタキサン系抗悪性腫瘍剤との併用において、通常、成人にはカルボプラチンとして、1日1回300〜400mg/m2(体表面積)を投与し、少なくとも3週間休薬する。これを1クールとし、投与を繰り返す。なお、投与量は、患者の状態により適宜減ずる。
<小児悪性固形腫瘍(神経芽腫・網膜芽腫・肝芽腫・中枢神経系胚細胞腫瘍、再発又は難治性のユーイング肉腫ファミリー腫瘍・腎芽腫)に対する他の抗悪性腫瘍剤との併用療法>
(1)神経芽腫・肝芽腫・中枢神経系胚細胞腫瘍、再発又は難治性のユーイング肉腫ファミリー腫瘍・腎芽腫に対する他の抗悪性腫瘍剤との併用療法
イホスファミドとエトポシドとの併用療法において、カルボプラチンの投与量及び投与方法は、カルボプラチンとして635mg/m2(体表面積)を1日間点滴静注又は400mg/m2(体表面積)を2日間点滴静注し、少なくとも3〜4週間休薬する。これを1クールとし、投与を繰り返す。
なお、投与量及び投与日数は疾患、症状、併用する他の抗悪性腫瘍剤により適宜減ずる。
また、1歳未満もしくは体重10kg未満の小児に対して、投与量には十分配慮すること。
なお、投与量及び投与日数は疾患、症状、併用する他の抗悪性腫瘍剤により適宜減ずる。
また、1歳未満もしくは体重10kg未満の小児に対して、投与量には十分配慮すること。
(2)網膜芽腫に対する他の抗悪性腫瘍剤との併用療法
ビンクリスチン硫酸塩とエトポシドとの併用療法において、カルボプラチンの投与量及び投与方法は、カルボプラチンとして560mg/m2(体表面積)を1日間点滴静注し、少なくとも3〜4週間休薬する。これを1クールとし、投与を繰り返す。
ただし、36ヵ月齢以下の患児にはカルボプラチンを18.6mg/kgとする。
なお、投与量及び投与日数は疾患、症状、併用する他の抗悪性腫瘍剤により適宜減ずる。
ただし、36ヵ月齢以下の患児にはカルボプラチンを18.6mg/kgとする。
なお、投与量及び投与日数は疾患、症状、併用する他の抗悪性腫瘍剤により適宜減ずる。
<子宮体癌>
他の抗悪性腫瘍剤との併用において、通常、成人にはカルボプラチンとして、1日1回AUC5〜6mg・min/mL相当量を投与し、少なくとも3週間休薬する。これを1クールとし、投与を繰り返す。なお、投与量は、患者の状態により適宜減ずる。
<効能共通>
本剤投与時、投与量に応じて250mL以上のブドウ糖注射液又は生理食塩液に混和し、30分以上かけて点滴静注する。
7. 用法及び用量に関連する注意
<子宮体癌>
AUC目標値及び腎機能に基づく本剤の投与量については、関連する学会の最新のガイドライン等を参考に設定すること。
8. 重要な基本的注意
<効能共通>
8.1 骨髄抑制等の重篤な副作用が起こることがあるので、適宜臨床検査(血液検査、肝機能検査、腎機能検査等)を行うなど、患者の状態を十分に観察すること。また、使用が長期間にわたると副作用が強くあらわれ、遷延性に推移することがあるので、投与は慎重に行うこと。[9.1.1、9.1.2、11.1.1、11.1.4、11.1.5、11.1.12参照]
8.2 腫瘍崩壊症候群があらわれることがあるので、血清中電解質濃度及び腎機能検査を行うなど、患者の状態を十分に観察すること。[11.1.18参照]
8.3 本剤の投与にあたってはG-CSF製剤等の適切な使用に関しても考慮すること。
8.4 悪心・嘔吐、食欲不振等の消化器症状が起こることがあるので、患者の状態を十分に観察し、適切な処置を行うこと。
8.5 感染症、出血傾向の発現又は増悪に十分注意すること。
<小児悪性固形腫瘍(神経芽腫・網膜芽腫・肝芽腫・中枢神経系胚細胞腫瘍、再発又は難治性のユーイング肉腫ファミリー腫瘍・腎芽腫)に対する他の抗悪性腫瘍剤との併用療法>
8.6 関連文献(「抗がん剤報告書:カルボプラチン(小児)」等)を熟読すること。
<乳癌>
8.7 関連文献(「医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:カルボプラチン(乳癌)」等)を熟読すること。
<子宮体癌>
8.8 関連文献(「医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:カルボプラチン(子宮体癌)」等)を熟読すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄抑制のある患者
9.1.2 感染症を合併している患者
9.1.3 水痘患者
致命的な全身障害があらわれるおそれがある。
9.2 腎機能障害患者
腎機能が低下しているので、副作用が強くあらわれることがある。
9.2.1 前治療、特にシスプラチンの投与を受け腎機能が低下している患者
初回投与量を適宜減量し、血液検査値に十分注意すること。骨髄抑制が強くあらわれることがある。
9.2.2 小児悪性固形腫瘍(神経芽腫・網膜芽腫・肝芽腫・中枢神経系胚細胞腫瘍、再発又は難治性のユーイング肉腫ファミリー腫瘍・腎芽腫)に対する他の抗悪性腫瘍剤との併用療法において、腎機能が低下している患者
骨髄抑制、聴器障害、腎障害の発現に特に注意し、用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。なお、腎機能の指標としてGFR(Glomerular filtration rate:糸球体ろ過値)等を考慮して、投与量を選択することが望ましい。
9.3 肝機能障害患者
代謝機能等が低下しているので、副作用が強くあらわれることがある。
9.4 生殖能を有する者
9.4.1 小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.4.2 妊娠する可能性のある女性には、本剤投与中及び投与終了後一定期間は適切な避妊をするよう指導すること。[9.5参照]
9.4.3 パートナーが妊娠する可能性のある男性には、本剤投与中及び投与終了後一定期間は適切な避妊をするよう指導すること。細菌を用いた復帰突然変異試験、哺乳類培養細胞を用いた染色体異常試験及びマウスを用いた小核試験において、遺伝毒性が報告されている。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中への移行が報告されている。
9.7 小児等
9.7.1 小児悪性固形腫瘍(神経芽腫・網膜芽腫・肝芽腫・中枢神経系胚細胞腫瘍、再発又は難治性のユーイング肉腫ファミリー腫瘍・腎芽腫)に対する他の抗悪性腫瘍剤との併用療法においては、骨髄抑制、聴器障害、ファンコニー症候群等の腎障害の発現に特に注意し、用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。
9.7.2 外国で、本剤を高用量で他の聴器毒性を有する薬剤と併用した場合、臨床上有意な聴力低下が小児患者に発現するとの報告がある。
9.8 高齢者
用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。一般に生理機能(骨髄機能、肝機能、腎機能等)が低下している。
10. 相互作用
10.2 併用注意
| 放射線照射 | 骨髄抑制等の副作用が増強することがあるので、併用療法を行う場合には、患者の状態を観察しながら、減量するなど用量に注意すること。 | ともに骨髄抑制等の副作用を有する。 |
| 放射線照射 | 胸部への放射線照射を併用した場合に、重篤な食道炎又は肺臓炎が発現したとの報告がある。併用する場合には、患者の状態に注意し、食道炎や肺陰影等が出現した場合には、本剤の投与及び放射線照射を直ちに中止し、適切な処置を行うこと。 | 機序は不明であるが、動物試験(マウス)で本剤による放射線感受性増加が認められている。 |
| 放射線照射 | 本剤と放射線照射の併用により、肝中心静脈閉塞症(VOD)が発症したとの報告があるので、十分注意すること1)。 | 機序不明 |
| 抗悪性腫瘍剤 | 骨髄抑制等の副作用が増強することがあるので、併用療法を行う場合には、患者の状態を観察しながら、減量するなど用量に注意すること。 | ともに骨髄抑制等の副作用を有する。 |
| 抗悪性腫瘍剤 | 本剤と他の抗悪性腫瘍剤の併用により、肝中心静脈閉塞症(VOD)が発症したとの報告があるので、十分注意すること1)。 | 機序不明 |
| 腎毒性及び聴器毒性を有する薬剤 アミノグリコシド系抗生物質等 | 腎障害及び聴器障害が増強することがあるので、併用療法を行う場合には、慎重に投与すること。 | ともに腎障害及び聴器障害を有する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制
11.1.2 ショック、アナフィラキシー(0.1%未満)
チアノーゼ、呼吸困難、胸内苦悶、血圧低下、気管支痙攣等があらわれた場合には投与を中止し、適切な処置を行うこと。なお、本剤の投与回数を重ねると、ショック、アナフィラキシーの発現頻度が高くなる傾向もみられる。[15.1.3参照]
11.1.3 間質性肺炎(0.1%)
発熱、咳嗽、呼吸困難、胸部X線異常等を伴う間質性肺炎があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.4 急性腎障害(0.1%未満)、ファンコニー症候群(頻度不明)
急性腎障害、ファンコニー症候群等があらわれることがあるので、観察を十分に行い、BUN、血清クレアチニン、クレアチニン・クリアランス値等に異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.1参照]
11.1.5 肝不全、肝機能障害、黄疸(いずれも頻度不明)[8.1参照]
11.1.6 消化管壊死、消化管穿孔、消化管出血、消化管潰瘍(いずれも頻度不明)
11.1.7 出血性腸炎、偽膜性大腸炎(頻度不明)
出血性腸炎、偽膜性大腸炎等があらわれることがあるので、観察を十分に行い、激しい腹痛・下痢等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.8 麻痺性イレウス(0.1%未満)
腸管麻痺(食欲不振、悪心・嘔吐、著しい便秘、腹痛、腹部の膨満あるいは弛緩及び腸内容物のうっ滞等)を来し、麻痺性イレウスに移行することがあるので、腸管麻痺があらわれた場合には投与を中止し、腸管減圧法等の適切な処置を行うこと。
11.1.9 脳梗塞(0.1%未満)、肺梗塞(頻度不明)
11.1.10 血栓・塞栓症(頻度不明)
血栓・塞栓症(肺塞栓、脳血栓、その他の動脈又は静脈血栓症等)があらわれることがある。
11.1.11 心筋梗塞、うっ血性心不全(頻度不明)
11.1.12 溶血性尿毒症症候群(頻度不明)
血小板減少、溶血性貧血、腎不全を主徴とする溶血性尿毒症症候群があらわれることがある。[8.1参照]
11.1.13 急性呼吸窮迫症候群(頻度不明)
急速に進行する呼吸困難、低酸素症、両側性びまん性肺浸潤影等の胸部X線異常等が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.14 播種性血管内凝固症候群(DIC)(頻度不明)
血小板数、血清FDP値、血漿フィブリノゲン濃度等の血液検査に異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.15 急性膵炎(頻度不明)
血清アミラーゼ値、血清リパーゼ値等に異常が認められた場合には投与を中止すること。
11.1.16 難聴(0.1%未満)
難聴、耳鳴等があらわれることがある。
11.1.17 白質脳症(可逆性後白質脳症症候群を含む)(頻度不明)
歩行時のふらつき、舌のもつれ、痙攣、頭痛、錯乱、視覚障害等が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.18 腫瘍崩壊症候群(頻度不明)
異常が認められた場合には投与を中止し、適切な処置(生理食塩液、高尿酸血症治療剤等の投与、透析等)を行うとともに、症状が回復するまで患者の状態を十分に観察すること。[8.2参照]
11.1.19 うっ血乳頭、球後視神経炎、皮質盲(頻度不明)
うっ血乳頭、球後視神経炎、皮質盲等の視覚障害があらわれることがある。
11.1.20 溶血性貧血(頻度不明)
クームス陽性の溶血性貧血があらわれることがある。
「重大な副作用」及び「その他の副作用」の発現頻度は、承認時までの国内臨床試験620例に製造販売後の使用成績調査5,598例を含めた総症例6,218例による
11.2 その他の副作用
| 10%以上 | 1%〜10%未満 | 1%未満 | 頻度不明 | |
| 消化器 | 悪心・嘔吐注1)(50.5%)、食欲不振(45.4%) | 下痢、口内炎、腹痛、便秘 | 口渇 | |
| 腎臓 | 血尿、蛋白尿 | 乏尿 | ||
| 過敏症注2) | 発疹 | そう痒感 | 蕁麻疹 | |
| 精神神経系 | 末梢神経障害(しびれ等)、頭痛 | 耳鳴、聴力低下、視力障害、眩暈、痙攣、異常感覚、味覚異常、神経過敏、不安、不眠 | ||
| 肝臓 | ALT上昇(10.2%) | AST上昇、Al-P上昇、ビリルビン上昇、LDH上昇、γ-GTP上昇 | ||
| 循環器 | 心電図異常(期外収縮)、心悸亢進、血圧上昇、血圧低下、不整脈(頻脈、徐脈、心房細動、心房粗動、房室ブロック) | |||
| 電解質 | 血清ナトリウム、カリウム、クロール、カルシウム、リン、マグネシウム等の異常 | 抗利尿ホルモン分泌異常症候群 | ||
| 皮膚 | 脱毛(18.3%) | 色素沈着、爪の変色、皮膚疾患 | ||
| その他 | 全身倦怠感(18.6%) | 発熱、浮腫 | 疼痛、潮紅、ほてり、胸部不快感、吃逆、注射部位反応(発赤、腫脹、疼痛、壊死、硬結等)、低蛋白血症 | 無力症、尿酸上昇、悪寒、脱水、体重減少、アルブミン低下、呼吸困難 |
13. 過量投与
13.1 症状
本剤を高用量で投与した際に、失明を含む視覚障害があらわれたとの報告がある。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は、イオウを含むアミノ酸(メチオニン及びシスチン)輸液中で分解が起こるため、これらのアミノ酸輸液との配合を避けること。
14.1.2 本剤は、アルミニウムと反応して沈殿物を形成し、活性が低下するので、使用にあたってはアルミニウムを含む医療器具を用いないこと。[14.2.1参照]
14.1.3 本剤は、錯化合物であるので、他の抗悪性腫瘍剤とは混注しないこと。
14.1.4 本剤は細胞毒性を有するため、調製時には手袋を着用することが望ましい。皮膚に薬液が付着した場合は、直ちに多量の流水でよく洗い流すこと。
14.1.5 本剤は輸液と混和した後、できるだけ速やかに使用すること。
14.2 薬剤投与時の注意
14.2.1 使用にあたってはアルミニウムを含む医療器具を用いないこと。[14.1.2参照]
14.2.2 本剤は、生理食塩液等の無機塩類(NaCl、KCl、CaCl2等)を含有する輸液に混和するときは、8時間以内に投与を終了すること。
14.2.3 静脈内投与に際し、薬液が血管外に漏れると、注射部位に硬結・壊死等を起こすことがあるので、薬液が血管外に漏れないように慎重に投与すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤は、シスプラチン投与で効果が認められなかった症例に対しては、有効性が認められていない。
15.1.2 本剤と他の抗悪性腫瘍剤の併用により、急性白血病(前白血病相を伴う場合もある)、骨髄異形成症候群(MDS)が発生したとの報告がある。
15.1.3 本剤の投与回数を重ねると、ショック、アナフィラキシーの発現頻度が高くなる傾向がみられ、特に白金製剤の投与回数が8回を超えるとその傾向は顕著となるとの報告がある。[11.1.2参照]
15.2 非臨床試験に基づく情報
15.2.1 本剤は、細菌及びヒトリンパ芽球細胞に対し変異原性が認められており、また、ハムスターに対する染色体異常誘起性が認められている。
15.2.2 ラットの慢性毒性試験(静脈内投与)により耳下腺及び乳腺の腺癌、前立腺の前癌病変が発生したとの報告がある。
16. 薬物動態
16.1 血中濃度
がん患者にカルボプラチン75〜450mg/m2注)を1回点滴静注したときの血中濃度の推移は3相性の減衰曲線を示し、α相の半減期は0.16〜0.32時間、β相は1.29〜1.69時間、γ相は22〜32時間であり、大部分のカルボプラチンは投与後速やかに、また、時間の経過とともに緩慢に血中より消失した2)3)4)。
注)本剤の承認された用量は300〜400mg/m2である。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験成績
臨床第II相試験(カルボプラチン単独療法)による疾患別奏効率(寛解率)は次のとおりである。
17.1.2 海外臨床試験成績
海外における非小細胞肺癌を対象としたカルボプラチン単独療法による奏効率及び生存期間は次のとおりである。
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍作用
19. 有効成分に関する理化学的知見
19.1. カルボプラチン
20. 取扱い上の注意
20.1 本剤は、光及び熱により分解するので、直射日光や高温を避け、外箱開封後は遮光して保存すること。
20.2 冷蔵庫保存では、結晶が析出することがある。
22. 包装
<カルボプラチン注射液50mg「日医工」>
5mL×1バイアル
<カルボプラチン注射液150mg「日医工」>
15mL×1バイアル
<カルボプラチン注射液450mg「日医工」>
45mL×1バイアル
23. 主要文献
- Pein F.,et al., J.Clin.Oncol., 12 (5), 931-936, (1994) »PubMed
- 木村禧代二 他, Oncologia., 21 (4), 88-94, (1988)
- 藤原恵一 他, 癌と化学療法, 15 (6), 1943-1948, (1988) »PubMed
- 佐々木康綱 他, Chemotherapy., 37 (3), 280-284, (1989) »DOI
- 犬山征夫 他, 癌と化学療法, 15 (7), 2131-2138, (1988) »PubMed
- 木村禧代二 他, 癌と化学療法, 15 (7), 2139-2144, (1988) »PubMed
- 小松彦太郎 他, 癌と化学療法, 15 (8), 2313-2318, (1988) »PubMed
- Tamura T.,et al., Jpn.J.Clin.Oncol., 18 (1), 27-32, (1988) »PubMed
- 木村禧代二 他, 癌と化学療法, 15 (9), 2781-2785, (1988) »PubMed
- 新島端夫 他, 癌と化学療法, 15 (8), 2305-2311, (1988) »PubMed
- 加藤俊 他, 癌と化学療法, 15 (8), 2291-2296, (1988) »PubMed
- 野田起一郎 他, 癌と化学療法, 15 (11), 3067-3072, (1988) »PubMed
- 内藤和行 他, 癌と化学療法, 15 (7), 2145-2151, (1988) »PubMed
- 犬山征夫 他, 耳鼻と臨床, 34 (6), 1511-1519, (1988) »DOI
- 加藤俊 他, 癌と化学療法, 15 (8), 2297-2304, (1988) »PubMed
- Kreisman H.,et al., Cancer Treat.Rep., 71 (11), 1049-1052, (1987) »PubMed
- Kramer B.S.,et al., Am.J.Clin.Oncol., 11 (6), 643-645, (1988) »PubMed
- Bonomi P.D.,et al., J.Clin.Oncol., 7 (11), 1602-1613, (1989) »PubMed
- Klastersky J.,et al., J.Clin.Oncol., 8 (9), 1556-1562, (1990) »PubMed
- Belani C.P.,et al., Ann.Oncol., 16 (7), 1069-1075, (2005) »PubMed
- 吉谷徳夫 他, 日本産科婦人科学会雑誌, 41 (1), 7-14, (1989)
- Micetich K.C.,et al., Cancer Res., 45 (9), 4043-4047, (1985) »PubMed
- Knox R.J.,et al., Cancer Res., 46 (4), 1972-1979, (1986)
- Rose W.C.,et al., Cancer Treat.Revi., 12 (Suppl.A), 1-19, (1985)
- Harrap K.R.,et al., Cisplatin,Current Status and New Developments. Prestayko A.W.,et al.ed., 193-212, (1980), (Academic Press.)
- Brader W.T.,et al., Cisplatin,Current Status and New Developments. Prestayko A.W.,et al.ed., 171-182, (1980), (Academic Press.)
- Rose W.C.,et al., Cancer Treat.Rep., 66 (1), 135-146, (1982) »PubMed
- Lee F.H.,et al., Cancer Treat.Revi., 10 (1), 39-51, (1983) »PubMed
- 善積昇 他, Human Cell., 1 (3), 301-307, (1988) »PubMed
- 菊池義公 他, 癌と化学療法, 15 (10), 2895-2898, (1988) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工株式会社
富山市総曲輪1丁目6番21