医薬品情報
| 総称名 | デパス |
|---|---|
| 一般名 | エチゾラム |
| 欧文一般名 | Etizolam |
| 薬効分類名 | 精神安定剤 |
| 薬効分類番号 | 1179 |
| ATCコード | N05BA19 |
| KEGG DRUG |
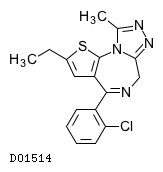
D01514
エチゾラム
|
| KEGG DGROUP |
DG03202
睡眠薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第2版 D51)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 25.保険給付上の注意 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| デパス錠0.25mg | DEPAS TABLETS | 田辺ファーマ | 1179025F3029 | 9.5円/錠 | 第三種向精神薬, 処方箋医薬品注) |
| デパス錠0.5mg | DEPAS TABLETS | 田辺ファーマ | 1179025F1026 | 9.5円/錠 | 第三種向精神薬, 処方箋医薬品注) |
| デパス錠1mg | DEPAS TABLETS | 田辺ファーマ | 1179025F2022 | 10.4円/錠 | 第三種向精神薬, 処方箋医薬品注) |
| デパス細粒1% | DEPAS FINE GRANULES | 田辺ファーマ | 1179025C1054 | 34円/g | 第三種向精神薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 急性閉塞隅角緑内障の患者[抗コリン作用により眼圧が上昇し、症状を悪化させることがある。]
2.2 重症筋無力症の患者[筋弛緩作用により、症状を悪化させるおそれがある。]
4. 効能または効果
○神経症における不安・緊張・抑うつ・神経衰弱症状・睡眠障害
○うつ病における不安・緊張・睡眠障害
○心身症(高血圧症、胃・十二指腸潰瘍)における身体症候ならびに不安・緊張・抑うつ・睡眠障害
○統合失調症における睡眠障害
○下記疾患における不安・緊張・抑うつおよび筋緊張
頸椎症、腰痛症、筋収縮性頭痛
6. 用法及び用量
<神経症、うつ病>
通常、成人にはエチゾラムとして1日3mgを3回に分けて経口投与する。
<心身症、頸椎症、腰痛症、筋収縮性頭痛>
通常、成人にはエチゾラムとして1日1.5mgを3回に分けて経口投与する。
<睡眠障害>
通常、成人にはエチゾラムとして1日1〜3mgを就寝前に1回経口投与する。
なお、いずれの場合も年齢、症状により適宜増減するが、高齢者には、エチゾラムとして1日1.5mgまでとする。
8. 重要な基本的注意
8.1 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
8.2 連用により薬物依存を生じることがあるので、漫然とした継続投与による長期使用を避けること。本剤の投与を継続する場合には、治療上の必要性を十分に検討すること。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心障害のある患者
血圧低下があらわれるおそれがあり、症状の悪化につながるおそれがある。
9.1.2 脳に器質的障害のある患者
作用が強くあらわれるおそれがある。
9.1.3 衰弱患者
作用が強くあらわれるおそれがある。
9.1.4 中等度呼吸障害又は重篤な呼吸障害(呼吸不全)のある患者
呼吸機能が高度に低下している患者に投与した場合、炭酸ガスナルコーシスを起こすことがある。[11.1.2参照]
9.2 腎機能障害患者
作用が強くあらわれるおそれがある。
9.3 肝機能障害患者
作用が強くあらわれるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.5.1 動物実験により催奇形作用が報告されており、また、妊娠中に他のベンゾジアゼピン系薬剤(ジアゼパム)の投与を受けた患者の中に奇形を有する児等の障害児を出産した例が対照群と比較して有意に多いとの疫学的調査報告がある。
9.5.2 ベンゾジアゼピン系薬剤で新生児に哺乳困難、嘔吐、活動低下、筋緊張低下、過緊張、嗜眠、傾眠、呼吸抑制・無呼吸、チアノーゼ、易刺激性、神経過敏、振戦、低体温、頻脈等を起こすことが報告されている。なお、これらの症状は、離脱症状あるいは新生児仮死として報告される場合もある。また、ベンゾジアゼピン系薬剤で新生児に黄疸の増強を起こすことが報告されている。なお、妊娠後期に本剤を連用していた患者から出生した新生児に血清CK上昇があらわれることがある。
9.5.3 分娩前に連用した場合、出産後新生児に離脱症状があらわれることが、ベンゾジアゼピン系薬剤で報告されている。
9.6 授乳婦
授乳を避けさせること。ヒト母乳中へ移行し、哺乳中の児に体重増加不良があらわれることがある。また、他のベンゾジアゼピン系薬剤(ジアゼパム)で哺乳中の児に嗜眠、体重減少等を起こすことが報告されており、また黄疸を増強する可能性がある。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
少量から投与を開始するなど慎重に投与すること。運動失調等の副作用が発現しやすい。
10. 相互作用
相互作用序文
本剤は、肝代謝酵素CYP2C9及びCYP3A4で代謝される。[16.4.3参照]
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| 中枢神経抑制剤 フェノチアジン誘導体 バルビツール酸誘導体等 | 眠気、血圧低下、運動失調、意識障害などを起こすおそれがある。 | 中枢神経抑制剤との併用で相加的な増強作用が考えられる。 |
| MAO阻害剤 | 過鎮静、昏睡、痙攣発作、興奮などを起こすおそれがある。 | MAO阻害剤が本剤の肝での代謝を抑制し、半減期を延長し、血中濃度を上昇させるため作用が増強されることが考えられる。 |
| フルボキサミンマレイン酸塩 | 本剤の用量を減量するなど、注意して投与する。 | フルボキサミンマレイン酸塩が本剤の肝での代謝を阻害し、血中濃度を上昇させるため本剤の作用が増強されることがある。 |
| アルコール 飲酒 | 精神機能、知覚・運動機能の低下を起こすおそれがある。 | エタノールと本剤は相加的な中枢抑制作用を示すことが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 依存性(頻度不明)
連用により薬物依存を生じることがあるので、観察を十分に行い、用量及び使用期間に注意し慎重に投与すること。また、連用中における投与量の急激な減少ないし投与の中止により、痙攣発作、せん妄、振戦、不眠、不安、幻覚、妄想等の離脱症状があらわれることがあるので、投与を中止する場合には、徐々に減量するなど慎重に行うこと。[8.2参照]
11.1.2 呼吸抑制、炭酸ガスナルコーシス(いずれも頻度不明)
呼吸機能が高度に低下している患者に投与した場合、炭酸ガスナルコーシスを起こすことがあるので、このような場合には気道を確保し、換気をはかるなど適切な処置を行うこと。[9.1.4参照]
11.1.3 悪性症候群(頻度不明)
本剤の投与、又は抗精神病薬等との併用、あるいは本剤の急激な減量・中止により悪性症候群があらわれることがある。発熱、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗、白血球の増加、血清CKの上昇等があらわれた場合には、体冷却、水分補給等の全身管理とともに適切な処置を行うこと。また、本症候群発症時にはミオグロビン尿を伴う腎機能の低下があらわれることがある。
11.1.4 横紋筋融解症(頻度不明)
筋肉痛、脱力感、血清CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがあるので、このような場合には、投与を中止し、適切な処置を行うこと。
11.1.5 間質性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、肺音の異常(捻髪音)等が認められた場合には投与を中止し、速やかに胸部X線等の検査を実施し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.6 肝機能障害、黄疸(いずれも頻度不明)
肝機能障害(AST、ALT、γ-GTP、LDH、ALP、ビリルビン上昇等)、黄疸があらわれることがある。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 精神神経系 | 眠気(13.2%)、ふらつき | めまい、歩行失調、頭痛・頭重、言語障害、不眠、酩酊感、焦燥 | 興奮、振戦、眼症状(霧視、調節障害) | 健忘、刺激興奮、錯乱 |
| 呼吸器 | 呼吸困難感 | |||
| 循環器 | 動悸、立ちくらみ | |||
| 消化器 | 口渇、悪心・嘔気、食欲不振、胃・腹部不快感、腹痛、便秘、下痢 | 嘔吐 | ||
| 過敏症 | 発疹 | 蕁麻疹 | 紅斑、そう痒感 | |
| 骨格筋 | 倦怠感、脱力感、易疲労感、筋弛緩等の筋緊張低下症状 | |||
| その他 | 発汗、排尿障害 | 浮腫、鼻閉 | 乳汁分泌、女性化乳房、高プロラクチン血症、眼瞼痙攣注) |
13. 過量投与
13.1 症状
運動失調、低血圧、呼吸抑制、意識障害などがあらわれることがある。
13.2 処置
本剤の過量投与が明白又は疑われた場合の処置としてフルマゼニル(ベンゾジアゼピン受容体拮抗剤)を投与する場合には、使用前にフルマゼニルの使用上の注意を必ず読むこと。なお、投与した薬剤が特定されないままにフルマゼニルを投与された患者で、新たに本剤を投与する場合、本剤の鎮静・抗痙攣作用が変化、遅延するおそれがある。
14. 適用上の注意
14.1 薬剤交付時の注意
<錠>
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人10例に本剤2mgを食後30分に単回経口投与した場合、吸収は良好で、最高血漿中濃度は約3時間後に得られ、血漿中濃度の半減期は約6時間であった1)。
| tmax(h) | Cmax(ng/mL) | t1/2(h) | AUC0-36h(ng・h/mL) |
| 3.3±0.3 | 25±1.5 | 6.3±0.8 | 284.3±40.4 |
16.1.2 反復投与
神経症の例に本剤1mg錠を1日3回食後30分から1時間に反復経口投与した場合、投与開始後7日、14日及び28日目の血漿中濃度はほぼ等しかった2)。
16.2 吸収
エチゾラムは消化管から比較的速やかに吸収される。
16.3 分布
16.3.1 組織への移行性
ラットに14C-エチゾラムを経口投与した場合、肝臓では2時間後、脳及びその他の臓器では0.5時間後に放射能濃度が最高となり、24時間後には、肝臓に最高濃度の1/10程度の放射能が認められたほかは、各組織中からほぼ完全に消失した。また、最長3週間まで反復投与しても、肝臓、腎臓、血清、脳の濃度は、単回投与の場合と比較して著しい上昇はなく、体内蓄積性は少ないと考えられる3)。
16.3.2 蛋白結合率
93%4)
16.4 代謝
16.4.1 代謝部位
肝臓5)
16.4.2 代謝経路
健康成人に本剤を経口投与した場合の尿中主代謝物は8位エチル基のα水酸化体(MIII)及びそのグルクロン酸抱合体、1位メチル基の水酸化体(MVI)のグルクロン酸抱合体である5)。
16.4.3 チトクロームP450の分子種
16.5 排泄
投与量の約53%が尿中に排泄され、そのうち主なものはMIII及びそのグルクロン酸抱合体、MVIのグルクロン酸抱合体で未変化体は少なかった5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
二重盲検比較試験を含む1,608例について実施された臨床試験の概要は次のとおりである。(有効率は“有効と認められるもの”以上を集計)
神経症、心身症(高血圧症、胃・十二指腸潰瘍)並びに統合失調症における睡眠障害に対しては二重盲検比較試験によって本剤の有用性が確認されている。
18. 薬効薬理
18.1 作用機序
視床下部及び大脳辺縁系、特に扁桃核のベンゾジアゼピン受容体に作用し、不安・緊張などの情動異常を改善する。
18.2 ヒトでの作用
18.2.1 抗不安作用
18.2.2 鎮静・催眠作用
健康成人男性での終夜睡眠脳波では、全睡眠時間を有意に延長させたが、徐波睡眠には影響を及ぼさなかった。また、REM睡眠を抑制したが、REM反跳現象は認められなかった16)。
18.3 動物での作用
18.3.1 抗不安作用
(1)臨床上抗不安作用との相関が高いといわれる抗ペンチレンテトラゾール作用(マウス)、及び視床下部刺激による指向性攻撃反応の抑制作用(ネコ)が、ジアゼパムの5〜6倍強力である17)。
(2)マウス、ラットにおけるin vivoの実験で、ストレス負荷による脳内アミン(ドパミン、ノルアドレナリン、セロトニン)の代謝回転の亢進を強く抑制する18)。
(3)ラットにおけるin vitroの実験で、脳内ベンゾジアゼピン受容体に対して高い親和性を示す19)。
18.3.2 鎮静・催眠作用
(1)家兎の自発脳波では、ジアゼパムの1/4量(0.16mg/kg)から著明な徐波化を示す17)。
18.3.3 筋緊張緩解作用
ラットにおける実験で、ジアゼパムと異なり、γ-固縮(Sherrington型去脳)のみでなく、α-固縮(Pollock-Davis型虚血性去脳)に対しても強い筋緊張緩解作用を示す21)。
18.3.4 抗うつ作用
ラットにおけるin vivoの実験で、三環系抗うつ剤イミプラミンと同様に脳内ノルアドレナリンの再取込みを抑制する18)。
18.3.5 心身安定化作用
19. 有効成分に関する理化学的知見
19.1. エチゾラム
20. 取扱い上の注意
外箱又は容器開封後は遮光保存すること。
22. 包装
<デパス錠0.25mg>
100錠[10錠(PTP)×10]
<デパス錠0.5mg>
100錠[10錠(PTP)×10]、500錠[10錠(PTP)×50]、1,000錠[10錠(PTP)×100]、1,000錠[バラ]
<デパス錠1mg>
100錠[10錠(PTP)×10]、500錠[10錠(PTP)×50]
<デパス細粒1%>
100g
23. 主要文献
- 田辺ファーマ(株):エチゾラムの薬物動態に関わる資料1(社内資料)
- 田辺ファーマ(株):エチゾラムの薬物動態に関わる資料2(社内資料)
- Kato Y,et al., Arzneimittelforschung., 28 (7), 1170-1173, (1978) »PubMed
- 田辺ファーマ(株):エチゾラムの薬物動態に関わる資料5(社内資料)
- 田辺ファーマ(株):エチゾラムの薬物動態に関わる資料3(社内資料)
- 田辺ファーマ(株):エチゾラムの薬物動態に関わる資料4(社内資料)
- 葉田 裕, 臨床精神医学, 8 (1), 111-131, (1979)
- 山内育郎,他, 新薬と臨床, 28 (7), 1135-1145, (1979)
- 鈴木仁一,他, 臨床と研究, 56 (10), 3425-3442, (1979)
- 並木正義,他, 臨床と研究, 59 (12), 4101-4112, (1982)
- 鈴木仁一,他, 臨床と研究, 59 (11), 3797-3808, (1982)
- 室 捷之,他, 新薬と臨床, 27 (8), 1407-1422, (1978)
- 小島卓也,他, 臨床精神医学, 12 (10), 1293-1314, (1983)
- Itil TM,et al., Psychopharmacol Bull., 18 (4), 165-172, (1982) »PubMed
- 斎藤正己,他, 脳波と筋電図, 4 (1), 27-40, (1976)
- Nakazawa Y,et al., Psychopharmacologia., 44 (2), 165-171, (1975) »PubMed
- Tsumagari T,et al., Arzneimittelforschung., 28 (7), 1158-1164, (1978) »PubMed
- Setoguchi M,et al., Arzneimittelforschung., 28 (7), 1165-1169, (1978) »PubMed
- 田辺ファーマ(株):エチゾラムの薬効薬理に関わる資料1(社内資料)
- 田辺ファーマ(株):エチゾラムの薬効薬理に関わる資料2(社内資料)
- 田辺ファーマ(株):エチゾラムの薬効薬理に関わる資料5(社内資料)
- 田辺ファーマ(株):エチゾラムの薬効薬理に関わる資料3(社内資料)
- 田辺ファーマ(株):エチゾラムの薬効薬理に関わる資料4(社内資料)
24. 文献請求先及び問い合わせ先
文献請求先
田辺ファーマ株式会社
くすり相談センター
〒541-8505
大阪市中央区道修町3-2-10
電話:0120-753-280
製品情報問い合わせ先
田辺ファーマ株式会社
くすり相談センター
〒541-8505
大阪市中央区道修町3-2-10
電話:0120-753-280
25. 保険給付上の注意
本剤は厚生労働省告示第365号(平成28年10月13日付)に基づき、1回30日分を限度として投薬する。
26. 製造販売業者等
26.1 製造販売元
田辺ファーマ株式会社
大阪市中央区道修町3-2-10