医薬品情報
| 総称名 | トービイ |
|---|---|
| 一般名 | トブラマイシン |
| 欧文一般名 | Tobramycin |
| 製剤名 | トブラマイシン吸入液 |
| 薬効分類名 | アミノグリコシド系抗生物質製剤 |
| 薬効分類番号 | 6123 |
| ATCコード | J01GB01 |
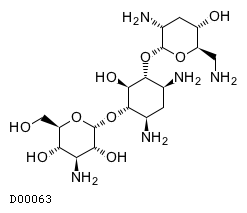
| KEGG DRUG |
D00063
トブラマイシン
|
| KEGG DGROUP |
DG01447
アミノグリコシド系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| トービイ吸入液300mg | TOBI Inhalation solution | ヴィアトリス製薬 | 6123700G1026 | 9045円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分並びに他のアミノグリコシド系抗生物質又はバシトラシンに対し過敏症の既往歴のある患者
4. 効能または効果
嚢胞性線維症における緑膿菌による呼吸器感染に伴う症状の改善
5. 効能または効果に関連する注意
1秒量(FEV1)が予測正常値に対し<25%又は>75%の患者、バークホルデリア・セパシア感染を合併している患者における有効性及び安全性は確立していない。
6. 用法及び用量
1回300mgを1日2回28日間噴霧吸入する。その後28日間休薬する。これを1サイクルとして投与を繰り返す。
7. 用法及び用量に関連する注意
7.1 可能な限り12時間間隔で投与し、少なくとも投与間隔を6時間以上あけること。
7.2 本剤の投与には、PARI LCプラスネブライザー及びコンプレッサーを使用すること。なお、コンプレッサーは、PARI LCプラスネブライザーに装着した際に、流量4〜6L/分又は圧力110〜217kPaが得られるコンプレッサーを使用すること。外国の臨床試験においては、PARI LCプラスネブライザーが使用されており、これ以外のネブライザーを使用した場合の有効性及び安全性は確認されていない。
8. 重要な基本的注意
8.1 吸入薬の場合、薬剤の吸入により気管支痙攣が誘発される可能性があるので、異常が認められた場合には投与を中止し、適切な処置を行うこと。
8.2 注射用アミノグリコシド系抗生物質製剤と併用する場合には、トブラマイシンの血清中トラフ値をモニタリングすることが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 第8脳神経障害のある患者や第8脳神経障害が疑われる患者又は発現する可能性が高い患者
聴覚検査を実施することが望ましい。第8脳神経障害が発現又は増悪するおそれがある。[11.1.2参照]
9.1.2 パーキンソン病や重症筋無力症等の神経筋障害のある患者又はこれらの障害が疑われる患者
アミノグリコシド系抗生物質製剤の神経筋機能に対するクラーレ様の作用により、筋力低下が増悪することがある。
9.1.3 気管支拡張薬等の吸入及び肺理学療法を必要とする患者
本剤の呼吸器における作用を確実にするために、これらの治療を行った後に本剤を投与することが望ましい。
9.2 腎機能障害患者
9.2.1 腎機能障害のある患者又は腎機能障害が疑われる患者
高い血中濃度が持続し、腎障害が悪化するおそれがあり、また、第8脳神経障害等の副作用が強くあらわれるおそれがある。[11.1.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊婦に投与すると新生児に第8脳神経障害があらわれるおそれがある。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。注射剤において、乳汁中へ移行することが報告されている。
9.7 小児等
6歳未満の小児を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| 腎毒性及び聴器毒性を有する薬剤 バンコマイシン エンビオマイシン 白金含有抗悪性腫瘍剤 シスプラチン カルボプラチン ネダプラチン等 | 腎障害及び聴器障害が発現又は悪化するおそれがある。 | 機序は不明であるが、共に腎毒性、聴器毒性を有する。 |
| ループ利尿剤 フロセミド等 マンニトール | 腎障害及び聴器障害が発現又は悪化するおそれがある。 | 機序は明確ではないが、併用によりアミノグリコシド系抗生物質の血中濃度の上昇、腎への蓄積が起こるという報告がある。 |
| 腎毒性を有する薬剤 シクロスポリン タクロリムス水和物 アムホテリシンB セファロチンナトリウム ポリミキシンB等 | 腎障害が発現又は悪化するおそれがある。 | 機序は不明であるが、共に腎毒性を有する。 |
| 筋弛緩剤 A型ボツリヌス毒素等 | 呼吸抑制があらわれるおそれがある。 | 共に神経筋接合部の遮断作用を有し、併用によりその作用が増強される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 急性腎障害(頻度不明)
急性腎障害等の重篤な腎障害があらわれることがある。症状が認められた場合には、血中濃度が2μg/mL以下に低下するまで本剤の投与を中止すること。[9.2.1参照]
11.1.2 第8脳神経障害(頻度不明)
眩暈、耳鳴、難聴等の第8脳神経障害があらわれることがある。症状が認められた場合には、血中濃度が2μg/mL以下に低下するまで本剤の投与を中止すること。[9.1.1参照]
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 頻度不明 | |
| 皮膚 | 過敏症状、そう痒症、蕁麻疹、発疹 | ||
| 呼吸器 | ラ音、発声障害、鼻炎、肺機能低下、咳嗽、喀血、喀痰増加 | 変色痰、気管支痙攣、喘息、呼吸困難 | 口腔咽頭痛 |
| 筋骨格系 | 筋肉痛、背部痛 | ||
| 感染症 | 咽頭炎 | 喉頭炎 | |
| 神経系 | 味覚異常 | 頭痛、浮動性めまい | 失声症 |
| 全身症状 | 胸痛、無力症 | けん怠感、発熱、疼痛 | |
| 消化器 | 腹痛、悪心、嘔吐、食欲減退 |
13. 過量投与
13.1 症状
本剤のヒトにおける最大耐量は確立されていない。本剤の吸入投与による過量投与時にみられる主な症状として重度の嗄声が考えられる。
13.2 処置
急性中毒が認められた場合には、本剤の投与を中止し適切な処置を行うとともに、腎機能検査を実施すること。また、血中濃度のモニタリングが有用と考えられる。本剤の除去には、血液透析が有用であることが示唆されたとの報告がある。
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 アンプルを使用直前に開封し、1回で使い切ること。開封後のアンプルを保管して再利用しないこと。
14.1.2 座位もしくは直立の姿勢で、ネブライザーのマウスピースを歯でくわえて舌の上に置き、通常呼吸をしている状態で吸入する。
14.1.3 1アンプル全量を、PARI LCプラスネブライザーに移し、コンプレッサーを用いて約15分間かけて吸入する。
14.1.4 本剤の希釈又は他剤との混合は避けること。
15. その他の注意
15.2 非臨床試験に基づく情報
ラットに連日長期間吸入投与した試験において、呼吸器系に本薬の刺激性に起因すると考えられる軽度の変性、炎症又は過形成がみられた。より長期間投与したラットの試験では、低用量から過形成の発現が確認された。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
16.1.2 反復投与
嚢胞性線維症患者に本剤300mg1日2回、4週間反復噴霧吸入投与したのち4週間休薬を1サイクルとし、3回繰り返したとき、初回噴霧吸入投与後1時間の血清中トブラマイシン濃度の平均値(n=257)は0.95μg/mL(範囲:定量下限値(0.18μg/mL)未満〜3.62μg/mL)であった。また、最終噴霧吸入投与後1時間の血清中トブラマイシン濃度の平均値(n=222)は1.05μg/mL(範囲:定量下限値未満〜3.41μg/mL)であった3)(外国人のデータ)。
16.2 吸収
16.2.1 吸入投与
16.2.2 喀痰中濃度
(1)単回投与
嚢胞性線維症患者20例に本剤300mgを単回噴霧吸入投与したとき、喀痰中のトブラマイシンは投与開始後0.5時間(最初の採取時点)で最高濃度を示した。喀痰中からの平均消失半減期は1.7時間であった2)(外国人のデータ)。
単回噴霧吸入投与時の平均喀痰中トブラマイシン濃度推移(平均値+標準偏差、n=18〜20)
| Cmax(μg/g) | Tmax(h) | AUC0-12h(μg・h/g) | AUCinf(μg・h/g) | T1/2(h) |
| 737±1,028 | ※0.5(0.5〜2) | 974±1,143 | 1,302±1,127 | 1.7±1.6 |
(2)反復投与
嚢胞性線維症患者に本剤300mg1日2回、4週間反復噴霧吸入投与したのち4週間休薬を1サイクルとし、3回繰り返したとき、初回噴霧吸入投与後10分の喀痰中トブラマイシン濃度の平均値(n=240)は1,237μg/g(範囲:35〜7,414μg/g)であった。最終噴霧吸入投与後10分の喀痰中トブラマイシン濃度の平均値(n=201)は1,154μg/g(範囲:定量下限値(20μg/g)未満〜8,085μg/g)であった。喀痰中トブラマイシン濃度のばらつきは大きかった3)(外国人のデータ)。
16.3 分布
16.4 代謝
トブラマイシンは代謝を受けない5)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外第III相試験
(1)プラセボ対照二重盲検比較試験として緑膿菌が検出された嚢胞性線維症患者223例(トブラマイシン群109例/プラセボ群114例)を対象に、トブラマイシン300mgあるいはプラセボを1日2回吸入28日間継続投与し28日間休薬する投薬サイクルを3サイクル(計24週)行った結果、トブラマイシン群では、予測正常値に対する努力性呼出1秒量の割合(%FEV1)が3サイクル目の投薬終了時(20週)に投与前値から12.0%(96例)と増加を示したのに対し、プラセボ群では−0.5%(98例)の変化であり、トブラマイシン吸入による呼吸機能の改善が認められた。また、3サイクル目の投薬終了時(20週)の喀痰中緑膿菌コロニー形成単位(Log10CFU)は、トブラマイシン群では投与前値から−0.87(71例)と減少したのに対し、プラセボ群では0.30(67例)と増加を示しており、トブラマイシン群でCFUの減少が認められた。
有害事象発現頻度は100.0%(109/109例)であった。主な有害事象は、咳嗽102例(93.6%)、鼻炎80例(73.4%)、喀痰増加61例(56.0%)、咽頭炎50例(45.9%)、呼吸困難47例(43.1%)であった8)。
有害事象発現頻度は100.0%(109/109例)であった。主な有害事象は、咳嗽102例(93.6%)、鼻炎80例(73.4%)、喀痰増加61例(56.0%)、咽頭炎50例(45.9%)、呼吸困難47例(43.1%)であった8)。
(2)プラセボ対照二重盲検比較試験として緑膿菌が検出された嚢胞性線維症患者297例(トブラマイシン群149例/プラセボ群148例)を対象に、トブラマイシン300mgあるいはプラセボを1日2回吸入28日間継続投与し28日間休薬する投薬サイクルを3サイクル(計24週)行った結果、トブラマイシン群では、予測正常値に対する努力性呼出1秒量の割合(%FEV1)が3サイクル目の投薬終了時(20週)に投与前値から8.7%(135例)と増加を示したのに対し、プラセボ群では−2.7%(133例)の変化であり、トブラマイシン吸入による呼吸機能の改善が認められた。また、3サイクル目の投薬終了時(20週)の喀痰中緑膿菌コロニー形成単位(Log10CFU)は、トブラマイシン群では投与前値から−0.62(90例)と減少したのに対し、プラセボ群では0.37(91例)と増加を示しており、トブラマイシン群でCFUの減少が認められた。
有害事象発現頻度は100.0%(149/149例)であった。主な有害事象は、咳嗽131例(87.9%)、鼻炎95例(63.8%)、喀痰増加95例(63.8%)、無力症72例(48.3%)、呼吸困難70例(47.0%)であった9)。
有害事象発現頻度は100.0%(149/149例)であった。主な有害事象は、咳嗽131例(87.9%)、鼻炎95例(63.8%)、喀痰増加95例(63.8%)、無力症72例(48.3%)、呼吸困難70例(47.0%)であった9)。
%FEV1のベースラインに対する相対変化率(%)
喀痰中緑膿菌コロニー形成単位のベースラインからの絶対変化量
18. 薬効薬理
18.1 作用機序
トブラマイシンは、細菌の蛋白合成を阻害することにより抗菌作用を発揮し、その作用は殺菌的である10)。
18.2 抗菌作用
トブラマイシンは、緑膿菌を含むグラム陰性菌に対し幅広いin vitro抗菌活性を示す6)。
19. 有効成分に関する理化学的知見
19.1. トブラマイシン
20. 取扱い上の注意
20.1 室温で28日間を超えて保存しないこと。
20.2 未使用のアンプルは、光を避けて必ずアルミ袋に保管し、アルミ袋開封後はすみやかに使用すること。
22. 包装
5mL×14管(アルミ袋)
23. 主要文献
- Geller DE,et al., Pediatr Pulmonol., 42 (4), 307-313, (2007) »PubMed
- 社内資料:外国人嚢胞性線維症患者を対象とした単回投与試験(承認年月日:2012.9.28、CTD2.7.2.2.1.1)
- Geller DE,et al., Chest., 122 (1), 219-226, (2002) »PubMed
- Gordon RC,et al., Antimicrob Agents Chemother., 2 (3), 214-216, (1972) »PubMed
- 石山俊次ほか, Chemotherapy., 23 (3), 1151-1168, (1975) »DOI
- Neu HC., J Infect Dis., 134 (Suppl.), S3-S19, (1976)
- 山作房之輔ほか, Jpn J Antibiot., 34 (11), 1429-1435, (1981) »PubMed
- 社内資料:外国人嚢胞性線維症患者を対象とした第III相試験(承認年月日:2012.9.28、CTD2.7.6.4.1.1)
- 社内資料:外国人嚢胞性線維症患者を対象とした第III相試験(承認年月日:2012.9.28、CTD2.7.6.4.1.2)
- Trevor AJ,et al., ガッツング・コア薬理学, (原書7版), 383-385, (2006), (丸善株式会社)
24. 文献請求先及び問い合わせ先
文献請求先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
製品情報問い合わせ先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
26. 製造販売業者等
26.1 製造販売元
ヴィアトリス製薬合同会社
東京都港区麻布台一丁目3番1号