医薬品情報
| 総称名 | ブフェニール |
|---|---|
| 一般名 | フェニル酪酸ナトリウム |
| 欧文一般名 | Sodium Phenylbutyrate |
| 製剤名 | フェニル酪酸ナトリウム製剤 |
| 薬効分類名 | 尿素サイクル異常症用薬 |
| 薬効分類番号 | 3999 |
| ATCコード | A16AX03 |
| KEGG DRUG |
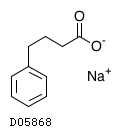
D05868
フェニル酪酸ナトリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年4月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ブフェニール錠500mg | Buphenyl Tablets 500mg | オーファンパシフィック | 3999032F1021 | 470.6円/錠 | 処方箋医薬品注) |
| ブフェニール顆粒94% | Buphenyl Granules 94% | オーファンパシフィック | 3999032D1020 | 871.3円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対して過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤は新生児期に発症する尿素サイクル異常症患者(出生後28日以内に発症する完全な尿素サイクル酵素欠損症患者)及び高アンモニア血症の既往を有する遅発型尿素サイクル異常症の患者に適用される。
5.2 本剤の適用患者には食事制限(食品蛋白の摂取制限)及び必須アミノ酸補給等の十分な栄養管理の下に本剤を投与する必要があるので、食事指導を行うこと。
6. 用法及び用量
通常、以下のとおり投与する。
| 対象 | 1日投与量(フェニル酪酸ナトリウムとして) | 用法 |
| 体重20kg未満の小児等 | 450〜600mg/kg | 3回〜6回に分割し、食事又は栄養補給とともに若しくは食直後に経口投与する。 |
| 成人及び体重20kg以上の小児等 | 9.9〜13.0g/m2(体表面積) |
投与は少量より開始し、患者の状態、血中アンモニア濃度、血漿中アミノ酸濃度等を参考に適宜増減する。また、食事制限及び必須アミノ酸補給等の十分な栄養管理の下に投与する。
7. 用法及び用量に関連する注意
7.1 1日あたり20g(40錠)以上の投与に関する安全性及び臨床効果は確認されていない。
7.2 風邪、過激な運動、食事及び便秘等により高アンモニア血症が悪化した場合は適宜増量する。また、高アンモニア血症の急性増悪が認められた場合には他の治療法を検討すること。
8. 重要な基本的注意
8.1 本剤はナトリウム含量が高いため、うっ血性心不全、腎不全、浮腫を伴うナトリウム貯留が認められる患者に投与する場合は注意すること。(500mg錠1錠あたり62mg、顆粒剤1gあたり116mgのナトリウムを含有する)[9.1.1、9.2.1参照]
8.2 主代謝物であるフェニルアセチルグルタミンの腎排泄はカリウムの尿中消失を誘発するおそれがあるため、本剤投与中は血清中カリウム濃度をモニタリングすること。[9.2.2参照]
8.3 血中アンモニア濃度、血漿中グルタミン濃度等を測定し、治療効果を確認すること。
8.4 本剤投与及び栄養管理により血漿中アミノ酸濃度が低下する可能性があるため、アルギニン濃度、分岐鎖アミノ酸濃度及び血清中蛋白濃度を基準範囲内に維持すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 うっ血性心不全、浮腫を伴うナトリウム貯留が認められる患者
疾患を増悪させるおそれがある。[8.1参照]
9.1.2 先天性のβ酸化異常を有する患者
代謝遅延により、血漿中のフェニル酪酸濃度が上昇するおそれがある。
9.2 腎機能障害患者
9.2.1 腎不全患者
疾患を増悪させるおそれがある。[8.1参照]
9.2.2 腎機能障害を有する患者
主代謝物であるフェニルアセチルグルタミンは主に腎臓から排泄されるため、蓄積するおそれがある。[8.2参照]
9.3 肝機能障害患者
9.3.1 肝機能障害を有する患者[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
11. 副作用
11.2 その他の副作用
| 10%以上 | 1〜10%未満 | 1%未満 | 頻度不明 | |
| 内分泌系 | 高アンモニア血症 | アミノ酸濃度減少、体重増加 | 肥満 | 食欲増進 |
| 精神神経系 | 人格変化、運動失調、頭痛 | 灼熱感、協調運動異常、構語障害、脳症、嗜眠、末梢性ニューロパチー、食欲減退、めまい、悪寒 | ||
| 消化器系 | 腹部不快感、悪心、流涎過多、肝機能障害、嘔吐 | 膵炎、腹痛 | 下痢、嚥下障害、胃炎、食道痛、口腔内不快感、逆流性食道炎 | |
| 皮膚 | 脱毛症 | 発疹 | 毛髪障害 | 紅斑、末梢性浮腫 |
| 感覚器 | 味覚倒錯 | 脊椎固定、腱障害、背部痛 | ||
| 血液 | 斑状出血 | 汎血球減少症、アシドーシス、低カリウム血症 | ||
| 呼吸器 | 肺炎 | 鼻炎 | ||
| 泌尿・生殖器 | 月経障害、無月経 | 失禁 | 急性腎障害 | |
| その他 | 体臭 | 感染、薬物相互作用 | 紅痛症、脱水 |
13. 過量投与
13.1 症状
5ヶ月齢の男児に偶発的に10g(1370mg/kg)を単回投与。下痢、神経過敏症、代謝性アシドーシスを呈し、対症療法を施した後48時間以内に回復した。
13.2 処置
薬の投与を中止する。血液透析あるいは腹膜透析が有用であると考えられる。
14. 適用上の注意
14.1 薬剤調製時の注意
<製剤共通>
14.1.1 グラシン紙等水分透過性の高い包材に分包して投薬する場合には、気密性の高い容器に入れるなどして湿気を避けて保存すること。[20.参照]
<ブフェニール錠500mg>
14.1.2 通常の錠剤に比べて柔らかいため自動分包機に適さない。
<ブフェニール顆粒94%>
14.1.3 顆粒剤を液体と混合すると、フェニル酪酸ナトリウムのみが溶け(水10mLに5g)、添加剤は溶けない。
14.2 薬剤交付時の注意
<ブフェニール顆粒94%>
14.2.1 顆粒剤服用時は、食物(固形、液状どちらでも良い)と混合して投与するのが望ましい。
15. その他の注意
15.2 非臨床試験に基づく情報
妊娠ラットにフェニル酪酸の活性代謝物であるフェニル酢酸の胎児及び新生児への影響を検討した1)結果、フェニル酢酸非抱合体(フェニル酢酸及びフェニルアセチルCoA)の血漿中濃度が0.5μmol/mLを上回った群では、妊娠9〜20日の12日間持続皮下投与したとき、自然流産及び新生児の早期死亡がみられた。血漿中濃度を0.25〜0.45μmol/mLに維持した群では、ほぼ全ての新生児が生存したが、体重及び大脳半球重量は通常より有意に低く(いずれもp<0.001)、全ての同腹児に学習障害がみられた。一方、2日齢のラットにフェニル酢酸を20日間投与した後では、17%の体重減少が認められ、成長の遅延がみられた2)。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与3)
健康成人男性10例及び健康成人女性11例の合計21例を対象として、フェニル酪酸ナトリウムの顆粒剤及び錠剤を空腹時に単回経口投与し、フェニル酪酸及びその代謝物(フェニル酢酸及びフェニルアセチルグルタミン)の薬物動態をクロスオーバー試験で検討した。海外第III相試験における使用製剤を用い、投与量は、錠剤及び顆粒剤ともにフェニル酪酸ナトリウムとして5g注)とした(外国人データ)。
| 測定物質 | 製剤 | tmax(hr) | Cmax(μg/mL) | AUC0-t(μg・hr/mL) | t1/2(hr) |
| フェニル酪酸 | 錠剤 | 1.35(49) | 218.0(25) | 577.3(31) | 0.77(35) |
| 顆粒剤 | 1.00(35) | 195.2(25) | 493.8(28) | 0.76(39) | |
| フェニル酢酸 | 錠剤 | 3.74(22) | 48.5(39) | 210.6(47) | 1.15(23) |
| 顆粒剤 | 3.55(18) | 45.3(36) | 187.6(41) | 1.29(29) | |
| フェニルアセチルグルタミン | 錠剤 | 3.43(14) | 68.5(20) | 306.0(25) | 2.41(32) |
| 顆粒剤 | 3.23(13) | 62.8(17) | 267.7(24) | 2.36(26) |
16.1.2 反復投与
尿素サイクル異常症患者13例を対象として、フェニル酪酸ナトリウムの顆粒剤又は錠剤を反復経口投与し、治験責任(分担)医師により薬物動態評価用の採血が実施された8例を対象としてフェニル酪酸及びその代謝物(フェニル酢酸及びフェニルアセチルグルタミン)の血漿中濃度を測定した。投与量は1.33〜4.5g注)であった4)。
| 測定項目 | 採血時期 | 平均値(μg/mL) | 標準偏差 |
| フェニル酪酸 | 投与前 | 定量限界未満 | − |
| 1時間後 | 94.880 | 76.906 | |
| 4時間後 | 34.518 | 42.888 | |
| フェニル酢酸 | 投与前 | 定量限界未満 | − |
| 1時間後 | 12.591 | 12.815 | |
| 4時間後 | 19.440 | 16.524 | |
| フェニルアセチルグルタミン | 投与前 | 6.794 | 6.739 |
| 1時間後 | 27.488 | 15.354 | |
| 4時間後 | 66.973 | 50.512 |
16.2 吸収
16.2.1 食事の影響
承認時までに食事の影響を検討した試験は行われていない。
16.4 代謝
16.5 排泄
健康成人男性2例又は1例に、フェニル酪酸ナトリウム(2.5g又は5g)注)を単回経口投与したとき、フェニルアセチルグルタミンとして、尿中に排泄された。投与8時間以内に投与されたフェニル酪酸ナトリウムの約71〜82%、投与24時間以内に約92%がフェニルアセチルグルタミンとして腎排泄された5)6)(外国人データ)。
健康成人男性2例を対象にフェニル酢酸の14C標識体(1mg/kg)注)を単回経口投与したとき、投与24時間後までに投与量の98%が尿中に排泄され、組成比はフェニル酢酸のグルタミン抱合体(フェニルアセチルグルタミン)93%、グリシン抱合体<0.05%、タウリン抱合体6%であり、未変化体は検出されなかった7)(外国人データ)。
健康成人男性2例を対象にフェニル酢酸の14C標識体(1mg/kg)注)を単回経口投与したとき、投与24時間後までに投与量の98%が尿中に排泄され、組成比はフェニル酢酸のグルタミン抱合体(フェニルアセチルグルタミン)93%、グリシン抱合体<0.05%、タウリン抱合体6%であり、未変化体は検出されなかった7)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 肝硬変患者
(1)単回投与8)
男性肝硬変患者4例にフェニル酪酸ナトリウム(2.5g)注)を、空腹時に単回経口投与したとき、4例中3例で投与8時間以内に投与されたフェニル酪酸ナトリウムの約33〜46%がフェニルアセチルグルタミンとして尿中に排泄され、フェニル酢酸の尿中排泄も認められた。肝硬変患者ではフェニル酢酸からその後尿中に排泄されるフェニルアセチルグルタミンへの変換は比較的緩徐であることが示唆された(外国人データ)。[9.3.1参照]
(2)反復投与9)
門脈圧亢進症を合併する男性肝硬変患者6例にフェニル酪酸ナトリウム(20g/日)注)を1日3回3日間反復経口投与したとき、6例中3例で血漿中フェニル酢酸が投与1日目から3日目にかけて継続して上昇し、フェニル酢酸の蓄積が示唆された(外国人データ)。[9.3.1参照]
注)本剤の承認された用法・用量は、成人及び体重20kg以上の小児にはフェニル酪酸ナトリウムとして1日9.9〜13.0g/m2(体表面積)、体重20kg未満の新生児、乳幼児及び小児にはフェニル酪酸ナトリウムとして1日450〜600mg/kgを3〜6回に分割して経口投与することとされている。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第I/II相試験4)
日本人尿素サイクル異常症患者13例(オルニチントランスカルバミラーゼ欠損症11例、アルギニノコハク酸合成酵素欠損症1例、及びカルバミルリン酸合成酵素欠損症1例)を対象として食事又は栄養補給とともに、若しくは食直後に1日3〜6回に分割して経口投与した。平均投与量は、1.59〜13.86g/日注)であった。高アンモニア血症(血中アンモニア濃度≧150μg/dL)は治験開始後に13例中10例で合計51回発現した。このうち、血中アンモニア濃度が200μg/dLを超えたのは8例で30回、300μg/dLを超えたのは5例で13回であった。13例中3例では、治験薬投与開始後に高アンモニア血症の発現は認められなかった。これらの高アンモニア血症はいずれも回復した。
副作用の発現割合は61.5%(8/13例)であった。発現した副作用は、高アンモニア血症4例(30.8%)、脱毛症3例(23.1%)、頭痛2例(15.4%)、膿痂疹、尿路感染、皮膚乳頭腫、人格変化、運動失調、片頭痛、上気道の炎症、腹部不快感、胃潰瘍、胃腸出血、悪心、急性膵炎、流涎過多、嘔吐、肝障害、発疹、排尿困難、月経障害、嚢胞、尿中ブドウ糖陽性、アミノ酸濃度減少各1例(7.7%)であった(本試験の延長試験として実施された製造販売後臨床試験の結果を含む)。
副作用の発現割合は61.5%(8/13例)であった。発現した副作用は、高アンモニア血症4例(30.8%)、脱毛症3例(23.1%)、頭痛2例(15.4%)、膿痂疹、尿路感染、皮膚乳頭腫、人格変化、運動失調、片頭痛、上気道の炎症、腹部不快感、胃潰瘍、胃腸出血、悪心、急性膵炎、流涎過多、嘔吐、肝障害、発疹、排尿困難、月経障害、嚢胞、尿中ブドウ糖陽性、アミノ酸濃度減少各1例(7.7%)であった(本試験の延長試験として実施された製造販売後臨床試験の結果を含む)。
17.1.2 海外第III相試験10)
海外の尿素サイクル異常症患者183例(オルニチントランスカルバミラーゼ欠損症122例、アルギニノコハク酸合成酵素欠損症39例及びカルバミルリン酸合成酵素欠損症22例)を対象に、新生児、幼児及び体重20kg未満の小児ではフェニル酪酸ナトリウムとして450〜600mg/kg/日、体重20kg以上の小児、10代の患者及び成人患者ではフェニル酪酸ナトリウムとして9.9〜13.0g/m2/日を経口投与(必須アミノ酸や蛋白質の摂取量維持のための食事療法も併用)した。有効性評価対象183例のうち139例が生存し、全体の生存率は約76%であった。高アンモニア血症は評価可能症例173例のうち29%の被験者で発症しなかった。血漿中のアンモニア濃度は85例で測定され、281回の測定値のうち61.2%は検査施設の基準範囲内であった。また、85例中17例(6%)は基準範囲値上限の2倍以上高かった。
安全性の評価が可能であった183例中、副作用は34例(18.6%)に54件報告された。全体で2例以上の副作用は、月経障害10例(5.5%)、体臭7例(3.8%)、無月経5例(2.7%)、体重増加4例(2.2%)、嘔吐3例(1.6%)、味覚倒錯、肺炎各2例(1.1%)であった。
安全性の評価が可能であった183例中、副作用は34例(18.6%)に54件報告された。全体で2例以上の副作用は、月経障害10例(5.5%)、体臭7例(3.8%)、無月経5例(2.7%)、体重増加4例(2.2%)、嘔吐3例(1.6%)、味覚倒錯、肺炎各2例(1.1%)であった。
17.3 その他
17.3.1 国内臨床研究11)
日本人尿素サイクル異常症患者であるオルニチントランスカルバミラーゼ欠損症6例(新生児発症型1例、遅発型5例)を対象に本剤(錠剤1例、顆粒剤5例)を450〜600mg/kg/日(体重20kg未満)又は9.9〜13.0g/m2/日(体重20kg以上)を1日3回食後(患者の食事摂取量に合わせ適宜増減。アルギニンとシトルリンの併用は可)12ヶ月投与した結果、服薬コンプライアンスを保つことが困難な1例を除き、血中アンモニアのコントロールに有用で、ほとんどの症例で摂取蛋白量の増加が示された。
副作用は、6例中4例に分岐鎖アミノ酸の低下が認められた。
副作用は、6例中4例に分岐鎖アミノ酸の低下が認められた。
注)本剤の承認された用法・用量は、成人及び体重20kg以上の小児にはフェニル酪酸ナトリウムとして1日9.9〜13.0g/m2(体表面積)、体重20kg未満の新生児、乳幼児及び小児にはフェニル酪酸ナトリウムとして1日450〜600mg/kgを3〜6回に分割して経口投与することとされている。
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. フェニル酪酸ナトリウム
20. 取扱い上の注意
無包装開放状態で吸湿することが認められているため、開栓後は防湿に留意すること。[14.1.1参照]
22. 包装
<ブフェニール錠500mg>
(バラ:チャイルドレジスタンスキャップ、プラスチックボトル)250錠
<ブフェニール顆粒94%>
(チャイルドレジスタンスキャップ、プラスチックボトル)266g
23. 主要文献
- Loo YH,et al., Dev Neurosci., 6, 227-234, (1983-1984)
- Fulton TR,et al., Life Sci., 27, 1271-1281, (1980) »PubMed
- 社内資料:海外健康成人の薬物動態(Study IV-6)(2012年9月28日承認、CTD2.7.6.1)
- 社内資料:国内第I/II相試験(CM02-001試験2013年9月27日治験総括報告書最終報告)(2012年9月28日承認)
- 社内資料:海外健康成人2例単回投与時薬物動態(Study IV-4)(2012年9月28日承認、CTD2.7.6.2)
- 社内資料:海外健康成人1例単回投与時薬物動態(Study IV-5)(2012年9月28日承認、CTD2.7.6.3)
- James MO,et al., Proc R Soc Lond B Biol Sci., 182, 25-35, (1972) »PubMed
- 社内資料:海外肝硬変患者4例単回投与時薬物動態(Study IV-15)(2012年9月28日承認、CTD2.7.6.5)
- 社内資料:海外肝硬変患者6例反復投与時薬物動態(Study IV-16)(2012年9月28日承認、CTD2.7.6.6)
- 社内資料:海外第III相試験(Study IV-17)(2012年9月28日承認、CTD2.7.6.7)
- 小松崎匠子ほか, 日本小児科学会雑誌, 116, 842-848, (2012)
- Moldave K,et al., Biol Chem., 229, 463-476, (1957)
24. 文献請求先及び問い合わせ先
文献請求先
株式会社オーファンパシフィック
DIセンター
〒105-0023
東京都港区芝浦1-1-1
電話:0120-889-009 受付時間 9:00〜17:30(土・日・祝日・社休日を除く)
製品情報問い合わせ先
株式会社オーファンパシフィック
DIセンター
〒105-0023
東京都港区芝浦1-1-1
電話:0120-889-009 受付時間 9:00〜17:30(土・日・祝日・社休日を除く)
26. 製造販売業者等
26.1 製造販売元
株式会社オーファンパシフィック
〒105-0023
東京都港区芝浦1-1-1