医薬品情報
| 総称名 | ギリアデル |
|---|---|
| 一般名 | カルムスチン |
| 欧文一般名 | Carmustine |
| 製剤名 | カルムスチン脳内留置用剤 |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 薬効分類番号 | 4219 |
| ATCコード | L01AD01 |
| KEGG DRUG |
D00254
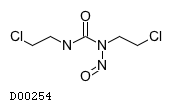
カルムスチン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年3月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ギリアデル脳内留置用剤7.7mg | Gliadel 7.7mg Implant | エーザイ | 4219700X1020 | 163858円/枚 | 劇薬, 処方箋医薬品注) |
1. 警告
本剤の投与にあたっては、緊急時に十分対応できる医療施設において、悪性脳腫瘍の外科手術及び薬物療法に十分な知識・経験を持つ医師のもとで、本剤の留置が適切と判断される症例についてのみ実施すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
悪性神経膠腫
5. 効能または効果に関連する注意
5.1 本剤は、術中迅速病理組織診断等により組織型を確認の上、留置すること。
6. 用法及び用量
通常、成人には、腫瘍切除腔の大きさや形状に応じて、本剤8枚(カルムスチンとして61.6mg)又は適宜減じた枚数を脳腫瘍切除術時の切除面を被覆するように留置する。
7. 用法及び用量に関連する注意
7.1 本剤は、切除腔の大きさ・形状により、わずかに重なりあって留置することは可能であるが、組織表面と接しない切除腔に充填しないこと。
7.2 本剤を分割して使用した場合の有効性及び安全性は確立していない。[14.2.4参照]
7.3 本剤を2回以上留置した場合の有効性及び安全性は確立していない。
8. 重要な基本的注意
8.1 本剤が脳室系に移行して水頭症が発症するおそれがあるので、腫瘍切除術後に切除腔から脳室系に至る間隙が認められる場合には、本剤の留置前にその間隙を閉鎖する等の対応を行った上で本剤を留置すること。[11.1.2参照]
8.2 本剤留置患者において、脳脊髄液の漏出が認められることがあるので、手術時の硬膜閉鎖等の処置を適切に実施すること。
8.3 本剤留置後のCT及びMRI検査において、切除腔周囲の脳組織に造影増強が認められた場合には、本剤の留置又は腫瘍の増大に起因する可能性があることに留意し、適切な処置を検討すること。
8.4 本剤留置部位に気体の貯留が認められることがあり、神経症状を発現した例も報告されている。本剤留置後は、片麻痺、失語症、意識障害等の神経症状の観察を十分に行い、異常が認められた場合には、適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.4 生殖能を有する者
9.4.1 妊娠可能な女性には、本剤留置後最低2週間は適切な避妊法を用いるよう指導すること。[9.5参照]
9.4.2 パートナーが妊娠する可能性のある男性には、最低3ヵ月間は適切な避妊法を用いるよう指導すること。雄動物(ラット)に投与したときに授胎能の低下、胚死亡の増加が認められたとの報告がある。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。
動物実験(ラット)で14C標識カルムスチンを静脈内投与したとき、放射能の乳汁移行が認められている。
動物実験(ラット)で14C標識カルムスチンを静脈内投与したとき、放射能の乳汁移行が認められている。
9.7 小児等
小児を対象とした臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 痙攣、大発作痙攣(いずれも頻度不明)
11.1.2 脳浮腫(25.0%)、頭蓋内圧上昇(頻度不明)、水頭症(頻度不明)、脳ヘルニア(頻度不明)[8.1参照]
11.1.3 創傷治癒不良(頻度不明)
創傷治癒に影響を及ぼす可能性が考えられ、脳脊髄液の漏出、創傷治癒遅延による創し開、創合併症があらわれることがある。
11.1.4 感染症(頻度不明)
創傷感染、膿瘍、髄膜炎等の感染症があらわれることがある。
11.1.5 血栓塞栓症(頻度不明)
脳梗塞、深部静脈血栓症、肺塞栓症等の血栓塞栓症があらわれることがある。
11.1.6 出血(頻度不明)
腫瘍出血、脳出血、頭蓋内出血等の出血症状があらわれることがある。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 頻度不明 | |
| 全身症状 | 発熱 | 低体温、浮腫 | 顔面浮腫、無力症、倦怠感、腫脹、腫瘤、嚢胞、疼痛、胸痛、体重減少 |
| 精神神経系 | 頭痛、片麻痺 | 失語症、感覚鈍麻、記憶障害、半盲、単麻痺 | 錯乱状態、うつ病、解離、感情不安定、激越、幻覚、思考異常、人格障害、不安、失見当識、不眠症、妄想症、認知症、傾眠、昏迷、ジスキネジア、異常感覚、会話障害、協調運動異常、構語障害、昏睡、錯感覚、刺激無反応、視野欠損、振戦、脳神経麻痺、めまい、部分発作、片頭痛、末梢性ニューロパチー、嗜眠 |
| 感覚器 | 斜視 | 眼筋麻痺、散瞳、視神経乳頭浮腫、視力障害、失明、弱視、複視、霧視、羞明、耳鳴 | |
| 血液 | リンパ球数減少 | 血小板数減少、白血球数増加 | 白血球数減少、プロトロンビン量減少、汎血球減少症、貧血、血液量減少症 |
| 肝臓 | ALT増加 | 肝機能検査異常、Al-P増加 | |
| 腎臓・泌尿器 | 尿失禁 | 尿閉、膀胱感覚消失、頻尿、多尿、尿糖 | |
| 循環器 | ショック、高血圧、低血圧、チアノーゼ、頻脈、心電図異常、心拍出量異常 | ||
| 消化器 | 悪心、嘔吐、食欲減退 | 腹部不快感 | 下痢、便秘 |
| 皮膚 | そう痒症、皮膚変色、蕁麻疹、多汗症、発疹 | ||
| 筋骨格系 | 筋攣縮、筋骨格硬直、頚部痛、背部痛、四肢痛、筋力低下 | ||
| 呼吸器 | しゃっくり、呼吸困難、誤嚥性肺炎 | ||
| 代謝・内分泌 | 尿崩症、高血糖、脱水、低ナトリウム血症、低マグネシウム血症 | ||
| 感染症 | 敗血症、カンジダ症、帯状疱疹、尿路感染、蜂巣炎 | ||
| その他 | 不規則月経、CRP増加、CK増加 | 処置後血腫、切開部位痛、切開部位浮腫、切開部位紅斑、帽状腱膜下血腫、創腐敗、創部炎症、髄液貯留、脳室炎、嚢胞性リンパ管腫、髄液細胞増加 |
14. 適用上の注意
14.1 薬剤留置前の注意
14.1.1 本剤(二重のアルミラミネート袋入り)は、保存庫(−15℃以下)から、未開封のまま手術室に運び、脳内留置の準備ができるまで開封しない。
14.1.2 本剤は、室温で6時間まで安定である。(未開封時)
14.1.3 室温で6時間以内の本剤(未開封)は、1回のみ再凍結(−15℃以下)保存できるが、再凍結後の本剤は、6ヵ月以内に使用すること(ただし外箱又はラベルに表示の使用期限内に使用すること)。
14.2 薬剤留置時の注意
14.2.1 二重のアルミラミネート袋の開封時、本剤は割れやすいため、開封時の留意点等を別に示す。[説明図参照]
14.2.2 カルムスチンが皮膚に接触すると、重度の熱傷と色素沈着をきたすおそれがあるので、本剤の取扱い時には十分に注意すること。
14.2.3 脳内留置時、腫瘍を切除して十分に止血した後、切除面をできるだけ被覆するように、本剤を留置する。なお、切除腔の大きさ・形状により、本剤がわずかに重なり合って留置することは可とする。[説明図参照]
14.2.4 搬送による衝撃等により、開封時に本剤が割れていた場合は、原則使用せずに廃棄すること。
本剤をほぼ同じ大きさに2分割したとき、カルムスチン放出性は未分割の製剤と同様であったが、分割して使用した場合の有効性及び安全性は確立していない。[7.2参照]
本剤をほぼ同じ大きさに2分割したとき、カルムスチン放出性は未分割の製剤と同様であったが、分割して使用した場合の有効性及び安全性は確立していない。[7.2参照]
15. その他の注意
15.2 非臨床試験に基づく情報
本剤の有効成分であるカルムスチンは、他のアルキル化剤と同様に遺伝毒性を有し、マウス、ラットのリンパ組織、肺等において腫瘍が発生したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.2 吸収
16.3 分布
In vitro(0℃)におけるカルムスチンのヒト血漿たん白結合率は、約80%であったことが報告されている3)。
16.4 代謝
ヒト肝ミクロソーム及びサイトソールを用いたin vitro代謝試験結果から、カルムスチンは、ミクロソームでの脱ニトロソ反応によって1,3-ビス(2-クロロエチル)ウレアに代謝されると推察された。また、非酵素的に2-クロロエチルイソシアネートに分解した後、グルタチオンと抱合体を形成すると推察された4)。
16.5 排泄
16.5.1 外国人悪性腫瘍患者に14C標識カルムスチン200mg/m2を単回静脈内投与したとき、投与後96時間までに尿及び糞中にそれぞれ投与放射能の約60%及び1%未満が排泄され、また、投与放射能の約6%は14C-CO2として呼気中に排泄されたことが報告されている5)。
16.5.2 ラット及びウサギの脳内に14C標識SA又は14C標識CPPを用いて合成したポリフェプロサン20(カルムスチン含有)を留置した。ラットでは14C-SA由来の放射能は、投与後7日までに尿、糞及び呼気(14C-CO2として)中にそれぞれ11%、1%及び46%が排泄され、脳内遺残物に8%が残存した。また、ウサギでは14C-CPP由来の放射能は、投与後21日までに尿及び糞中にそれぞれ62%及び2%が排泄され、脳内遺残物に29%が残存した6)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第I/II相試験
初発悪性神経膠腫患者16例及び再発膠芽腫患者8例を対象に、非対照、非盲検臨床試験を行った。この試験では、腫瘍切除術時に本剤を留置した時の有効性及び安全性について評価した。中央病理診断による24例の病理組織型は、初発例では膠芽腫9例、膠芽腫以外7例(内訳:退形成性乏突起神経膠腫3例、乏突起神経膠腫2例、退形成性神経節膠腫及び乏突起星細胞腫各1例)、再発例では膠芽腫4例、膠芽腫以外4例(内訳:退形成性乏突起神経膠腫、退形成性乏突起星細胞腫、退形成性星細胞腫及び高グレード神経膠腫各1例)であり、本剤留置時の腫瘍摘出率(平均値±標準偏差)は、初発例で91.9±8.5%、再発例で87.3±17.0%、全体で90.3±11.8%であった。初発例では、本剤留置後にテモゾロミドと放射線療法との併用療法を行った。本剤の留置枚数は24例中21例に8枚が留置され、その他の3例は5枚、6枚、7枚であった。
その結果、Kaplan-Meier法による初発例の12ヵ月生存率は100.0%であり、再発例の6ヵ月生存率は87.5%、12ヵ月生存率は62.5%であった。12ヵ月時点の生存期間中央値は、初発例及び再発例ともに算出できなかった。無増悪生存率は、初発例の6ヵ月で75.0%(95%信頼区間:46.3-89.8)、12ヵ月で62.5%(95%信頼区間:34.9-81.1)、無増悪生存期間中央値は、12ヵ月時点では算出できなかった。再発例の6ヵ月無増悪生存率は、37.5%(95%信頼区間:8.7-67.4)、12ヵ月では、25.0%(95%信頼区間:3.7-55.8)、無増悪生存期間中央値は170日であった1)。副作用(臨床検査値異常を含む)発現症例は13例(54.2%)で、主な副作用は、脳浮腫6例(25.0%)、発熱3例(12.5%)、リンパ球数減少3例(12.5%)、片麻痺(不全片麻痺を含む)3例(12.5%)、悪心2例(8.3%)、嘔吐2例(8.3%)、食欲減退2例(8.3%)、頭痛2例(8.3%)、ALT増加2例(8.3%)であった。(承認時)[5.2参照]
その結果、Kaplan-Meier法による初発例の12ヵ月生存率は100.0%であり、再発例の6ヵ月生存率は87.5%、12ヵ月生存率は62.5%であった。12ヵ月時点の生存期間中央値は、初発例及び再発例ともに算出できなかった。無増悪生存率は、初発例の6ヵ月で75.0%(95%信頼区間:46.3-89.8)、12ヵ月で62.5%(95%信頼区間:34.9-81.1)、無増悪生存期間中央値は、12ヵ月時点では算出できなかった。再発例の6ヵ月無増悪生存率は、37.5%(95%信頼区間:8.7-67.4)、12ヵ月では、25.0%(95%信頼区間:3.7-55.8)、無増悪生存期間中央値は170日であった1)。副作用(臨床検査値異常を含む)発現症例は13例(54.2%)で、主な副作用は、脳浮腫6例(25.0%)、発熱3例(12.5%)、リンパ球数減少3例(12.5%)、片麻痺(不全片麻痺を含む)3例(12.5%)、悪心2例(8.3%)、嘔吐2例(8.3%)、食欲減退2例(8.3%)、頭痛2例(8.3%)、ALT増加2例(8.3%)であった。(承認時)[5.2参照]
18. 薬効薬理
19. 有効成分に関する理化学的知見
19.1. カルムスチン
22. 包装
8枚(分包1枚×8)
4枚(分包1枚×4)
1枚(分包1枚)
23. 主要文献
- Aoki T.,et al., Neurol.Med.Chir., 54 (4), 290-301, (2014), (Tokyo) »PubMed
- Fung L.K.,et al., Cancer Res., 58 (4), 672-684, (1998) »PubMed
- Loo T.L.,et al., J.Pharm.Sci., 55 (5), 492-497, (1966)
- 社内資料:カルムスチンのヒト肝ミクロソーム、ヒト肝サイトソールに対する影響
- DeVita V.T.,et al., Clin. Pharmacol.Ther., 8 (4), 566-577, (1967) »PubMed
- 社内資料:ラット及びウサギにおけるポリフェプロサン20の薬物動態
- Chabner B.A.,et al., Goodman&Gilman's The pharmacological basis of therapeutics 11th ed., 1324, (2006)
- Tashima M.,et al., Biochem.Pharmacol., 28 (4), 511-517, (1979) »PubMed
- Batista L.F.Z.,et al., Cancer Res., 67 (24), 11886-11895, (2007) »PubMed
- Xu G.W.,et al., Int.J.Cancer, 116 (2), 187-192, (2005) »PubMed
- 社内資料:ヒト神経膠芽腫細胞株(U-87MG)の頭蓋内移植モデルに対するカルムスチンの抗腫瘍効果
24. 文献請求先及び問い合わせ先
文献請求先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
製品情報問い合わせ先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
26. 製造販売業者等
26.1 製造販売(輸入)元
エーザイ株式会社
東京都文京区小石川4-6-10
その他の説明
「ギリアデル脳内留置用剤7.7mg」の開封時の留意点について 説明図
[1]本剤の開封前に、手術用手袋を二重に着用すること。
[2]本剤の取扱いが終了するまで、手袋を着用したままにすること。(本剤が皮膚に接触すると重度の熱傷と色素沈着をきたすおそれがある)
[1]左右にゆっくり引く
外袋の開封用の角を、ゆっくりと引っ張って開ける。
[1]の注意 勢いよくはがさない!
外袋を勢いよくはがさないこと。
本剤に外圧がかかると破損する可能性がある。
本剤に外圧がかかると破損する可能性がある。
[2]内袋(滅菌済み)の端を慎重に、指又は滅菌済みのピンセットでしっかりつまんで取り出す。(つまんだまま、次の操作で内袋をカットするため)
[3]内袋の端をつまんで、滅菌済みのハサミで内袋を円弧状にカットする。(円弧状にすると本剤を取り出しやすい)
[4]本剤を、内袋からゆっくりと滅菌済みのピンセットで取り出し、腫瘍切除腔へ留置する。
注:本剤の開封に使用したピンセット、ハサミは、手術に使用しないこと。
「ギリアデル脳内留置用剤7.7mg」の廃棄について
以下のように扱われた本剤及びその他廃材は、廃棄物専用容器に廃棄すること。
[1]開封後、脳内に留置する前に誤って本剤を落としたもの
[2]室温で6時間を経過した未開封の本剤
[3]再凍結後6ヵ月を経過した未開封の本剤
[4]本剤の留置時に使用した二重の手術用手袋の外側の手袋及びその他廃材
「ギリアデル脳内留置用剤7.7mg」の腫瘍切除面への留置について 説明図
[1]本剤の留置前に、腫瘍切除面が十分に止血できていることを確認する。
[2]腫瘍切除面を被覆するように、本剤を留置する。(最大8枚まで)
[3]腫瘍切除腔の大きさ・形状により、本剤がわずかに重なり合って留置することは可能である。
注意:腫瘍切除面を被覆するように本剤を留置したら、それ以上、本剤の留置は行わないこと。留置枚数が7枚以下の場合、残った本剤を組織表面と接しない切除腔に充填しないこと。