医薬品情報
| 総称名 | マキサカルシトール |
|---|---|
| 一般名 | マキサカルシトール |
| 欧文一般名 | Maxacalcitol |
| 製剤名 | マキサカルシトール軟膏 |
| 薬効分類名 | 尋常性乾癬等 角化症治療剤 |
| 薬効分類番号 | 2691 |
| KEGG DRUG |
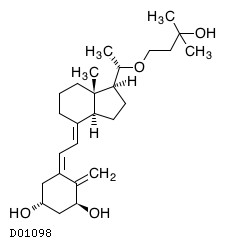
D01098
マキサカルシトール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年6月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| マキサカルシトール軟膏25μg/g「イワキ」 (後発品) | Maxacalcitol Ointment 25μg/g"IWAKI" | 岩城製薬 | 2691702M1052 | 34.8円/g | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対して過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常1日2回適量を患部に塗擦する。なお、症状により適宜回数を減じる。
7. 用法及び用量に関連する注意
7.1 1日の使用量はマキサカルシトールとして250μg(マキサカルシトール外用製剤として10g)までとする。
7.2 本剤は、通常、使用後6週目までに効果が認められているので、治療にあたっては経過を十分に観察し、症状の改善がみられない場合には、漫然と使用を継続しないこと。
8. 重要な基本的注意
8.1 本剤は活性型ビタミンD3誘導体製剤であり、血中カルシウム値が上昇する可能性がある。また、高カルシウム血症に伴い、急性腎障害の報告があるため、本剤の使用に際しては、血中カルシウム値及び腎機能(血中クレアチニン、BUN等)の検査を定期的(開始2〜4週後に1回、その後は適宜)に行うこと。なお、正常域を超えた場合には減量又は使用を中止すること。[9.1.1、9.2、11.1.1、11.1.2参照]
8.2 皮疹が広範囲にある場合や、皮疹重症度が高く、皮膚のバリア機能が低下して本剤の経皮吸収が増加する可能性のある患者では、高カルシウム血症が発現しやすく、急性腎障害に至る可能性もあるため、本剤を少量から使用開始し、観察を十分に行い、血中カルシウム値及び腎機能の検査を定期的に行うこと。[9.1.1、9.2、11.1.1、11.1.2参照]
8.3 本剤の密封療法(ODT)における安全性は確立していない。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には使用しないことが望ましい。動物実験(ラット)では胎盤を通じて胎児へ移行することが認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。周産期及び授乳期の静脈内投与試験(ラット)において、1.1μg/kg/日投与で出生児に体重増加抑制がみられた。また、分娩後哺乳中のラットに静脈内投与したとき、乳汁中への移行を示唆する報告がある。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
使用が過度にならないように注意すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| ビタミンD及びその誘導体 アルファカルシドール カルシトリオール カルシポトリオール 等 | 高カルシウム血症があらわれるおそれがある。 | 相加作用 |
| PTH製剤 テリパラチド アバロパラチド酢酸塩 | 高カルシウム血症があらわれるおそれがある。 | 相加作用 |
| カルシウム製剤 乳酸カルシウム水和物 炭酸カルシウム 等 | 高カルシウム血症があらわれるおそれがある。 | 本剤は腸管でのカルシウムの吸収を促進させる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には使用を中止するなど適切な処置を行うこと。
11.1.1 高カルシウム血症(頻度不明)
11.1.2 急性腎障害(頻度不明)
11.2 その他の副作用
| 1%以上 | 0.1〜1%未満 | 頻度不明 | |
| 皮膚 | そう痒、皮膚刺激、紅斑、皮膚剥脱 | 発疹、湿疹、接触皮膚炎、水疱、腫脹、疼痛、毛包炎、色素沈着、びらん、浮腫、熱感 | |
| 腎臓 | 尿中蛋白陽性、血中クレアチニン増加、増殖性糸球体腎炎 | 尿路結石、BUN増加 | |
| 代謝 | 血中カルシウム増加 | 血中リン増加、Al-P増加、CK増加、尿中ブドウ糖陽性、血中アルブミン減少、血中カリウム減少 | |
| 消化器 | 口渇、食欲不振、びらん性胃炎 | ||
| 肝臓 | γ-GTP増加、AST増加、ALT増加、血中ビリルビン増加、尿中ウロビリン陽性 | ||
| 血液 | 白血球数減少、白血球数増加、血小板数減少 | ||
| 筋・骨格系 | 背部痛 |
13. 過量投与
13.1 症状
高カルシウム血症が発現する可能性がある。高カルシウム血症の主な症状は、口渇、倦怠感、脱力感、食欲不振、嘔気、嘔吐、腹部膨満感、腹痛、頭痛、めまい、筋肉痛、筋力低下等である。[14.1参照]
13.2 処置
直ちに使用を中止すること。血中カルシウム値、尿中カルシウム値等の生化学的検査を行い、必要に応じて輸液等の処置を行うこと。
14. 適用上の注意
14.1 薬剤交付時の注意
誤用(内服等)防止のため、薬剤の保管に十分注意させること。特に、小児の手のとどかない所に保管させること。万一、誤って内服した場合には、高カルシウム血症等の全身性の副作用があらわれることがあるので、医療機関を受診するなど、適切な処置を受けるよう指導すること。[13.1参照]
14.2 薬剤使用時の注意
14.2.1 使用部位
(1)本剤は患部にのみ使用し、正常皮膚部位には使用しないこと。
(2)皮膚以外の部位(眼、粘膜)には使用しないこと。
14.2.2 使用時
本剤に触れた手で傷口等に触れないように注意すること。
14.2.3 使用後
本剤塗擦後は手をよく洗うこと。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 光苛酷試験において、本剤は紫外線(太陽光線を含む)により分解された。
15.2.2 がん原性試験においてラット(F344/DuCrj)に1日1回24カ月間経皮投与した結果、副腎において褐色細胞腫の発生頻度が増加した。一部、副腎被膜への浸潤を示す例が認められたが、副腎近隣組織への浸潤や遠隔転移を示すものはなかった。また、マウスでは1日1回18カ月間経皮投与で発がん性は認められなかった。
16. 薬物動態
16.1 血中濃度
16.1.1 尋常性乾癬患者にマキサカルシトール軟膏(マキサカルシトールとして25μg/g)1回適量(7gまで)を1日2回26週間塗擦したところ注1)、24例に血清中マキサカルシトール(50.4〜744.0pg/mL)を検出したが、他は検出限界(50pg/mL)以下であった1)。
16.1.2 尋常性乾癬患者4例にマキサカルシトール軟膏(マキサカルシトールとして50μg/g注2))4gを1日1回3日間塗擦したところ、得られたパラメータは次のとおりであった2)(外国人データ)。
| tmax(h) | Cmax(pg/mL) | AUC(pg・h/mL) | t1/2(h) | |
| 1日目 | 3.0 | 591±285 | 4177±2369.1 | 3.9 |
| 3日目 | 3.5 | 475±188 | 2452±1218 | 2.2 |
16.2 吸収
健康成人男子12例に同一被験者の左前腕内側部にマキサカルシトール軟膏を塗布(38mg)し、塗布8時間後(定常状態)における角質内薬物濃度を測定した。その結果、軟膏の角質内薬物濃度は、11.1±3.4μg/gであった3)。
16.4 代謝
ラット腎ミトコンドリアを用いた代謝試験4)において、マキサカルシトールは活性型ビタミンD3の代謝酵素であるCYP24により代謝されると考えられた(in vitro)。ヒトP450発現系を用いた代謝試験4)において、マキサカルシトールはCYP3A4によって代謝された(in vitro)。
注1)本剤の1日最大使用量は10gである。
注2)本剤の承認規格は25μg/g軟膏である。
16.8 その他
16.8.1 生物学的同等性試験
(1)薬物動態学的試験
マキサカルシトール軟膏25μg/g「イワキ」とオキサロール軟膏25μg/gを健康な成人男性12例の背部皮膚に適用した時の皮膚薬物動態学的試験を実施し、定常状態における角層中マキサカルシトール量を測定した。得られた角層中薬物量について統計解析を行った結果、両剤の生物学的同等性が確認された5)。
(2)暴露量試験
マキサカルシトール軟膏25μg/g「イワキ」及びオキサロール軟膏25μg/gをウサギ損傷皮膚に単回経皮投与し、得られた各採血時間の血漿中マキサカルシトール濃度から求めたAUCについて比較検討したところ、マキサカルシトール軟膏25μg/g「イワキ」の暴露量はオキサロール軟膏25μg/gと比較して『同等以下』であると判定された6)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<尋常性乾癬>
17.1.1 国内第III相臨床試験(軟膏の左右比較試験)
尋常性乾癬患者79例を対象にマキサカルシトール軟膏を1日2回適量(片側の1回最高量1g)注)、8週間連日外用した左右比較試験7)において有効性が認められた。
安全性解析対象例75例において、局所性の副作用は4例(5.3%)に5件認められた。副作用の内訳は、そう痒3件(4.0%)、刺激感、発赤各1件(1.3%)であった。全身性の副作用は2例(2.7%)にγ-GTP上昇が認められた。
安全性解析対象例75例において、局所性の副作用は4例(5.3%)に5件認められた。副作用の内訳は、そう痒3件(4.0%)、刺激感、発赤各1件(1.3%)であった。全身性の副作用は2例(2.7%)にγ-GTP上昇が認められた。
17.1.2 国内第III相臨床試験(軟膏の長期外用試験、長期外用継続試験)
尋常性乾癬患者128例を対象にマキサカルシトール軟膏を1日2回(1回も可)、適量(1回最高量7g)注)、26週間連日外用した長期外用試験8)において、外用開始後から速やかな治療効果を認め、長期間その効果が維持されたことより、有用性が認められた。
安全性解析対象例127例において、局所性の副作用は16例(12.6%)に18件認められた。主な副作用は、刺激感、そう痒各5件(3.9%)、鱗屑、発赤各2件(1.6%)等であった。全身性の副作用は14例(11.0%)に18件認められた。主な副作用は、血清カルシウム上昇7件(5.5%)、γ-GTP上昇3件(2.4%)、ALT上昇2件(1.6%)等であった。
また、長期外用試験完了例で継続同意が得られた46例を対象に、長期外用試験終了後さらに26週間連日外用した長期外用継続試験9)においても、効果の継続が確認された。
安全性解析対象例46例において、局所性の副作用は3例(6.5%)に5件認められた。副作用の内訳は、鱗屑が2件(4.3%)、そう痒、発赤、刺激感が各1件(2.2%)であった。全身性の副作用は9例(19.6%)に11件認められた。主な副作用は、血清カルシウム上昇4件(8.7%)、骨型ALP上昇2件(4.3%)等であった。
安全性解析対象例127例において、局所性の副作用は16例(12.6%)に18件認められた。主な副作用は、刺激感、そう痒各5件(3.9%)、鱗屑、発赤各2件(1.6%)等であった。全身性の副作用は14例(11.0%)に18件認められた。主な副作用は、血清カルシウム上昇7件(5.5%)、γ-GTP上昇3件(2.4%)、ALT上昇2件(1.6%)等であった。
また、長期外用試験完了例で継続同意が得られた46例を対象に、長期外用試験終了後さらに26週間連日外用した長期外用継続試験9)においても、効果の継続が確認された。
安全性解析対象例46例において、局所性の副作用は3例(6.5%)に5件認められた。副作用の内訳は、鱗屑が2件(4.3%)、そう痒、発赤、刺激感が各1件(2.2%)であった。全身性の副作用は9例(19.6%)に11件認められた。主な副作用は、血清カルシウム上昇4件(8.7%)、骨型ALP上昇2件(4.3%)等であった。
<魚鱗癬群、掌蹠角化症>
17.1.3 国内第III相臨床試験(軟膏の一般臨床試験)
魚鱗癬群患者21例、掌蹠角化症患者29例を対象にマキサカルシトール軟膏を1日2回(1回も可)、適量(1回最高量7g)注)、8週間連日外用した一般臨床試験10)における全般改善度は、「著明改善」以上の部位数が魚鱗癬群61.9%(13/21例)、掌蹠角化症28.6%(8/28例)であり、「中等度改善」以上の部位数が魚鱗癬群81.0%(17/21例)、掌蹠角化症67.9%(19/28例)であった。
局所性の副作用は、魚鱗癬群患者では安全性解析対象例21例において1例(4.8%)に2件認められ、副作用の内訳はそう痒、発赤が各1件(4.8%)であった。掌蹠角化症患者では安全性解析対象例29例において5例(17.2%)に8件認められ、主な副作用はそう痒3件(10.3%)、刺激感2件(6.9%)等であった。全身性の副作用は、魚鱗癬群患者では2例(9.5%)に3件認められ、副作用の内訳はAST上昇、血清アルブミン低下、尿蛋白陽性が各1件(4.8%)であった。掌蹠角化症患者では1例(3.4%)に2件認められ、副作用の内訳はウロビリノゲン陽性、尿蛋白陽性が各1件(3.4%)であった。
局所性の副作用は、魚鱗癬群患者では安全性解析対象例21例において1例(4.8%)に2件認められ、副作用の内訳はそう痒、発赤が各1件(4.8%)であった。掌蹠角化症患者では安全性解析対象例29例において5例(17.2%)に8件認められ、主な副作用はそう痒3件(10.3%)、刺激感2件(6.9%)等であった。全身性の副作用は、魚鱗癬群患者では2例(9.5%)に3件認められ、副作用の内訳はAST上昇、血清アルブミン低下、尿蛋白陽性が各1件(4.8%)であった。掌蹠角化症患者では1例(3.4%)に2件認められ、副作用の内訳はウロビリノゲン陽性、尿蛋白陽性が各1件(3.4%)であった。
<掌蹠膿疱症>
17.1.4 国内第III相臨床試験(軟膏の比較臨床試験)
中等症以上の掌蹠膿疱症患者を対象に1日2回、適量(軟膏として1日10gまで)、8週間塗擦した比較臨床試験11)において、軟膏投与群(94例)の最終評価時の皮膚所見合計スコア変化量は−3.7であり、プラセボ投与群(93例)の−1.9に比し、有意なスコアの低下が認められた(p<0.0001)。
安全性解析対象例188例において、副作用は軟膏投与群では95例中11例(11.6%)に認められた。
安全性解析対象例188例において、副作用は軟膏投与群では95例中11例(11.6%)に認められた。
注)本剤の1日最大使用量は10gである。
18. 薬効薬理
18.1 作用機序
18.2 受容体親和性
18.3 表皮角化細胞に対する増殖抑制作用
18.4 表皮角化細胞に対する分化誘導作用
18.5 サイトカイン、リンパ球等に対する作用
19. 有効成分に関する理化学的知見
19.1. マキサカルシトール
22. 包装
1本[10g(チューブ)×1]
10本[10g(チューブ)×10]
50本[10g(チューブ)×50]
23. 主要文献
- 患者における血清中の有働(オキサロール軟膏:2001年6月20日承認、申請資料概要ヘ.3.(2))
- 血清中濃度推移(オキサロール軟膏:2001年6月20日承認、申請資料概要ヘ.3.(3).1)
- Umemura K.,et al., Int.J.Clin.Pharmacol.Ther., 46 (6), 289-294, (2008) »PubMed
- 代謝酵素(オキサロール軟膏:2001年6月20日承認、申請資料概要ヘ.2.(7).1))
- 岩城製薬株式会社 社内資料(生物学的同等性試験)
- 岩城製薬株式会社 社内資料(暴露量試験)
- OCT軟膏研究会, 医学のあゆみ, 194 (11), 887-904, (2000)
- 尋常性乾癬患者を対象とした長期外用試験(オキサロール軟膏:2001年6月20日承認、申請資料概要ト.2.(5)1))
- 尋常性乾癬患者を対象とした長期外用継続試験(オキサロール軟膏:2001年6月20日承認、申請資料概要ト.2.(5)2))
- 角化異常症患者を対象とした第III相一般臨床試験(オキサロール軟膏:2001年6月20日承認、申請資料概要ト.2.(4)2))
- 掌蹠膿疱症患者を対象とした第III相臨床試験(オキサロール軟膏、ローション:2008年11月25日承認、審査報告書)
- 薬理作用試験(ケラチノサイトの増殖抑制)(オキサロール軟膏:2001年6月20日承認、申請資料概要ホ.2.(1))
- Kondo S.,et al., Arch.Dermatol.Res., 292 (11), 550-555, (2000) »PubMed
- 尋常性乾癬患者を対象とした臨床薬理試験(オキサロール軟膏:2001年6月20日承認、申請資料概要ト.2.(6))
- 薬理作用試験(ケラチノサイトの分化促進)(オキサロール軟膏:2001年6月20日承認、申請資料概要ホ.2.(2))
- Komine M.,et al., Arch.Dermatol.Res., 291 (9), 500-506, (1999) »PubMed
- 薬理作用試験(ビタミンD受容体に対する親和性)(オキサロール軟膏:2001年6月20日承認、申請資料概要ホ.1.(3))
- 薬理作用試験(ビタミンD結合蛋白に対する結合能)(オキサロール軟膏:2001年6月20日承認、申請資料概要ホ.1.(1))
- 薬理作用試験(ケラチノサイト核内への移行)(オキサロール軟膏:2001年6月20日承認、申請資料概要ホ.1.(4))
24. 文献請求先及び問い合わせ先
文献請求先
岩城製薬株式会社
マーケティング部 学術グループ
〒103-8434
東京都中央区日本橋本町4-8-2
電話:03-6626-6251
FAX:03-6626-6261
製品情報問い合わせ先
岩城製薬株式会社
マーケティング部 学術グループ
〒103-8434
東京都中央区日本橋本町4-8-2
電話:03-6626-6251
FAX:03-6626-6261
26. 製造販売業者等
26.1 製造販売元
岩城製薬株式会社
東京都中央区日本橋本町4-8-2