医薬品情報
| 総称名 | アミカシン硫酸塩 |
|---|---|
| 一般名 | アミカシン硫酸塩 |
| 欧文一般名 | Amikacin Sulfate |
| 薬効分類名 | アミノグリコシド系抗生物質製剤 |
| 薬効分類番号 | 6123 |
| ATCコード | D06AX12 J01GB06 |
| KEGG DRUG |
D00865
アミカシン硫酸塩
|
| KEGG DGROUP |
DG01447
アミノグリコシド系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年12月 改訂(第2版)

|
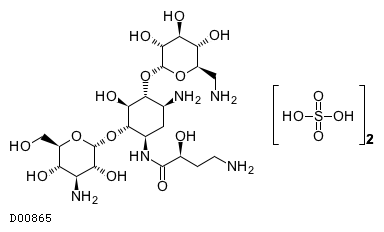
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アミカシン硫酸塩注100mg「NP」 | ニプロ | 6123402A1192 | 453円/管 | 処方箋医薬品注) | |
| アミカシン硫酸塩注200mg「NP」 | ニプロ | 6123402A3195 | 686円/管 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分並びにアミノグリコシド系抗生物質又はバシトラシンに対し過敏症の既往歴のある患者[8.1.1参照]
4. 効能または効果
<適応菌種>
<適応症>
敗血症、外傷・熱傷及び手術創等の二次感染、肺炎、肺膿瘍、慢性呼吸器病変の二次感染、膀胱炎、腎盂腎炎、腹膜炎
6. 用法及び用量
<筋肉内投与の場合>
通常、成人1回アミカシン硫酸塩として100〜200mg(力価)を1日1〜2回筋肉内投与する。小児は、アミカシン硫酸塩として1日4〜8mg(力価)/kgとし、1日1〜2回筋肉内投与する。
なお、年齢及び症状により適宜増減する。
なお、年齢及び症状により適宜増減する。
<点滴静脈内投与の場合>
通常、成人1回アミカシン硫酸塩として100〜200mg(力価)を、1日2回点滴静脈内投与する。小児は、アミカシン硫酸塩として1日4〜8mg(力価)/kgとし、1日2回点滴静脈内投与する。また、新生児(未熟児を含む)は、1回アミカシン硫酸塩として6mg(力価)/kgを、1日2回点滴静脈内投与する。
なお、年齢、体重及び症状により適宜増減する。
点滴静脈内投与の場合には、通常100〜500mLの補液中に100〜200mg(力価)の割合で溶解し、30分〜1時間かけて投与すること。
なお、年齢、体重及び症状により適宜増減する。
点滴静脈内投与の場合には、通常100〜500mLの補液中に100〜200mg(力価)の割合で溶解し、30分〜1時間かけて投与すること。
7. 用法及び用量に関連する注意
7.1 1回投与量を調節する方法
体重及びクレアチニン・クリアランスを用い、図1又は計算式より求めた初回量及び維持量を投与する1)。
図1 8時間及び12時間ごと投与図
| 初回量(mg) | DL=D・W/5.0×104[(Ccr+132)2−1700] |
| 維持量(mg) | DM=D・W/101(Ccr+0.7) |
| 初回量(mg) | DL=D・W/4.3×104[(Ccr+125)2−6700] |
| 維持量(mg) | DM=D・W/101(Ccr+0.7) |
D:腎機能正常者に対する使用量(mg/kg)、W:体重(kg)
Ccr:クレアチニン・クリアランス(mL/min)
7.2 投与間隔を調節する方法
「血清クレアチニン値×9」時間ごとに通常量を投与する。
8. 重要な基本的注意
8.1 本剤によるショック、アナフィラキシーの発生を確実に予知できる方法がないので、次の措置をとること。[11.1.1参照]
8.1.1 事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。[2.参照]
8.1.2 投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
8.1.3 投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に、投与開始直後は注意深く観察すること。
8.2 眩暈、耳鳴、難聴等の第8脳神経障害があらわれることがあるので慎重に投与すること。特に腎機能障害患者、高齢者、長期間投与患者及び大量投与患者等では血中濃度が高くなりやすく、聴力障害の危険性がより大きくなるので、聴力検査を実施することが望ましい。アミノグリコシド系抗生物質の聴力障害は、高周波音に始まり低周波音へと波及するので、障害の早期発見のために、聴力検査の最高周波数である8kHzでの検査が有用である。[7.、9.2、9.8.1、11.1.2参照]
8.4 投与後は血中濃度をモニタリングすることが望ましい。
8.5 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 本人又はその血族がアミノグリコシド系抗生物質による難聴又はその他の難聴のある患者
難聴が発現又は増悪するおそれがある。
9.1.2 重症筋無力症の患者
神経筋遮断作用があり呼吸抑制があらわれることがある。
9.1.3 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
観察を十分に行うこと。ビタミンK欠乏症状があらわれることがある。
9.2 腎機能障害患者
投与量を減らすか、投与間隔をあけて投与すること。高い血中濃度が持続し、腎障害が悪化するおそれがあり、また、第8脳神経障害等の副作用が強くあらわれるおそれがある。[7.、8.2参照]
9.3 肝機能障害患者
肝障害を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。アミカシン硫酸塩はヒト胎盤を通過する。新生児に第8脳神経障害があらわれるおそれがある。[16.3.1参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.8 高齢者
10. 相互作用
10.2 併用注意
| 腎障害を起こすおそれのある血液代用剤 デキストラン ヒドロキシエチルデンプン 等 | 腎障害が発現、悪化することがあるので、併用は避けることが望ましい。 腎障害が発生した場合には、投与を中止し、透析療法等適切な処置を行うこと。 | 機序は明確でないが、併用によりアミノグリコシド系抗生物質の血中への蓄積、近位尿細管上皮の空胞変性が生じるという報告がある。 |
| ループ利尿剤 フロセミド アゾセミド トラセミド 等 | 腎障害及び聴器障害が発現、悪化するおそれがあるので、併用は避けることが望ましい。 | 機序は明確でないが、併用によりアミノグリコシド系抗生物質の血中濃度の上昇、腎への蓄積が起こるという報告がある。 |
| 腎毒性及び聴器毒性を有する薬剤 バンコマイシン塩酸塩 エンビオマイシン硫酸塩 白金含有抗悪性腫瘍剤(シスプラチン、カルボプラチン、ネダプラチン) 等 | 腎障害及び聴器障害が発現、悪化するおそれがあるので、併用は避けることが望ましい。 | 両薬剤ともに腎毒性、聴器毒性を有するが、相互作用の機序は不明。 |
| 麻酔剤 筋弛緩剤 ロクロニウム臭化物 A型ボツリヌス毒素製剤 等 コリスチンメタンスルホン酸ナトリウム | 呼吸抑制があらわれるおそれがある。呼吸抑制があらわれた場合には必要に応じ、コリンエステラーゼ阻害剤、カルシウム製剤の投与等の適切な処置を行うこと。 | 両薬剤ともに神経筋遮断作用を有しており、併用によりその作用が増強される。 |
| 腎毒性を有する薬剤 シクロスポリン アムホテリシンB 等 | 腎障害が発現、悪化するおそれがある。 | 両薬剤ともに腎毒性を有するが、相互作用の機序は不明。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(0.1%未満)
初期症状として、不快感、口内異常感、喘鳴、眩暈、便意、耳鳴、発汗等があらわれることがある。[8.1参照]
11.1.2 第8脳神経障害(0.1〜5%未満)
耳鳴・耳閉塞感・耳痛・眩暈・難聴等の第8脳神経障害(主として蝸牛機能障害)があらわれることがある。[8.2参照]
11.1.3 急性腎障害(頻度不明)
重篤な腎障害があらわれることがある。[8.3参照]
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | そう痒、発熱 | |
| 腎臓 | 浮腫、蛋白尿、血尿、血清クレアチニン上昇、BUN上昇、乏尿 | カリウム等の電解質異常 | |
| 肝臓 | AST上昇、ALT上昇 | Al-P上昇 | |
| 血液 | 白血球減少、好酸球増多 | ||
| 消化器 | 下痢、悪心・嘔吐 | ||
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等) | ||
| 投与部位(筋注の場合) | 注射部位の疼痛、硬結 | ||
| その他 | 頭痛、口唇部のしびれ感 |
13. 過量投与
13.1 症状
腎障害、聴覚障害、前庭障害、神経筋遮断症状、呼吸麻痺があらわれることがある。
13.2 処置
血液透析、腹膜透析による薬剤の除去を行う。神経筋遮断症状、呼吸麻痺に対してはコリンエステラーゼ阻害剤、カルシウム製剤の投与又は機械的呼吸補助を行う。
14. 適用上の注意
14.1 薬剤投与時の注意
<投与経路共通>
14.1.1 β-ラクタム系抗生物質製剤と本剤との混注により、両剤ともに不活性化されるとの報告がある。それぞれ別経路にて投与を行うこと。
<筋肉内投与>
14.1.2 下記の点に注意すること。
(1)やむを得ない場合にのみ必要最小限に行うこと。
(2)同一部位への反復注射は行わないこと。
(3)神経走行部位を避けること。
(4)注射針を刺入したとき、激痛を訴えたり、血液の逆流をみた場合は直ちに針を抜き、部位をかえて注射すること。
(5)注射部位に疼痛、硬結をみることがある。
<点滴静脈内投与>
14.1.3 副作用発生を防ぐため、必ず30分以上かけて投与すること。
15. その他の注意
15.1 臨床使用に基づく情報
クエン酸で抗凝固処理した血液を大量輸血された患者にアミノグリコシド系抗生物質を投与すると、投与経路にかかわらず、神経筋遮断症状、呼吸麻痺があらわれることがある。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人にアミカシン硫酸塩100mg(力価)又は200mg(力価)を筋注した場合、血中濃度のピークは30分ないし1時間後にあり、それぞれ5.8〜8.5μg/mL(n=3)、13.5〜15.0μg/mL(n=2)を示した。
また、健康成人(n=6)に100mg(力価)又は200mg(力価)を1時間で点滴静注した場合、血中濃度のピークは点滴終了時にあり、それぞれ7.5〜8.6μg/mL、13.9〜18.8μg/mLを示し、血中半減期(t1/2)は、1.7〜2.2時間である(図1)。
なお、健康成人(n=3)に200mg(力価)をCross overにより筋注及び点滴静注した場合、両者の血中濃度推移は図2のとおりほぼ一致し、t1/2、血中濃度曲線下面積(AUC)もほぼ同一の値を示す4)5)6)。
また、健康成人(n=6)に100mg(力価)又は200mg(力価)を1時間で点滴静注した場合、血中濃度のピークは点滴終了時にあり、それぞれ7.5〜8.6μg/mL、13.9〜18.8μg/mLを示し、血中半減期(t1/2)は、1.7〜2.2時間である(図1)。
なお、健康成人(n=3)に200mg(力価)をCross overにより筋注及び点滴静注した場合、両者の血中濃度推移は図2のとおりほぼ一致し、t1/2、血中濃度曲線下面積(AUC)もほぼ同一の値を示す4)5)6)。
図1 健康成人での点滴静注時の血中濃度
図2 健康成人での筋注・点滴静注時の血中濃度
16.1.2 生物学的同等性試験
アミカシン硫酸塩注100mg「NP」とビクリン注射液のそれぞれ1mL[アミカシン硫酸塩として100mg(力価)]を、クロスオーバー法により健康成人男子に絶食時に単回筋肉内投与して血漿中アミカシン硫酸塩濃度を測定した。得られた薬物動態パラメータ(AUC0→6hr、Cmax)の平均値の差の95%信頼区間は±20%の範囲にあり、両剤の生物学的同等性が確認された7)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→6hr(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | t1/2(hr) | |
| アミカシン硫酸塩注100mg「NP」 | 18.00±1.98 | 7.08±0.87 | 0.58±0.24 | 1.83±0.21 |
| ビクリン注射液 | 17.71±2.22 | 6.78±0.78 | 0.53±0.28 | 2.00±0.40 |
血漿中アミカシン硫酸塩濃度推移
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.4 代謝
アミカシン硫酸塩は生体内で代謝を受けない11)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内二重盲検比較試験
急性単純性膀胱炎の患者に対しアミカシン硫酸塩(AMK)及びベカナマイシン硫酸塩(AKM)それぞれ200mg(力価)を1日1回3日間、筋肉内注射にて投与する二重盲検比較試験において、AMK投与49例では著効38例、有効8例で有効率93.9%(46/49例)であり、アミカシン硫酸塩の有用性が示された。また、AKM投与56例では著効38例、有効15例で有効率94.6%(53/56例)であり、両群間に有意差を認めなかった。AMK投与群において副作用は3例に認められ、耳鳴(1/49例)、発熱(1/49例)、注射部位疼痛(1/49例)であった12)。
17.1.2 国内二重盲検比較試験
急性腎盂腎炎の患者に対しアミカシン硫酸塩(AMK)及びベカナマイシン硫酸塩(AKM)それぞれ200mg(力価)を1日1回7日間、筋肉内注射にて投与する二重盲検比較試験において、AMK投与21例では著効14例、有効7例で有効率100.0%(21/21例)であり、アミカシン硫酸塩の有用性が示された。また、AKM投与19例では著効11例、有効6例で有効率89.5%であり、両群間に有意差を認めなかった。AMK投与群において副作用は5例に認められたが全て注射部疼痛(5/21例)であった12)。
17.1.3 国内二重盲検比較試験
膀胱・前立腺手術後(留置カテーテル抜去後)尿路感染症及び複雑性尿路感染症の患者に対しアミカシン硫酸塩(AMK)及びベカナマイシン硫酸塩(AKM)それぞれ200mg(力価)を1日2回7日間、筋肉内注射にて投与する二重盲検比較試験において、AMK投与31例では著効5例、有効16例で有効率67.7%(21/31例)、AKM投与37例では著効2例、有効12例で有効率37.8%であり、AMK投与群の方が有意差をもって有用であった。なお、AMK投与群において副作用は認められなかった12)。
注)疾患名・菌種名は承認申請資料に基づき記載している。
18. 薬効薬理
18.1 作用機序
細菌の蛋白合成を阻害することにより細胞分裂の増殖のプロセスを阻止し、殺菌的に作用する13)。
18.2 抗菌作用
18.3 不活化酵素に対する安定性
アミノグリコシド系抗生物質を不活化する種々の酵素に対して強い抵抗を示す15)。
18.4 交差耐性
19. 有効成分に関する理化学的知見
19.1. アミカシン硫酸塩
22. 包装
<アミカシン硫酸塩注100mg「NP」>
1mL×10管[アンプル]
<アミカシン硫酸塩注200mg「NP」>
2mL×10管[アンプル]
23. 主要文献
- 山路武久 他, 臨床と細菌, 7 (4), 457-461, (1980)
- 秋吉正豊 他, Jpn.J.Antibiot., 28 (3), 288-304, (1975) »PubMed
- 松崎明紀 他, Jpn.J.Antibiot., 28 (4), 415-434, (1975) »PubMed
- 大久保滉 他, Jpn.J.Antibiot., 28 (3), 283-287, (1975) »PubMed
- 桧垣昌夫 他, 泌尿紀要, 28 (3), 345-360, (1982)
- 沢江義郎 他, Jpn.J.Antibiot., 33 (4), 539-548, (1980) »PubMed
- 社内資料:生物学的同等性試験
- 岩沢武彦 他, Chemother., 23 (6), 2175-2189, (1975) »DOI
- 松本慶蔵 他, Chemother., 23 (6), 2073-2079, (1975) »DOI
- 松田静治 他, Jpn.J.Antibiot., 27 (5), 633-636, (1974) »PubMed
- 第十八改正日本薬局方解説書, C-270-C-272, (2021)
- 熊沢浄一 他, 西日泌尿, 37 (3), 452-505, (1975)
- 第十八改正日本薬局方解説書, C-266-C-270, (2021)
- Kawaguchi H.,et al., J.Antibiot., 25 (12), 695-708, (1972) »PubMed
- Price,K.E.,et al., Antimicrob.Agents & Chemother., 5 (2), 143-152, (1974)
24. 文献請求先及び問い合わせ先
文献請求先
ニプロ株式会社
医薬品情報室
〒566-8510
大阪府摂津市千里丘新町3番26号
電話:0120-226-898
FAX:050-3535-8939
製品情報問い合わせ先
ニプロ株式会社
医薬品情報室
〒566-8510
大阪府摂津市千里丘新町3番26号
電話:0120-226-898
FAX:050-3535-8939
26. 製造販売業者等
26.1 製造販売元
ニプロ株式会社
大阪府摂津市千里丘新町3番26号