医薬品情報
| 総称名 | レグテクト |
|---|---|
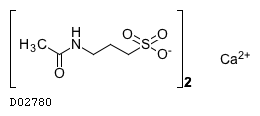
| 一般名 | アカンプロサートカルシウム |
| 欧文一般名 | Acamprosate calcium |
| 製剤名 | アカンプロサートカルシウム錠 |
| 薬効分類名 | アルコール依存症 断酒補助剤 |
| 薬効分類番号 | 1190 |
| ATCコード | N07BB03 |
| KEGG DRUG |
D02780
アカンプロサートカルシウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2020年8月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| レグテクト錠333mg | Regtect Tablets | 日本新薬 | 1190022H1020 | 34.2円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 重度の腎機能障害のある患者[9.2.1参照]
4. 効能または効果
アルコール依存症患者における断酒維持の補助
5. 効能または効果に関連する注意
5.1 アルコール依存症の診断は、国際疾病分類等の適切な診断基準に基づき慎重に実施し、基準を満たす場合にのみ使用すること。
5.2 心理社会的治療と併用すること。
5.3 断酒の意志がある患者にのみ使用すること。
5.4 離脱症状がみられる患者では、離脱症状に対する治療を終了してから使用すること。[本剤は離脱症状の治療剤ではない。]
6. 用法及び用量
通常、成人にはアカンプロサートカルシウムとして666mgを1日3回食後に経口投与する。
7. 用法及び用量に関連する注意
7.1 本剤の吸収は食事の影響を受けやすく、有効性及び安全性は食後投与により確認されているため、食後に服用するよう指導すること。[空腹時に投与すると、食後投与と比較して血中濃度が上昇するおそれがある。][16.2.1参照]
7.2 本剤の投与期間は原則として24週間とすること。治療上の有益性が認められる場合にのみ投与期間を延長できるが、定期的に本剤の投与継続の要否について検討し、本剤を漫然と投与しないこと。[国内臨床試験では、24週間の投与による有効性及び安全性が確認されている。][17.1.1参照]
8. 重要な基本的注意
8.1 本剤は、アルコール依存症の治療に対して十分な知識・経験を持つ医師のもとで、投与すること。
8.2 本剤との因果関係は明らかではないが、自殺念慮、自殺企図等が報告されているので、本剤を投与する際には患者の状態を十分に観察するとともに、関連する症状があらわれた場合には、本剤の投与を中止するなど適切な処置を行うこと。
8.3 患者及びその家族等に自殺念慮、自殺企図等の行動の変化があらわれることのリスク等について十分説明を行い、医師と緊密に連絡を取り合うよう指導すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 自殺念慮又は自殺企図の既往のある患者、自殺念慮のある患者
自殺念慮、自殺企図があらわれることがある。
9.2 腎機能障害患者
9.2.1 重度の腎機能障害のある患者
9.2.2 中等度の腎機能障害のある患者
減量を考慮するとともに、患者の状態を観察しながら慎重に投与すること。排泄遅延により血中濃度が上昇するおそれがある。[16.6.1参照]
9.2.3 軽度の腎機能障害のある患者
排泄遅延により血中濃度が上昇するおそれがある。
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者
重度の肝機能障害のある患者を対象とした臨床試験は実施していない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量を考慮するとともに、患者の状態を観察しながら慎重に投与すること。血中濃度が上昇するおそれがある。[16.6.3参照]
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
全身性皮疹、発疹、蕁麻疹、口内炎、喉頭痙攣、息切れ等の症状を伴うアナフィラキシーがあらわれることがある。
11.1.2 血管浮腫(頻度不明)
舌腫脹、リンパ節腫脹等の症状を伴う血管浮腫があらわれることがある。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 精神神経系 | 傾眠 | 不安、頭痛、精神運動亢進 | ||
| 消化器 | 下痢(14.1%) | 腹部膨満、嘔吐 | 便秘、悪心、鼓腸、過敏性腸症候群、口内炎 | 腹痛 |
| 肝臓 | γ-GTP増加 | |||
| 皮膚 | 湿疹、乾癬 | 蕁麻疹、そう痒症、斑状丘疹状皮疹 | ||
| その他 | 浮腫、末梢性浮腫 | 不感症、勃起不全、リビドー減退・亢進 |
13. 過量投与
13.1 症状
主な症状は下痢であると考えられる。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は腸溶性のフィルムコーティング錠であるため、かんだり、割ったり、砕いたりせずにそのまま服用するよう指導すること。
15. その他の注意
15.1 臨床使用に基づく情報
海外で実施されたアルコール依存症患者を対象とした本剤の計11のプラセボ対照臨床試験において、自殺念慮、自殺企図等の自殺関連有害事象の発現割合は、短期投与試験(90日〜6ヵ月)で本剤群1.4%(19/1317例)、プラセボ群0.5%(6/1186例)、長期投与試験(48週〜12ヵ月)で本剤群2.4%(17/702例)、プラセボ群0.8%(4/520例)であり、相対リスク比は、短期投与試験で2.85(95%信頼区間:1.14-7.12)、長期投与試験で3.15(95%信頼区間:1.07-9.30)であった。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性(各10例)に本剤333〜1998mgを絶食下注)で単回経口投与した場合、血漿中未変化体濃度は4.4〜6.8時間で最高に達し、14.9〜20.4時間の半減期で消失した。血漿中濃度は用量増加とともに上昇し、AUC0-∞は用量にほぼ比例して増加した1)。
健康成人男性に本剤を経口投与した後の血漿中未変化体濃度推移(各点は10例の平均値)
| Dose(mg) | 例数 | Cmax(ng/mL) | tmax(hr) | t1/2,β(hr) | AUC0-∞(ng・hr/mL) |
| 333 | 10 | 123±45 | 4.40±0.70 | 16.9±5.9 | 1650±620 |
| 666 | 10 | 293±174 | 5.30±1.83 | 14.9±8.8 | 3760±1410 |
| 1332 | 10 | 290±120 | 6.80±3.43 | 20.4±15.1 | 8400±3890 |
| 1998 | 10 | 443±207 | 5.20±2.74 | 19.8±15.4 | 10700±5600 |
16.1.2 反復投与
本剤を健康成人男性10例に食後反復経口投与(666mgを1日3回)した場合、反復投与2日目からほぼ一定の血漿中濃度を示し、速やかに定常状態に達すると推察された2)。
16.2 吸収
16.2.1 食事の影響
16.3 分布
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 肝機能障害患者
軽度から中等度の肝機能障害患者(Child-Pugh分類:A群、B群)と健康成人(各6例)に本剤を絶食下注)で反復経口投与(666mgを1日3回)し、薬物動態パラメータを比較した。肝機能障害患者と健康成人の薬物動態に差は認められなかった9)(外国人データ)。
16.6.3 高齢者
注)本剤の承認された用法及び用量は、「通常、成人にはアカンプロサートカルシウムとして666mgを1日3回食後に経口投与する。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相プラセボ対照二重盲検比較試験
断酒意志があり、心理社会的治療を併用するアルコール依存症患者(327例)を対象として、本剤666mgを1日3回(1998mg/日)又はプラセボを24週間食後に経口投与した。その後、24週間の追跡観察期間を設けた。
その結果、投与期間の完全断酒率は、本剤群47.2%(77/163例)、プラセボ群36.0%(59/164例)であり、本剤のプラセボに対する優越性が示された。
その結果、投与期間の完全断酒率は、本剤群47.2%(77/163例)、プラセボ群36.0%(59/164例)であり、本剤のプラセボに対する優越性が示された。
| 投与群 | 完全断酒率 | 完全断酒率の差(95%信頼区間) | χ2検定 |
| 本剤群 | 47.2%(77/163例) | 11.3%(0.6〜21.9) | P=0.0388 |
| プラセボ群 | 36.0%(59/164例) |
18. 薬効薬理
18.1 作用機序
ラット大脳皮質初代培養神経細胞へのエタノールの持続曝露は、グルタミン酸刺激により誘発される細胞外への乳酸脱水素酵素の漏出を更に増大させ、アカンプロサートカルシウムはこの反応を抑制した12)。エタノール蒸気を吸入させたラットの依存モデルで、アカンプロサートカルシウムはエタノールからの離脱による側坐核及び海馬灌流液中のグルタミン酸量の増加を抑制した13)14)。
エタノール依存では中枢神経系の主要な興奮性神経であるグルタミン酸作動性神経の活動が亢進し、興奮性神経伝達と抑制性神経伝達の間に不均衡が生じると考えられている。アカンプロサートカルシウムの作用機序は明確でないものの、エタノール依存で亢進したグルタミン酸作動性神経活動を抑制することで神経伝達の均衡を回復し、エタノールの自発摂取抑制や報酬効果抑制につながると推察されている15)16)17)。
エタノール依存では中枢神経系の主要な興奮性神経であるグルタミン酸作動性神経の活動が亢進し、興奮性神経伝達と抑制性神経伝達の間に不均衡が生じると考えられている。アカンプロサートカルシウムの作用機序は明確でないものの、エタノール依存で亢進したグルタミン酸作動性神経活動を抑制することで神経伝達の均衡を回復し、エタノールの自発摂取抑制や報酬効果抑制につながると推察されている15)16)17)。
18.2 エタノールの精神依存モデルに対する作用
19. 有効成分に関する理化学的知見
19.1. アカンプロサートカルシウム
22. 包装
100錠[10錠(PTP)×10]、500錠[10錠(PTP)×50]、500錠[瓶、バラ]
23. 主要文献
- 国内第I相単回経口投与試験(承認年月日:2013年3月25日、CTD 2.7.6.3)
- 国内第I相反復経口投与試験(承認年月日:2013年3月25日、CTD 2.7.6.4)
- 静脈内投与時の薬物動態及び排泄パラメータの検討(承認年月日:2013年3月25日、CTD 2.7.6.7)
- 単回及び反復経口投与時の薬物動態及び絶対的BAの検討(承認年月日:2013年3月25日、CTD 2.7.6.6)
- 14C-アカンプロサートカルシウムのin vitroタンパク結合試験(承認年月日:2013年3月25日、CTD 2.7.2.2.1(2))
- 14C-アカンプロサートカルシウム投与後のヒト代謝物の検討(承認年月日:2013年3月25日、CTD 2.7.2.2.1(3))
- In vitroにおけるヒトチトクロームP-450(CYP)阻害及び酵素誘導試験(承認年月日:2013年3月25日、CTD 2.7.2.2.1(3))
- 腎障害患者における薬物動態の検討(承認年月日:2013年3月25日、CTD 2.7.6.15)
- 肝障害患者における薬物動態の検討(承認年月日:2013年3月25日、CTD 2.7.6.14)
- 国内第I相高齢者反復経口投与試験(承認年月日:2013年3月25日、CTD 2.7.6.12)
- 国内第III相試験(承認年月日:2013年3月25日、CTD 2.7.6.28)
- グルタミン酸作動性神経活動に対する作用(承認年月日:2013年3月25日、CTD 2.6.2.2.1)
- Dahchour A,et al., Psychiatry Res., 82 (2), 107-14, (1998) »PubMed
- Dahchour A,et al., Alcohol Clin Exp Res., 27 (3), 465-70, (2003) »PubMed
- De Witte P,, Addict Behav., 29 (7), 1325-39, (2004) »PubMed
- Gass JT,et al., Biochem Pharmacol., 75 (1), 218-65, (2008) »PubMed
- Olive MF,et al., Pharmacol Biochem Behav., 100 (4), 801-10, (2012) »PubMed
- エタノールの自発摂取に対する作用(承認年月日:2013年3月25日、CTD 2.6.2.2.3)
- エタノールの報酬効果に対する作用(承認年月日:2013年3月25日、CTD 2.6.2.2.4)
24. 文献請求先及び問い合わせ先
文献請求先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル 0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
製品情報問い合わせ先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル 0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
26. 製造販売業者等
26.1 製造販売元
日本新薬株式会社
京都市南区吉祥院西ノ庄門口町14