医薬品情報
| 総称名 | イノベロン |
|---|---|
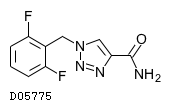
| 一般名 | ルフィナミド |
| 欧文一般名 | Rufinamide |
| 製剤名 | ルフィナミド製剤 |
| 薬効分類名 | 抗てんかん剤 |
| 薬効分類番号 | 1139 |
| ATCコード | N03AF03 |
| KEGG DRUG |
D05775
ルフィナミド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年11月 改訂(承認条件削除)(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| イノベロン錠100mg | Inovelon tablets | エーザイ | 1139012F1023 | 83.2円/錠 | 処方箋医薬品注) |
| イノベロン錠200mg | Inovelon tablets | エーザイ | 1139012F2020 | 136.1円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分又はトリアゾール誘導体に対し過敏症の既往歴のある患者
4. 効能または効果
他の抗てんかん薬で十分な効果が認められないLennox-Gastaut症候群における強直発作及び脱力発作に対する抗てんかん薬との併用療法
6. 用法及び用量
4歳以上の小児
体重15.0〜30.0kgの場合
通常、ルフィナミドとして、最初の2日間は1日200mgを1日2回に分けて食後に経口投与し、その後は2日ごとに1日用量として200mg以下ずつ漸増する。維持用量は1日1000mgとし、1日2回に分けて食後に経口投与する。なお、症状により、1日1000mgを超えない範囲で適宜増減するが、増量は2日以上の間隔をあけて1日用量として200mg以下ずつ行うこと。
体重30.1kg以上の場合
成人の用法・用量に従う。
成人
通常、ルフィナミドとして、最初の2日間は1日400mgを1日2回に分けて食後に経口投与し、その後は2日ごとに1日用量として400mg以下ずつ漸増する。維持用量は体重30.1〜50.0kgの患者には1日1800mg、体重50.1〜70.0kgの患者には1日2400mg、体重70.1kg以上の患者には1日3200mgとし、1日2回に分けて食後に経口投与する。なお、症状により維持用量を超えない範囲で適宜増減するが、増量は2日以上の間隔をあけて1日用量として400mg以下ずつ行うこと。
参考
| 4歳以上の小児 | 4歳以上の小児及び成人 | |||
| 体重 | 15.0〜30.0kg | 30.1〜50.0kg | 50.1〜70.0kg | 70.1kg以上 |
| 1・2日目 | 200mg/日 | 400mg/日 | ||
| 3日目以降 | 2日間毎に200mg以下ずつ漸増する。 | 2日間毎に400mg以下ずつ漸増する。 | ||
| 維持用量 | 1000mg/日 | 1800mg/日 | 2400mg/日 | 3200mg/日 |
7. 用法及び用量に関連する注意
7.1 本剤は他の抗てんかん薬と併用して使用すること。国内臨床試験において、本剤単独投与での使用経験はない。
8. 重要な基本的注意
8.1 本剤の投与によりてんかん重積状態があらわれることがあるので、本剤投与中は患者の状態を十分に観察し、てんかん重積状態が生じた場合には適切な処置を行うこと。また、本剤投与後に新たな発作型の出現又はてんかん重積状態の頻度の増加が認められた場合には、本剤投与継続の必要性を慎重に判断すること。
8.2 連用中における投与量の急激な減量ないし投与中止により、てんかん発作の増悪又はてんかん重積状態があらわれることがあるので、本剤の投与を中止する場合には、発疹の発現等安全性の観点から直ちに投与を中止しなければならない場合を除き、少なくとも2日ごとに徐々に減量し、1週間以上かけて中止すること。
8.3 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等、危険を伴う操作に従事させないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 他の抗てんかん薬に対しアレルギー歴又は発疹発現の既往歴がある患者
本剤の投与による薬剤性過敏症症候群が報告されている。[11.1.1参照]
9.1.2 先天性QT短縮症候群の患者
治療上の有益性が危険性を上回ると判断される場合にのみ投与し、本剤投与前及び投与中は定期的に心電図検査を実施するなど、患者の状態を慎重に観察すること。本剤投与によりQT間隔が過度に短縮するおそれがある。[17.3参照]
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者
治療上の有益性が危険性を上回ると判断される場合にのみ、患者の状態を慎重に観察しながら投与することとし、必要に応じて投与量を調節するなど適切な処置を行うこと。重度の肝障害患者を対象とした臨床試験は実施していない。
9.3.2 肝機能障害患者
本剤は肝臓で代謝されるため、血中濃度が上昇するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験で、妊娠ラットに投与したとき、非妊娠ラットと比較して、母動物の摂餌量減少の増強及び体重増加抑制の増強が報告されている。また、妊娠ラットに150mg/kgを経口投与したとき、母動物毒性に起因する出生後初期の出生児死亡率の増加及び出生児の生後体重の増加抑制が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラット及びウサギに14C-ルフィナミドを経口投与したとき、乳汁中へ移行することが報告されている。
9.7 小児等
9.7.1 発疹及び発熱等の症状が認められた場合には注意すること。小児には、発疹の初期徴候は感染と誤診されやすい。
9.7.2 低出生体重児、新生児、乳児、4歳未満又は体重15kg未満の幼児を対象とした国内臨床試験は実施していない。
9.8 高齢者
一般に高齢者では生理機能が低下している。なお、外国での試験では、高齢者と非高齢者との間で、薬物動態に明らかな差は認められていない。[16.6.2参照]
10. 相互作用
相互作用序文
本剤は主にカルボキシエステラーゼで代謝される。[16.4参照]
薬物代謝酵素用語
カルボキシエステラーゼ
10.2 併用注意
| バルプロ酸ナトリウム [7.2、16.7.1、16.7.5参照] | 本剤の血中濃度が上昇することがあるので、必要に応じて本剤の用量を調節すること。 | 相手薬剤により代謝酵素であるカルボキシエステラーゼが阻害され、本剤のクリアランスが低下する。 |
| フェノバルビタール プリミドン カルバマゼピン [16.7.1参照] | 本剤の血中濃度が低下する可能性がある。 | 機序は不明である。 |
| フェニトイン [16.7.1参照] | 本剤の血中濃度が低下する可能性がある。また、相手薬剤の血中濃度を上昇させるおそれがある。 | 機序は不明である。 |
| CYP3A4(又はCYP3A)で代謝される薬剤 クロバザム カルバマゼピン エトスクシミド トピラマート ゾニサミド トリアゾラム等 [16.7.1、16.7.2参照] | 相手薬剤の代謝を促進し、作用を減弱させるおそれがある。 | 本剤のCYP3A4に対する誘導作用によると考えられる。 |
| 経口避妊薬 エチニルエストラジオール・ノルエチステロン [16.7.4参照] | 相手薬剤の代謝を促進し、作用を減弱させるおそれがある。 | 機序は不明である。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、さらにリンパ節腫脹、肝機能障害等の臓器障害、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。[9.1.1参照]
11.1.2 皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
発熱、眼充血、紅斑、水疱・びらん、咽頭痛等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 10%以上 | 3〜10%未満 | 3%未満 | 頻度不明 | |
| 過敏症 | 発疹 | |||
| 消化器 | 食欲減退(17.2%) 嘔吐(12.1%) 便秘(10.3%) | 悪心 | ||
| 精神神経系 | 傾眠(20.7%) | 浮動性めまい、てんかん重積状態、激越、頭痛 | 精神運動亢進、運動失調、痙攣 | 攻撃性、嗜眠 |
| その他 | 体重減少 | 疲労、複視、霧視 |
13. 過量投与
本剤は血液透析により一部除去可能であり、発現している症状の程度に応じて血液透析の実施を考慮すること。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
海外で実施された複数の抗てんかん薬における、てんかん、精神疾患等を対象とした199のプラセボ対照比較試験の検討結果において、自殺念慮及び自殺企図の発現リスクが、抗てんかん薬の服用群でプラセボ群と比較して約2倍高く(抗てんかん薬服用群:0.43%、プラセボ群:0.24%)、抗てんかん薬の服用群では、プラセボ群と比べ1000人あたり1.9人多いと計算された(95%信頼区間:0.6-3.9)。また、てんかん患者のサブグループでは、プラセボ群と比べ1000人あたり2.4人多いと計算されている。
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
健康成人を対象にルフィナミドを1日2回に分けて、800mg/日注)から食後に経口投与を開始し、3日ごとに増量した場合の800、1600、2400及び3200mg/日注)における定常状態の平均血漿中濃度推移及び薬物動態パラメータは以下のとおりである(被験者の体重の平均値±標準偏差は72.1±10.8kg)1)(外国人データ)。
健康成人での反復投与時の定常状態の血漿中濃度推移
(Mean+S.D.)
| 1日投与量(mg/日) | n | Cmax(μg/mL) | tmaxb)(hr) | AUC0-12(μg・hr/mL) |
| 800注) | 14a) | 8.93±1.89 | 3.00 (2.00、6.04) | 84.90±22.80 |
| 1600注) | 14 | 15.58±4.32 | 3.00 (3.00、6.00) | 153.00±46.20 |
| 2400注) | 14 | 20.41±5.75 | 3.50 (1.99、6.01) | 201.00±65.70 |
| 3200注) | 10 | 23.18±6.06 | 4.00 (2.00、4.07) | 229.00±57.10 |
注)国内での承認用法及び用量と異なる。
16.2 吸収
16.2.1 食事の影響
健康成人に400mgを絶食下及び食後に単回経口投与注)したとき、食後投与では絶食下と比べ血漿中ルフィナミドのCmax及びAUCはそれぞれ56%及び34%上昇したが、tmax及びt1/2は一定であった2)(外国人データ)。
注)国内での承認用法及び用量と異なる。
16.3 分布
16.3.1 血清蛋白結合率
34%(in vitro、濃度0.62〜4.83μmol/L)3)
16.4 代謝
16.5 排泄
健康成人男性に14C-ルフィナミド600mgを食後に単回経口投与注)したとき、投与後48時間までに投与量の66%が主代謝物として、2%が未変化体として尿中より回収された。投与後168時間までに投与量の85%の放射能が尿中から、14%が糞中から回収された5)(外国人データ)。
注)国内での承認用法及び用量と異なる。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害患者(クレアチニンクリアランス30mL/分未満)にルフィナミド400mgを食後に単回経口投与注)した時の薬物動態は健康成人の薬物動態と類似していた。ルフィナミド400mgの食後単回経口投与注)3時間後に透析を受けた腎機能障害患者のCmax及びAUCはそれぞれ16%及び29%低下した7)(外国人データ)。
16.6.2 高齢者
注)国内での承認用法及び用量と異なる。
16.7 薬物相互作用
16.7.1 抗てんかん薬
(1)他の抗てんかん薬に対するルフィナミドの影響
(2)ルフィナミドに対する他の抗てんかん薬の影響
母集団薬物動態解析の結果より、カルバマゼピン、フェニトイン、プリミドン及びフェノバルビタールは、ルフィナミドの血漿中濃度を低下させることが示された。一方、バルプロ酸は、ルフィナミドの血漿中濃度を上昇させ、特に30kg未満の患者において、85%まで上昇させる可能性がある。なお、ラモトリギン、トピラマート及びベンゾジアゼピン系の薬剤の影響は認められなかった9)(外国人データ)。[7.2、10.2参照]
| 併用抗てんかん薬 | ルフィナミドの血漿中濃度に対する併用抗てんかん薬の影響 |
| カルバマゼピン | 22〜30%減少b) (カルバマゼピンの用量に依存) |
| フェノバルビタール フェニトイン プリミドン | 26〜50%減少b) |
| バルプロ酸 | 14〜85%増加b) (バルプロ酸の血漿中濃度に依存) |
16.7.2 トリアゾラム
16.7.3 オランザピン
健康成人男性19名にルフィナミド800mg/日注)を1日2回に分けて11日間食後に反復経口投与し、最終投与時にオランザピン5mgを食後に併用投与したとき、単独投与時と比較してオランザピンのCmax及びAUCに影響は認められなかった10)(外国人データ)。
16.7.4 経口避妊薬(エチニルエストラジオール35μg及びノルエチステロン1mg合剤)
16.7.5 In vitro試験
注)国内での承認用法及び用量と異なる。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
体重15.0kg以上で4〜30歳のLennox-Gastaut症候群患者59例を対象に本剤又はプラセボを12週間食後に経口投与する二重盲検比較試験(他の抗てんかん薬との併用療法)を実施した。維持用量は15.0〜30.0kgの患者には1日1000mg、30.1〜50.0kgの患者には1日1800mg、50.1〜70.0kgの患者には1日2400mg、70.1kg以上の患者には1日3200mgと設定した。その結果、本剤群では強直・脱力発作頻度がプラセボ群と比較して有意に減少した。また、副作用の発現率は、本剤群62.1%(18/29例)、プラセボ群16.7%(5/30例)であった。本剤群で発現率の高かった副作用は、食欲減退17.2%(5/29例)、傾眠17.2%(5/29例)及び嘔吐13.8%(4/29例)であった。プラセボ群で複数例に発現した副作用はなかった13)。
| 強直・脱力発作頻度変化率a) | ルフィナミド群 (28例b)) | プラセボ群 (30例) |
| 中央値 最小値、最大値 | −24.20% −93.5%、27.2% | −3.25% −81.6%、151.9% |
| 群間差c) [90%信頼区間] | −26.65% [−40.30%、−11.80%] | |
| 優越性検定d) | 0.003 | |
17.1.2 国内長期投与試験
第III相試験を完了した54例を対象として、長期投与試験(最長約16.3ヵ月)を実施した。その結果、各評価時期において強直・脱力発作頻度の減少が継続して認められ、投与40週後の強直・脱力発作頻度変化率(中央値)は−47.60%であった。また、副作用発現率は68.5%(37/54例)であった。発現率10%以上の副作用は、傾眠20.4%(11/54例)、食欲減退16.7%(9/54例)、便秘11.1%(6/54例)嘔吐11.1%(6/54例)であった14)。
| 強直・脱力発作頻度変化率a) | 12週 | 24週 | 32週 | 40週 |
| 例数 | 46 | 43 | 42 | 41 |
| 中央値 | −39.30% | −40.60% | −46.80% | −47.60% |
| 最小値 | −100.0% | −100.0% | −100.0% | −100.0% |
| 最大値 | 125.2% | 85.7% | 75.0% | 833.2% |
17.3 その他
17.3.1 QT/QTc評価試験
健康成人117名にルフィナミド2400、3200、4800及び7200mg/日又はプラセボを1日2回に分けて食後に3日ずつ漸増反復経口投与注)し、さらにプラセボ群では1日間の休薬後にモキシフロキサシン400mgを食後に単回投与した時のQTcF間隔を測定した。QTcF間隔は2400〜7200mg/日投与で、プラセボと比較し最大16.1〜20.2msec短縮した12)(外国人データ)。[9.1.2参照]
| 薬剤 | 投与後時間(hr) | プラセボとの差の最大値 [90%信頼区間](msec) |
| ルフィナミド 2400mg/日注) | 4 | −16.7 [−20.3、−13.1] |
| ルフィナミド 3200mg/日注) | 8 | −16.1 [−19.5、−12.7] |
| ルフィナミド 4800mg/日注) | 4 | −20.2 [−24.2、−16.2] |
| ルフィナミド 7200mg/日注) | 4 | −20.2 [−24.3、−16.1] |
| モキシフロキサシン 400mg/日 | 3 | 18.7 [14.9、22.5] |
注)国内での承認用法及び用量と異なる。
18. 薬効薬理
18.1 作用機序
ルフィナミドの作用機序は確定していないが、in vitro試験結果から、電位依存性ナトリウムチャネルの関与が示唆されている。ルフィナミドはラット大脳皮質神経細胞の電位依存性ナトリウムチャネルの不活性化状態からの回復を遅延させた。また、マウスの脊髄神経細胞におけるナトリウム依存性活動電位の持続性高頻度発火を抑制した15)。
18.2 抗痙攣作用
19. 有効成分に関する理化学的知見
19.1. ルフィナミド
22. 包装
<イノベロン錠100mg>
100錠[10錠(PTP)×10]
<イノベロン錠200mg>
100錠[10錠(PTP)×10]
23. 主要文献
- 社内資料:外国人健康成人を対象とした臨床第I相反復投与試験(外国試験)(2013年3月25日承認、CTD2.7.6.17)
- 社内資料:外国人健康成人を対象とした食事の影響検討試験(外国試験)(2013年3月25日承認、CTD2.7.6.8)
- 社内資料:ルフィナミドのin vitroヒト血清蛋白結合率(2013年3月25日承認、CTD2.7.2)
- 社内資料:ルフィナミドのin vitro代謝(2013年3月25日承認、CTD2.6.4.5.7)
- 社内資料:外国人健康成人を対象とした14C‐ルフィナミド単回投与時の薬物動態試験(外国試験)(2013年3月25日承認、CTD2.7.6.14)
- 社内資料:外国人健康高齢者を対象とした臨床第I相単回及び反復投与時の薬物動態試験(外国試験)(2013年3月25日承認、CTD2.7.6.18)
- 社内資料:腎機能障害患者を対象とした薬物動態試験(外国試験)(2013年3月25日承認、CTD2.7.6.19)
- 社内資料:併用抗てんかん薬の母集団薬物動態解析(2013年3月25日承認、CTD2.7.2.3.2.4.3)
- 社内資料:ルフィナミドの母集団薬物動態解析(2013年3月25日承認、CTD2.7.2.3.2.4.2)
- Perucca,E.et al., Epilepsia, 49 (7), 1123-1141, (2008) »PubMed »DOI
- Williams,E.T.et al., Drug Metab.Lett., 5 (4), 280-289, (2011) »PubMed »DOI
- 社内資料:外国人健康成人におけるQT/QTc評価試験(外国試験)(2013年3月25日承認、CTD2.7.6.24)
- 社内資料:Lennox-Gastaut症候群患者を対象とした臨床第III相二重盲検比較試験(国内試験)(2013年3月25日承認、CTD2.7.6.25)
- 社内資料:Lennox-Gastaut症候群患者を対象とした臨床第III相継続長期投与試験(国内試験)(2013年3月25日承認、CTD2.7.6.27)
- 社内資料:イオンチャネルに対する作用(2013年3月25日承認、CTD2.6.2.2.1)
- 社内資料:最大電撃痙攣に対する作用(ラット、マウス)(2013年3月25日承認、CTD2.6.2.2.2.1)
- 社内資料:薬物誘発痙攣に対する作用(マウス)(2013年3月25日承認、CTD2.6.2.2.2.2.1)
- 社内資料:キンドリングに対する作用(ネコ)(2013年3月25日承認、CTD2.6.2.2.3.2)
24. 文献請求先及び問い合わせ先
文献請求先
エーザイ株式会社
hhcホットライン
〒112-0088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
製品情報問い合わせ先
エーザイ株式会社
hhcホットライン
〒112-0088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
26. 製造販売業者等
26.1 製造販売元
エーザイ株式会社
東京都文京区小石川4-6-10