医薬品情報
| 総称名 | ルリコン |
|---|---|
| 一般名 | ルリコナゾール |
| 欧文一般名 | Luliconazole |
| 製剤名 | ルリコナゾール(Luliconazole)製剤 |
| 薬効分類名 | 抗真菌剤 |
| 薬効分類番号 | 2655 |
| ATCコード | D01AC18 |
| KEGG DRUG |
D01980
ルリコナゾール
|
| KEGG DGROUP |
DG01883
イミダゾール系抗真菌薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ルリコンクリーム1% | Lulicon Cream 1% | サンファーマ | 2655712N1020 | 28.8円/g | |
| ルリコン液1% | Lulicon Solution 1% | サンファーマ | 2655712Q1027 | 28.8円/mL | |
| ルリコン軟膏1% | Lulicon Ointment 1% | サンファーマ | 2655712M1025 | 28.8円/g |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
1日1回患部に塗布する。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| クリーム:皮膚 | そう痒、発赤、刺激感、接触皮膚炎、疼痛、湿疹 | ほてり、熱感、灼熱感 | 水疱 |
| クリーム:その他 | BUN上昇、尿蛋白増加 | ||
| 液:皮膚 | 刺激感、接触皮膚炎 | そう痒 | |
| 軟膏:皮膚 | 接触皮膚炎、発赤、そう痒 |
14. 適用上の注意
14.1 薬剤投与時の注意
<製剤共通>
14.1.1 眼科用として角膜、結膜には使用しないこと。
14.1.2 著しいびらん面には使用しないこと。
<液>
14.1.3 亀裂、びらん面には注意して使用すること。
15. その他の注意
15.2 非臨床試験に基づく情報
<製剤共通>
15.2.1 アジュバントを用いて感受性を高めた動物実験(モルモット)を実施した結果、クリーム及び液で皮膚感作性が認められ、液及び軟膏において、皮膚光感作性が認められている。
<クリーム・液>
15.2.2 損傷皮膚を用いた動物実験(ラット、ODT条件)において、クリームに比較して液の経皮吸収性が高くなることが認められている。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子6例の上背部皮膚にルリコンクリーム1% 5g又はルリコン液1% 5mLを24時間単回塗布したとき、塗布12〜24時間後に低濃度の未変化体が血漿中に認められたが、薬剤除去後24時間目には定量限界未満となった1)。
16.1.2 反復投与
健康成人男子6例の上背部皮膚にルリコンクリーム1% 5g又はルリコン液1% 5mLを7日間反復塗布したとき、初回投与後6時間以降及び各回投与22時間後に低濃度の未変化体が血漿中に認められたが、薬剤除去後24時間目には定量限界未満ないし定量限界をわずかに上回る程度にまで低下した。薬剤塗布後24時間目の血漿中未変化体濃度は、最終塗布時には初回塗布時の約1.9倍(クリーム)、約1.4倍(液)に上昇したが、塗布3回目以降ほぼ一定に推移し、また、反復塗布後の血漿中未変化体濃度の消失も速やかであったことより、反復塗布による蓄積性はないものと考えられた2)。
16.3 分布
16.3.1 ヒト角層中薬物濃度
健康成人男子24名を対象に、同一被験者の背部にルリコンクリーム1%及びルリコン軟膏1%を単回塗布した時、角層中薬物濃度(平均値±標準偏差)は投与後12時間においてそれぞれ225.48±72.06ng/cm2及び267.83±112.24ng/cm2、投与後24時間においてそれぞれ262.00±88.69ng/cm2及び234.52±100.92ng/cm2であった3)。
16.5 排泄
尿中に未変化体は検出されなかった。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
足白癬及び生毛部白癬患者312例(1%群107例、0.5%群101例、0.1%群104例)を対象に1%クリーム(以下、A群)、0.5%クリーム(以下、B群)及び0.1%クリーム(以下、C群)の有効性と安全性を評価するために、無作為化二重盲検比較試験を行った結果、足白癬における改善率は、趾間型足白癬で1%群97.3%(36/37例)、0.5%群91.4%(32/35例)、0.1%群97.3%(36/37例)、小水疱型足白癬で1%群83.8%(31/37例)、0.5%群90.6%(29/32例)、0.1%群94.3%(33/35例)、足白癬全体では1%群90.5%(67/74例)、0.5%群91.0%(61/67例)、0.1%群95.8%(69/72例)であった。生毛部白癬では1%群93.9%(31/33例)、0.5%群94.1%(32/34例)、0.1%群100%(32/32例)であった。足白癬、生毛部白癬とも90%以上の高い改善率が得られ、いずれの疾患においても3群間に有意差は認められなかった。足白癬における真菌消失率は、趾間型足白癬で1%群94.6%(35/37例)、0.5%群88.6%(31/35例)、0.1%群89.2%(33/37例)、小水疱型足白癬で1%群64.9%(24/37例)、0.5%群62.5%(20/32例)、0.1%群54.3%(19/35例)、足白癬全体では1%群79.7%(59/74例)、0.5%群76.1%(51/67例)、0.1%群72.2%(52/72例)であった。
生毛部白癬では1%群90.9%(30/33例)、0.5%群88.2%(30/34例)、0.1%群84.4%(27/32例)であり、いずれの疾患においても3群間に有意差は認められなかった。
副作用発現率は、A群で78例中2例(2.6%)2件、B群で70例中1例(1.4%)1件及びC群で76例中2例(2.6%)3件であった。主な副作用は、A群で湿疹1件(1.3%)、接触性皮膚炎1件(1.3%)、B群で投与部位疼痛1件(1.4%)及びC群で湿疹1件(1.3%)、投与部位疼痛1件(1.3%)、投与部位発赤1件(1.3%)であった4)。
生毛部白癬では1%群90.9%(30/33例)、0.5%群88.2%(30/34例)、0.1%群84.4%(27/32例)であり、いずれの疾患においても3群間に有意差は認められなかった。
副作用発現率は、A群で78例中2例(2.6%)2件、B群で70例中1例(1.4%)1件及びC群で76例中2例(2.6%)3件であった。主な副作用は、A群で湿疹1件(1.3%)、接触性皮膚炎1件(1.3%)、B群で投与部位疼痛1件(1.4%)及びC群で湿疹1件(1.3%)、投与部位疼痛1件(1.3%)、投与部位発赤1件(1.3%)であった4)。
17.1.2 国内第III相試験
足白癬患者511例を対象にクリームの短期間塗布(2週間塗布)での有効性及び安全性を、対照薬1%ビホナゾールクリームの通常期間塗布(4週間塗布)と無作為化単盲検比較試験にて検討した結果、主要評価項目である4週後の真菌学的効果における真菌消失率は、ルリコナゾール群で76.1%(188/247例)、ビホナゾール群で75.9%(183/241例)、4週後の皮膚症状改善度における改善率は、ルリコナゾール群で91.5%(226/247例)、ビホナゾール群で91.7%(222/242例)であり、検定の結果、有意差は認められなかった。
副作用発現率は、ルリコナゾール群で253例中5例(2.0%)7件であった。主な副作用は、ルリコナゾール群で投与部位刺激感2件(0.8%)、そう痒1件(0.4%)、かゆみ1件(0.4%)、灼熱感1件(0.4%)、投与部疼痛1件(0.4%)、投与部発赤1件(0.4%)であった5)。
副作用発現率は、ルリコナゾール群で253例中5例(2.0%)7件であった。主な副作用は、ルリコナゾール群で投与部位刺激感2件(0.8%)、そう痒1件(0.4%)、かゆみ1件(0.4%)、灼熱感1件(0.4%)、投与部疼痛1件(0.4%)、投与部発赤1件(0.4%)であった5)。
17.1.3 液剤の皮膚真菌症に対する国内臨床試験(クリームとの比較)
1%液と1%クリームの臨床における有効性及び安全性を比較検討するため、足白癬患者208例を対象に短期間塗布(2週間塗布)による比較試験を無作為化オープン試験にて実施した。主要評価項目である塗布開始4週後における真菌学的効果及び皮膚症状改善度の解析結果は以下の表のとおりであった。
液剤塗布群では、真菌消失率は65.1%(69/106例)であった。それに対し、クリーム塗布群では、真菌消失率は66.3%(65/98例)であり、検定の結果、両群間に有意差は認められなかった。液剤塗布群における皮膚症状改善率は液剤塗布群では90.6%(96/106例)であった。それに対し、クリーム塗布群では88.8%(87/98例)であり、検定の結果、両群間に有意差は認められなかった。
安全性解析採用例は液剤塗布群107例、クリーム塗布群100例であった。副作用発現率は、液剤塗布群で107例中2例(1.9%)2件、クリーム塗布群で100例中2例(2.0%)2件であった。主な副作用は、液剤塗布群で接触性皮膚炎1件(0.9%)、投与部位刺激感1件(0.9%)、クリーム塗布群で接触性皮膚炎1件(1.0%)、発赤1件(1.0%)であった6)。
液剤塗布群では、真菌消失率は65.1%(69/106例)であった。それに対し、クリーム塗布群では、真菌消失率は66.3%(65/98例)であり、検定の結果、両群間に有意差は認められなかった。液剤塗布群における皮膚症状改善率は液剤塗布群では90.6%(96/106例)であった。それに対し、クリーム塗布群では88.8%(87/98例)であり、検定の結果、両群間に有意差は認められなかった。
安全性解析採用例は液剤塗布群107例、クリーム塗布群100例であった。副作用発現率は、液剤塗布群で107例中2例(1.9%)2件、クリーム塗布群で100例中2例(2.0%)2件であった。主な副作用は、液剤塗布群で接触性皮膚炎1件(0.9%)、投与部位刺激感1件(0.9%)、クリーム塗布群で接触性皮膚炎1件(1.0%)、発赤1件(1.0%)であった6)。
18. 薬効薬理
18.1 作用機序
ルリコナゾールは真菌の細胞膜の構成成分であるエルゴステロールの合成阻害作用により抗真菌作用を示す7)。
18.2 抗真菌作用
18.2.1 ルリコナゾールは、皮膚糸状菌(Trichophyton属、Microsporum属、Epidermophyton属)、Candida属真菌及びMalassezia属真菌に対して優れた抗真菌活性を有する8)12)13)14)15)16)(in vitro)。皮膚糸状菌の臨床分離株に対するMICは0.00012〜0.004μg/mLであり、殺真菌活性も低濃度で発現した8)16)(in vitro)。
18.2.2 ルリコナゾールは、他の病原性真菌(酵母様真菌、Aspergillus属真菌及び黒色真菌)にも強い抗真菌活性を示した15)(in vitro)。
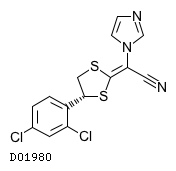
19. 有効成分に関する理化学的知見
19.1. ルリコナゾール
20. 取扱い上の注意
<製剤共通>
20.1 小児の手の届かない所に保管すること。
20.2 衣類に付着すると黄色に着色することがあるので注意すること。
<液>
20.3 合成樹脂を軟化したり、塗料を溶かしたりすることがあるので注意すること。
20.4 火気を避けて保存すること。
22. 包装
<ルリコンクリーム1%>
チューブ
10g×10本、10g×20本、10g×50本、30g×10本
<ルリコン液1%>
瓶
10mL×10本、10mL×20本
<ルリコン軟膏1%>
チューブ
10g×10本、10g×20本
23. 主要文献
- 社内資料:単回投与(2005年4月11日承認、申請資料概要へ3.(1),(3))
- 社内資料:排泄(2005年4月11日承認、申請資料概要へ3.(2),(4))
- 社内資料:皮膚薬物動態学的試験 治験総括報告書5.3.1.2
- Watanabe,S.et al., Mycoses., 50, 35-40, (2007) »PubMed
- Watanabe,S.et al., Mycoses., 49, 236-241, (2006) »PubMed
- 社内資料:液剤の皮膚真菌症に対する国内臨床試験(2005年4月11日承認、申請資料概要ト2.(2))
- Niwano,Y.et al., Med.Mycol., 37, 351-355, (1999) »PubMed
- 日本農薬株式会社 社内資料:非臨床試験(表在性真菌感染症患者由来新鮮分離株に対するin vitro抗菌活性)
- 日本農薬株式会社 社内資料:非臨床試験(モルモット白癬モデルにおける治療効果)
- 日本農薬株式会社 社内資料:非臨床試験(皮膚角質貯留性の検討)
- 日本農薬株式会社 社内資料:非臨床試験(角質親和性)
- Niwano,Y.et al., Antimicrob.Agents Chemother., 42, 967-970, (1998) »PubMed
- Uchida,K.et al., Microbiol.Immunol., 47, 143-146, (2003) »PubMed
- Uchida,K.et al., Int.J.Antimicrob.Agents., 21, 234-238, (2003) »PubMed
- Uchida,K.et al., J.Infect.Chemother., 10, 216-219, (2004) »PubMed
- Koga,Y.et al., J.Infect.Chemother., 12, 163-165, (2006) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
サンファーマ株式会社
くすり相談センター
〒105-0011
東京都港区芝公園1-7-6
電話:0120-22-6880 受付時間:9時〜17時(土、日、祝日、その他当社の休業日を除く)
製品情報問い合わせ先
サンファーマ株式会社
くすり相談センター
〒105-0011
東京都港区芝公園1-7-6
電話:0120-22-6880 受付時間:9時〜17時(土、日、祝日、その他当社の休業日を除く)
26. 製造販売業者等
26.1 製造販売元
サンファーマ株式会社
東京都港区芝公園1-7-6