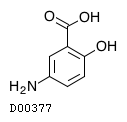
医薬品情報
| 総称名 | ペンタサ |
|---|---|
| 一般名 | メサラジン |
| 欧文一般名 | Mesalazine |
| 製剤名 | メサラジン坐剤 |
| 薬効分類名 | 潰瘍性大腸炎治療剤 |
| 薬効分類番号 | 2399 |
| ATCコード | A07EC02 |
| KEGG DRUG |
D00377
メサラジン
|
| KEGG DGROUP |
DG01504
非ステロイド性抗炎症薬 (NSAID)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第6版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ペンタサ坐剤1g | PENTASA Suppositories 1g | フェリング・ファーマ | 2399715J1020 | 186.6円/個 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
潰瘍性大腸炎(重症を除く)
5. 効能または効果に関連する注意
直腸部の炎症性病変に対して使用すること。なお、本剤が腸内で到達する範囲は直腸部に限局されるため、S状結腸より口側の炎症には効果が期待できない。[16.8参照]
6. 用法及び用量
通常、成人には1日1個(メサラジンとして1g)を、直腸内に挿入する。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 サラゾスルファピリジンに対する過敏症のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。メサラジンの動物実験(ラット)では催奇形性は認められていない28)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能(腎機能、肝機能等)が低下している。[7.1参照]
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 間質性肺疾患(頻度不明)
胸水、胸部痛、心電図異常等があらわれた場合には、投与を中止するなど適切な処置を行うこと。
11.1.4 再生不良性貧血、汎血球減少、無顆粒球症、血小板減少症(いずれも頻度不明)[8.3参照]
11.1.5 肝炎、肝機能障害、黄疸(いずれも頻度不明)
肝炎、AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。[8.4参照]
11.1.6 膵炎(頻度不明)[8.5参照]
11.1.7 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
11.1.8 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
11.1.9 抗好中球細胞質抗体(ANCA)関連血管炎(頻度不明)
発熱、倦怠感、関節痛、筋痛等の全身症状や、皮膚(紅斑、紫斑)、肺(血痰)、腎臓(血尿、蛋白尿)等の臓器症状があらわれることがある。
副作用頻度は、国内のペンタサ錠250mg・500mgの臨床成績及び市販後調査結果、又は外国における市販後調査結果(経口剤、注腸剤、坐剤を区別していない)
11.2 その他の副作用
| 1%以上 | 0.01〜1%未満 | 0.01%未満 | 頻度不明 | |
| 皮膚 | 発疹、丘疹、蕁麻疹、紅斑 | 脱毛48) | そう痒感 | |
| 消化器 | 下痢、腹痛、嘔気、嘔吐 | 血便注1)、下血注1)、アミラーゼ上昇、腹部膨満感注1)、便秘注1)、粘液便注1) | 食欲不振、口内炎、便の変色(黒色等) | |
| 肝臓 | AST・ALT・γ-GTP・Al-P・ビリルビンの上昇等の肝機能異常 | |||
| 腎臓 | 尿着色注1) | クレアチニン・尿中NAG・尿中ミクログロブリンの上昇・尿蛋白等の腎機能異常 | ||
| 血液 | 白血球減少、貧血、好酸球増多7) | |||
| その他 | 頭痛 | CK上昇注1) | 筋肉痛、関節痛、ループス様症候群49)50) | 発熱、浮腫、全身倦怠感、めまい、末梢神経障害51)、肛門部位疼痛、肛門部位のかゆみ、不快感、便意切迫、胸部痛、頚部痛、CRP上昇 |
14. 適用上の注意
14.1 薬剤投与後の注意
メサラジン又はその代謝物を含む尿は、次亜塩素酸塩を含有する漂白剤と接触することにより赤褐色に変色することがある。
16. 薬物動態
16.1 血中濃度
健康成人男性6例を対象として、ペンタサ坐剤1g(メサラジンとして1g含有)を空腹時に単回直腸内投与したとき、血漿中未変化体の濃度推移は図1、血漿中未変化体及び代謝物であるN-アセチルメサラジン(アセチル体)の薬物動態パラメータは表1のとおりであった52)。
図1 ペンタサ坐剤1gを単回投与したときの血漿中未変化体の濃度推移
| Cmax(ng/mL) | tmax#1(hr) | AUCt(ng・hr/mL) | |
| 未変化体 | 420±242 | 8.00#2(3.00-12.0) | 5410±4780 |
| アセチル体 | 856±497 | 6.00(1.00-24.0) | 12500±10800 |
16.3 分布
蛋白結合率はメサラジンで約70%、アセチル体で約88%であった(in vitro)。
16.4 代謝
メサラジンは全身に分布するN-アセチルトランスフェラーゼによって生体内でアセチル体に代謝される。
16.5 排泄
健康成人男性6例にペンタサ坐剤1g(メサラジンとして1g含有)を空腹時に単回直腸内投与したとき、未変化体及びアセチル体の投与後24時間の累積尿中排泄率はそれぞれ0.1%及び14.0%であった52)。
16.8 その他
153Smで標識したメサラジン坐剤1gを健康成人8例に直腸内投与したときの腸内での到達部位を検討した結果、8例全例で直腸部に限局した53)(外国人データ)。[5.参照]
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相検証的試験
直腸部に炎症を有する活動期の潰瘍性大腸炎患者129例を対象として、本剤1g又はプラセボを1日1回1個、4週間直腸内投与する多施設共同並行群間無作為化二重盲検比較試験を実施した。直腸部の粘膜スコアを基にした内視鏡的寛解導入率で、プラセボに対する優越性が検証された54)。
本剤投与群で発現した副作用は、適用部位疼痛1.5%(1/65例)であった。
本剤投与群で発現した副作用は、適用部位疼痛1.5%(1/65例)であった。
| 本剤1g(n=65) | プラセボ(n=64) | 群間差(%)#3 [95%信頼区間] | χ2検定 | |
| 内視鏡的寛解導入した被験者数#1 | 53 | 19 | 51.9 [37.2,66.5] | p<0.0001 |
| 内視鏡的寛解導入率(%)#2 | 81.5 | 29.7 |
18. 薬効薬理
18.1 作用機序
18.2 活性酸素に対する作用
in vitroにおいてフリーラジカル(DPPHL)還元作用、過酸化水素消去作用、次亜塩素酸イオン消去作用、過酸化脂質抑制作用(in vitro、in vivo)が認められた55)。
18.3 LTB4に対する作用
ラット好中球でのLTB4生合成を抑制した55)(in vitro)。
18.4 動物モデルに対する効果
19. 有効成分に関する理化学的知見
19.1. メサラジン
20. 取扱い上の注意
本剤は開封するとわずかに着色することがあるので、開封後は速やかに使用すること。
22. 包装
50個[10個(SP包装)×5]
100個[10個(SP包装)×10]
23. 主要文献
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2585-S2605, (1994)
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2509-S2530, (1994)
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2531-S2554, (1994)
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2555-S2583, (1994)
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2607-S2624, (1994)
- Miner,P.et al., Dig.Dis.Sci., 40 (2), 296-304, (1995) »PubMed »DOI
- Morice,A.H.et al., Lancet., 350, 1105, (1997) »PubMed »DOI
- Kapur,K.C.et al., Gut., 37, 838-839, (1995) »PubMed »DOI
- 竹下宗範,他, 第74回日本消化器病学会九州支部例会抄録, 74, 65, (1999)
- Mehta,R.P., CMAJ., 143 (10), 1031-1032 , (1990) »PubMed
- Witte,T.et al., Nephron., 67, 481-482, (1994) »PubMed »DOI
- Smilde,T.J.et al., Ned.Tijdschr.Geneeskd., 138 (51), 2557-2561, (1994) »PubMed
- Otsubo,H.et al., Int.J.Hematol., 68, 445-448, (1998) »PubMed »DOI
- Kotanagi,H.et al., J.Gastroenterol., 33, 571-574, (1998) »PubMed »DOI
- Casellas,F.et al., J.Clin.Gastroenterol., 22 (2), 160-161, (1996) »PubMed »DOI
- Daneshmend,T.K., Lancet., 337, 1297-1298, (1991) »PubMed »DOI
- Jick,H.et al., Pharmacotherapy., 15 (2), 176-181, (1995) »PubMed
- Committee on Safety of Medicines, Current Problems in Pharmacovigilance., 21, 5-6, (1995)
- Bodin,F.et al., Therapie., 46, 341, (1991) »PubMed
- Wyatt,S.et al., Lancet., 341, 1476, (1993) »PubMed »DOI
- Hautekeete,M.L.et al., Gastroenterology., 103, 1925-1927, (1992) »PubMed »DOI
- Stoschus,B.et al., J.Hepatol., 26, 425-428, (1997) »PubMed »DOI
- Deltenre,P.et al., Gut., 44, 886-888, (1999) »PubMed »DOI
- Besseau,M.et al., Gastroenterol.Clin.Biol., 15, 174-175, (1991)
- Sachedina,B.et al., Ann.Intern.Med., 110 (6), 490-492, (1989) »PubMed »DOI
- 棟方昭博,他, 薬理と治療, 22 (Suppl.10), S2625-S2638, (1994)
- Mulder,C.J.J.et al., Ann.Intern.Med., 106 (6), 911-912, (1988)
- 太田隆雄,他, 応用薬理, 47 (6), 513-522, (1994)
- 田中和彦,他, 応用薬理, 48 (4), 225-238, (1994)
- de Boer,N.K.H.et al., Am.J.Gastroenterol., 102, 2747-2753, (2007) »PubMed »DOI
- Szumlanski,C.L.et al., Br.J.Clin.Pharmacol., 39, 456-459, (1995) »PubMed »DOI
- Dewit,O.et al., Aliment.Pharmacol.Ther., 16, 79-85, (2002) »PubMed »DOI
- Honeybourne,D., BMJ., 308, 533-534, (1994) »PubMed »DOI
- Welte,T.et al., Lancet., 338, 1273, (1991) »PubMed »DOI
- Lagler,U.et al., Schweiz.Med.Wochenschr., 122, 1332-1334, (1992) »PubMed
- Bitton,A.et al., Am.J.Gastroenterol., 91, 1039-1040, (1996) »PubMed
- Declerck,D.et al., Rev.Mal.Respir., 11, 292-293, (1994) »PubMed
- Muzzi,A.et al., Chest., 108 (4), 1181, (1995) »PubMed »DOI
- Reinoso,M.A.et al., Chest., 101 (5), 1469-1471, (1992) »PubMed »DOI
- le Gros,V.et al., BMJ., 302, 970, (1991) »PubMed
- Kristensen,K.S.et al., Lancet., 335, 605, (1990) »PubMed »DOI
- Agnholt,J.et al., Lancet., 1, 1135, (1989) »PubMed »DOI
- 増谷学,他, 日本消化器病学会雑誌, 96 (5), 524-529, (1999) »DOI
- Heresbach,D.et al., Gastroenterol.Clin.Biol., 18, 782-785, (1994) »PubMed
- Gujral,N.et al., Dig.Dis.Sci., 41 (3), 624-626, (1996) »PubMed »DOI
- Iaquinto,G.et al., Ital.J.Gastroenterol., 26, 145-147, (1994) »PubMed
- Skhiri,H.et al., Nephron., 79, 236, (1998) »PubMed »DOI
- Netzer,P., Schweiz.Med.Wochenschr., 125, 2438-2442, (1995) »PubMed
- Dent,M.T., BMJ., 305, 159, (1992)
- Timsit,M.A.et al., Rev.Rhum.Engl.Ed., 64 (10), 586-588, (1997) »PubMed
- Woodward,D.K., BMJ., 299, 1224, (1989) »PubMed »DOI
- 社内資料:PS-SP臨床薬理試験<第I相> −健康成人男性を対象とした薬物動態の検討−
- Brown,J.et al., Aliment.Pharmacol.Ther., 11, 685-691, (1997) »PubMed
- 社内資料:PS-SP検証的試験<第III相> −活動期潰瘍性大腸炎患者を対象とした新剤型の検討−
- 中丸幸一,他, 日本薬理学雑誌, 104, 447-457, (1994) »PubMed »DOI
- Gomez-Munoz,A.et al., Biochim.Biophys.Acta., 1533 (2), 110-118, (2001) »PubMed
- Rousseaux,C.et al., J.Exp.Med., 201 (8), 1205-1215, (2005) »PubMed
- Kaiser,G.C.et al., Gastroenterology., 116 (3), 602-609, (1999) »PubMed
- Fox,C.C.et al., Dig.Dis.Sci., 36 (2), 179-184, (1991) »PubMed
- Eliakim,R.et al., Gastroenterology., 95, 1167-1172, (1988) »PubMed
- Mahida,Y.R.et al., Gut., 32, 50-54, (1991) »PubMed
- 小島僚太郎,他, 日本薬理学雑誌, 118, 123-130, (2001) »PubMed
- 社内資料:動物モデルにおけるメサラジンの障害抑制効果
24. 文献請求先及び問い合わせ先
文献請求先
杏林製薬株式会社
くすり情報センター
〒160-0017
東京都新宿区左門町20番地
電話:0120-409-341 受付時間 9:00〜17:30(土・日・祝日・会社休日を除く)
製品情報問い合わせ先
杏林製薬株式会社
くすり情報センター
〒160-0017
東京都新宿区左門町20番地
電話:0120-409-341 受付時間 9:00〜17:30(土・日・祝日・会社休日を除く)
26. 製造販売業者等
26.1 製造販売元(輸入)
フェリング・ファーマ株式会社
東京都港区虎ノ門二丁目10番4号
26.2 販売元
杏林製薬株式会社
東京都千代田区大手町一丁目3番7号