医薬品情報
| 総称名 | ノーモサング |
|---|---|
| 一般名 | ヘミン |
| 欧文一般名 | Hemin |
| 製剤名 | へミン注射液 |
| 薬効分類名 | ヘミン製剤 |
| 薬効分類番号 | 6349 |
| ATCコード | B06AB01 |
| KEGG DRUG |
D10003
ヘミン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年4月 改訂(第3版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ノーモサング点滴静注250mg | Normosang Infusion 250mg | オーファンパシフィック | 6349400A1026 | 154716円/管 | 生物由来製品, 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
急性ポルフィリン症患者における急性発作症状の改善
5. 効能または効果に関連する注意
5.1 本剤は臨床症状及び生化学検査等により急性ポルフィリン症と診断された患者に投与すること。
5.2 本剤による急性発作の予防効果は確認されていないことから、予防的には使用しないこと。
6. 用法及び用量
通常、ヘミンとして3mg/kgを1日1回、4日間点滴静注する。
ただし、1日あたりの投与量は250mgを超えないこと。
ただし、1日あたりの投与量は250mgを超えないこと。
8. 重要な基本的注意
8.2 本剤は1アンプルあたり21.4mgの鉄を含有している。再投与による鉄蓄積の懸念があるため、血清フェリチン値等の鉄の体内蓄積量に関する検査を行い、鉄過剰が疑われる場合には、必要に応じて瀉血等の適切な処置を行うこと。
8.3 本剤は1アンプルあたり1gのエタノールを含有する。本剤を投与する場合には問診等により投与の可否を判断し、投与後は患者の状態を十分に観察すること。
8.4 本剤は、貴重な人血液を原材料として製剤化したものである。本剤の原材料となった献血者の血液については、HBs抗原、抗HCV抗体、抗HIV-1抗体、抗HIV-2抗体及び梅毒マーカーが陰性であることを確認している。また、HIV-1 RNA、HBV DNA及びHCV RNAについては個々の血液について、HAV RNA及びヒトパルボウイルスB19 DNAについてはプールした血液について核酸増幅検査(NAT)を実施し、適合した血液を使用している。当該NATの検出限界以下のウイルスが混入している可能性が常に存在するが、その後の製造工程である、強酸(ギ酸)存在下での加熱処理、脂性溶媒存在下での加熱処理によるウイルスの不活性化・除去処理を実施しており、本剤投与によるHTLV-1をはじめとする感染症の報告はない。本剤の投与に際しては、その旨の患者又はその保護者への説明を考慮すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
相互作用序文
本剤の投与によりチトクロームP450酵素(分子種CYP2D6、CYP3A4)の活性が上昇する。
薬物代謝酵素用語
CYP
薬物代謝酵素用語
CYP2D6
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| CYP2D6で代謝を受ける薬剤 抗不整脈薬 メキシレチン フレカイニド プロパフェノン 等 β受容体遮断薬 プロプラノロール メトプロロール 等 | 本剤の投与により併用薬剤の代謝が亢進し、血中濃度が低下する可能性がある。 | 本剤の投与によりチトクロームP450(CYP2D6)の活性が上昇する。 |
| CYP3A4で代謝を受ける薬剤 Ca拮抗薬 ニフェジピン ジルチアゼム ベラパミル 等 抗不整脈薬 アミオダロン ジソピラミド リドカイン プロパフェノン キニジン 等 抗てんかん薬 フェニトイン カルバマゼピン 鎮痛薬 フェンタニル 等 鎮咳薬 セラトロダスト デキストロメトルファン | 本剤の投与により併用薬剤の代謝が亢進し、血中濃度が低下する可能性がある。 | 本剤の投与によりチトクロームP450(CYP3A4)の活性が上昇する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
11.2 その他の副作用
| 10%以上注1) | 1〜10%未満注1) | 頻度不明 | |
| 血管系 | 注射部位反応 | 血管障害、ほてり、静脈炎、注射部位疼痛、血管炎 | 注射部位血栓、静脈血栓症 |
| 皮膚及び皮下組織 | 蕁麻疹、皮膚変色 | ||
| 傷害 | 挫傷 | ||
| 消化器 | 悪心 | ||
| 腎及び尿路 | 尿中血陽性 | ||
| 神経系 | 傾眠、頭痛 | ||
| 臨床検査 | 低ナトリウム血症、血中ブドウ糖減少、血中尿酸増加、低アルブミン血症、血中鉄減少、血中クレアチニン増加、単球数増加、好中球数減少、血小板数減少、総蛋白減少 | ||
| 全身 | 異常感、倦怠感、発熱 | ||
| 筋骨格系 | 横紋筋融解症注2) |
13. 過量投与
13.1 症状
劇症肝炎、腎障害、高ビリルビン血症、貧血、出血性素因などが報告されている。また、添加剤として含まれるプロピレングリコールによる中枢神経系の副作用などが発現する可能性がある。
13.2 処置
患者の状態を注意深く観察し、異常が認められた場合には適切な処置を行うこと。プロピレングリコールの除去には血液透析が望ましい。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 ポリ塩化ビニル(PVC)容器中ではガラス瓶や他のプラスチック容器中よりも早くヘミンが分解するので、希釈にはPVC容器を用いないことが望ましい。
14.1.2 希釈後放置することで分解する可能性があるため、速やかに投与を開始し、希釈後1時間以内に投与を完了すること。
14.1.3 患者の体重あたりで計算した必要量を取り、日局生理食塩液100mLで希釈する。
14.2 薬剤投与前の注意
本剤は粘度が高く、細い注射針を使用すると投与時間が延長する可能性があるため、21ゲージ又はこれよりも太い注射用針を使用すること。
14.3 薬剤投与時の注意
14.3.1 本剤の黒色の色調により、目視による異物混入の確認が困難であることから、本剤投与時にはインラインフィルターを通して投与すること。なお、本剤の黒色の色調により、血漿の変色を認める場合がある。
14.4 薬剤投与後の注意
本剤投与後は、続けて日局生理食塩液等を静脈内投与することにより薬液を洗い流すことが望ましい。例えば、日局生理食塩液100mLを用い、最初に10mLを3、4回急速注入した後、残りを10〜15分かけて点滴静注する。
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
国内臨床試験(CM01-001試験)1)で急性ポルフィリン症患者5名に本剤をヘミンとして3mg/kg、4日間反復投与(点滴静注)したときの薬物動態パラメータは下記の通りであった。
| 最高血中薬物濃度(μg/mL) (初回投与時) | 56.5±14.7 |
| 消失半減期(時間) (4日目) | 17.1±4.8 |
| 分布容積(L) | 13.9±20.1 |
血中ヘミン濃度*の推移(平均値±標準偏差)(CM01-001試験)
*第1日目投与前濃度で補正
17. 臨床成績
17.1 有効性及び安全性に関する試験
急性ポルフィリン症患者1名を対象にヘミンとして3mg/kg/日、4日間点滴投与した時の本剤の有効性及び安全性を検討した。
臨床症状に関しては、腹痛、及びその他疼痛、嘔吐、悪心、血圧上昇などに改善が認められた。
尿中のヘム前駆体であるPBG、ALA、URO、CPPの排泄量はいずれも本剤投与開始後に速やかに低下した。
安全性に関しては、静脈炎が明らかに関連のある副作用として報告された。
臨床症状に関しては、腹痛、及びその他疼痛、嘔吐、悪心、血圧上昇などに改善が認められた。
尿中のヘム前駆体であるPBG、ALA、URO、CPPの排泄量はいずれも本剤投与開始後に速やかに低下した。
安全性に関しては、静脈炎が明らかに関連のある副作用として報告された。
17.2 製造販売後調査等
17.2.1 国内使用成績調査(全例調査)
本調査の有効性は、急性ポルフィリン症急性発作症状(腹痛・疼痛、消化器症状(腹痛以外)、中枢神経障害、末梢神経障害、その他)の各項目をスコアで評価し、調査担当医師がスコアの変化量を含めて総合的に「有効」、「無効」及び「評価不能」で判定した。有効性解析対象症例30例のうち28例で有効であった。
安全性解析対象症例41例における副作用発現割合は43.9%(18/41例)であった。
その内訳は、注射部位疼痛7例(17.1%)、血清フェリチン増加6例(14.6%)、静脈炎、血管炎各4例(9.8%)、溢出2例(4.9%)等であった。
安全性解析対象症例41例における副作用発現割合は43.9%(18/41例)であった。
その内訳は、注射部位疼痛7例(17.1%)、血清フェリチン増加6例(14.6%)、静脈炎、血管炎各4例(9.8%)、溢出2例(4.9%)等であった。
18. 薬効薬理
18.1 作用機序
18.2 ポルフィリン体もしくはその前駆体に対する作用
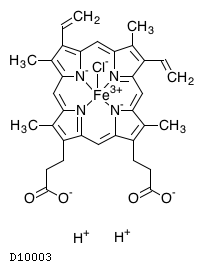
19. 有効成分に関する理化学的知見
19.1. ヘミン
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
10mL[1アンプル]
23. 主要文献
- 社内資料:国内臨床試験(CM01-001)(2013年3月25日承認、CTD2.7.6.1)
- 社内資料:国内臨床試験(CM01-002)(2013年3月25日承認、CTD2.7.6.2)
- 社内資料:国内臨床試験(CM01-003)(2013年3月25日承認、CTD2.7.6.3)
- 矢野雄三ほか, 日本臨床, 19, 123-160, (1998)
- 大門真, 医学のあゆみ 別冊神経疾患 state of arts Ver.1, 585-588, (1999)
- 社内資料:米国臨床試験(AZ66)(2013年3月25日承認、CTD2.7.6.4)
- Tokola O,et al., Pharmacol Toxicol., 61, 75-78, (1987) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
株式会社オーファンパシフィック
DIセンター
〒105-0023
東京都港区芝浦1-1-1
電話:0120-889-009 受付時間 9:00〜17:30(土・日・祝日・社休日を除く)
製品情報問い合わせ先
株式会社オーファンパシフィック
DIセンター
〒105-0023
東京都港区芝浦1-1-1
電話:0120-889-009 受付時間 9:00〜17:30(土・日・祝日・社休日を除く)
26. 製造販売業者等
26.1 製造販売元
株式会社オーファンパシフィック
〒105-0023
東京都港区芝浦1-1-1
その他の説明
献血又は非献血の区別の考え方
献血又は非献血の区別は製剤の安全性の優劣を示すものではありません。この表示区別は、下記の手順に従って決められています。