医薬品情報
| 総称名 | ビオプテン |
|---|---|
| 一般名 | サプロプテリン塩酸塩 |
| 欧文一般名 | Sapropterin Hydrochloride |
| 製剤名 | サプロプテリン塩酸塩顆粒 |
| 薬効分類名 | 天然型テトラヒドロビオプテリン製剤 |
| 薬効分類番号 | 3999 |
| ATCコード | A16AX07 |
| KEGG DRUG |
D01798
サプロプテリン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年5月 改訂(第2版)

|
4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ビオプテン顆粒2.5% | BIOPTEN GRANULES | 第一三共 | 3999012D1023 | 3706.8円/包 | 処方箋医薬品注) |
| ビオプテン顆粒10% | BIOPTEN GRANULES | 第一三共 | 3999012D2020 | 37067.5円/包 | 処方箋医薬品注) |
4. 効能または効果
○ジヒドロビオプテリン合成酵素欠損、ジヒドロプテリジン還元酵素欠損に基づく高フェニルアラニン血症(異型高フェニルアラニン血症)における血清フェニルアラニン値の低下
○テトラヒドロビオプテリン反応性フェニルアラニン水酸化酵素欠損に基づく高フェニルアラニン血症(テトラヒドロビオプテリン反応性高フェニルアラニン血症)における血清フェニルアラニン値の低下
5. 効能または効果に関連する注意
<異型高フェニルアラニン血症>
5.1 本剤は、確定診断によりジヒドロビオプテリン合成酵素欠損症、ジヒドロプテリジン還元酵素欠損症に特定されたものに投与すること。
<テトラヒドロビオプテリン反応性高フェニルアラニン血症>
5.2 本剤は、テトラヒドロビオプテリン負荷試験等による鑑別診断にて、テトラヒドロビオプテリン反応性高フェニルアラニン血症と特定されたものに投与すること。
6. 用法及び用量
<異型高フェニルアラニン血症>
通常、サプロプテリン塩酸塩として1日2〜5mg/kgを1〜3回に分割経口投与するが、血清フェニルアラニン値が正常域に維持される用量をもって、有効維持量とする。
<テトラヒドロビオプテリン反応性高フェニルアラニン血症>
通常、サプロプテリン塩酸塩として1日10mg/kg(1〜3回に分割経口投与)から投与を開始し、臨床症状等の観察を行いながら、年齢に相応した血清フェニルアラニン値の目標値に維持される用量をもって、有効維持量とする。
7. 用法及び用量に関連する注意
<テトラヒドロビオプテリン反応性高フェニルアラニン血症>
7.1 原則として1日20mg/kgを超える投与は行わないこと。1日20mg/kgを超える使用経験は少ない。
7.2 公表されている治療指針の年齢に相応した血清フェニルアラニン値の維持範囲を治療の目標値とすること1)。
8. 重要な基本的注意
<効能共通>
8.1 本剤は長期にわたり投与されるため、血清フェニルアラニン値を定期的に測定し、治療効果を確認するとともに、副作用の観察を行うこと。
<テトラヒドロビオプテリン反応性高フェニルアラニン血症>
8.2 本剤投与によっても治療目標とする血清フェニルアラニン値に到達しない場合は、フェニルアラニン制限食による食事療法を併用するか、あるいは食事療法による単独療法に変更すること。食事療法を併用する場合には、フェニルアラニン摂取制限によるフェニルアラニン欠乏症状が発現する可能性が否定できないので、血清フェニルアラニン値が適正に維持されているか注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 重篤な脳器質障害、てんかん、痙攣発作等のある患者
失神発作、痙攣の発現、痙攣発作回数の増加が認められている。
9.1.2 薬物アレルギーのある患者
9.1.3 食事摂取不良等により栄養状態が不良の患者
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
AST、ALT等の上昇が認められている。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験で乳汁中へ移行することが報告されている。
9.7 小児等
低出生体重児、新生児、乳児へ投与する場合は低用量より開始するなど、慎重に投与すること。幼若ラットに本剤を投与した場合、血漿中及び脳内総ビオプテリン濃度が成熟ラットに比し高くなることが報告されている。
10. 相互作用
10.2 併用注意
| レボドパ | 興奮性、易刺激性が生じることがあるので、このような場合には減量するなど慎重に投与すること。 | 併用することにより相加的にカテコールアミンの産生が増加するためと推測される。 |
11. 副作用
11.2 その他の副作用
| 5%以上注) | 1〜5%未満注) | 頻度不明 | |
| 過敏症 | アレルギー反応、発疹 | ||
| 精神神経系 | どもり、多幸気分、不機嫌 | 興奮、運動過多、睡眠障害 | |
| 中枢神経系 | 痙攣 | ジスキネジー、ミオクローヌス、意識レベル低下、筋緊張亢進、会話障害 | 頭痛、反射亢進、浮動性めまい、振戦 |
| 消化器 | 下痢(12.8%) | 嘔吐、流涎過多 | 腹痛、悪心、鼓腸、排便回数増加、消化不良、胃炎、食道炎、食道痛、口腔咽頭痛 |
| 呼吸器 | 咽喉頭疼痛、咽頭炎 | ||
| 血液 | 白血球数増加、血小板数増加、ヘモグロビン減少、白血球分画の異常(リンパ球数増加、好塩基球数増加等) | ||
| 眼 | 斜視、眼運動障害 | ||
| 肝臓 | 肝機能異常(AST増加、ALT増加、γ-GTP増加) | ||
| 腎臓 | 尿蛋白陽性 | 頻尿、多尿、遺尿 | |
| その他 | 疲労、食欲減退 |
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
本剤を健康成人男性に100mg又は200mgを単回経口投与したとき、血漿中の総ビオプテリン濃度及び還元型ビオプテリン濃度は投与後2〜3時間で最高値に達したのち、徐々に減少し、投与後12時間でほぼ内因性レベルに戻った。総ビオプテリンに対する還元型ビオプテリンの割合は約60〜70%の範囲で推移した2)。
| 投与量 | 100mg | 200mg | ||
| 総ビオプテリン | 還元型ビオプテリン | 総ビオプテリン | 還元型ビオプテリン | |
| Tmax(hr) | 3.1±0.2 | 2.8±0.2 | 2.6±0.5 | 2.5±0.5 |
| Cmax(ng/mL) | 6.8±1.0 | 4.9±0.7 | 12.5±3.4 | 9.2±2.7 |
| t1/2(hr) | 3.6±0.4 | 2.9±0.3 | 3.5±0.4 | 3.3±0.4 |
| AUC(ng・hr/mL) | 59.8±8.4 | 38.9±6.5 | 92.0±19.0 | 64.5±15.0 |
16.2 吸収
16.2.1 食事の影響
健康成人計72例を対象とした食事の影響試験(錠剤を用いた10mg/kg/日の単回投与クロスオーバー2試験)において、食後投与のCmaxは空腹投与の138〜183%、食後投与のAUCinfは空腹投与の125〜159%であり、本剤の吸収は食事の影響を受けた3)(外国人データ)。
16.3 分布
16.3.1 ラットにおける組織分布
サプロプテリン塩酸塩をラットに経口投与したとき、副腎、肝臓、腎臓に主に分布し、幼若動物では成熟動物に比し、血漿中及び脳内濃度が高かった。また、サプロプテリン塩酸塩をラットに静脈内投与したとき、胎児、乳汁への移行が認められたが、経口投与では、胎児、乳汁中にはほとんど分布しなかった4)。
16.3.2 血漿蛋白結合率
ヒト血漿蛋白結合率は、総ビオプテリン、還元型ビオプテリンいずれにおいても、血漿中濃度が10ng/mL以下では23〜34%、50ng/mLを超えると10%以下であった5)(in vitro)。
16.4 代謝
ジヒドロプテリジン還元酵素欠損症患者に本剤及びL-セピアプテリンを投与後、尿中主代謝産物としてジヒドロビオプテリン、ジヒドロキサントプテリンが認められた6)(外国人データ)。
16.5 排泄
健康成人男性に本剤100mg又は200mgを単回経口投与したとき、いずれの投与量においても24時間以内に総ビオプテリンとして投与量の約1%が尿中に排泄された2)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<異型高フェニルアラニン血症>
17.1.1 国内第II相臨床試験
国内10施設で異型高フェニルアラニン血症と診断された16例について臨床効果及び血清フェニルアラニン値への影響を検討した結果、次のとおり、有用性が認められた。副作用は6.3%(1/16例)で痙攣発作回数の増加であった7)。
(1)臨床効果
| 疾患名 | 例数 | 最終全般改善度 | 有用度 | ||
| 著明改善 | 中等度改善以上 | 極めて有用 | 有用以上 | ||
| DHBS欠損症 | 14 | 13(92.9) | 14(100) | 13(92.9) | 14(100) |
| DHPR欠損症 | 2 | 1(50.0) | 2(100) | 1(50.0) | 2(100) |
| 計 | 16 | 14(87.5) | 16(100) | 14(87.5) | 16(100) |
(2)血清フェニルアラニン値への影響
異型高フェニルアラニン血症の確定診断時に、16例全例において高値を示していた血清フェニルアラニン値は、本剤の投与開始後、3mg/dL以下に維持された。
血清フェニルアラニン値の変化
<テトラヒドロビオプテリン反応性高フェニルアラニン血症>
17.1.2 国内臨床研究
12例を対象とした臨床研究であり、長期投与された9例のうち本剤の単独療法が行われたのは6例であった。そのうち、5例は本剤1日7.9〜17.0mg/kgの投与で血清フェニルアラニン値は適正に維持されていた8)。副作用は50.0%(6/12例)に認められ、主なものは下痢25.0%(3/12例)、肝機能異常(1例のAST増加、ALT増加の検査値異常を含む)16.7%(2/12例)であった。
17.1.3 海外臨床試験
プラセボ対照二重盲検比較試験において、プラセボ群(47例)の血中フェニルアラニン値の投与前値(平均値±標準偏差)は888.3±323.1μmol/L(14.7±5.3mg/dL)で、6週目の変化量は2.9±239.5μmol/L(0.05±4.0mg/dL)とほとんど変動しなかった。一方、サプロプテリン塩酸塩製剤(BH4製剤)群(41例)の血中フェニルアラニン値は投与前値の842.7±299.6μmol/L(13.9±4.9mg/dL)から1週後には619.9±354.7μmol/L(10.2±5.9mg/dL)に有意に低下した。治療中、血中フェニルアラニン値はこの値より低値で推移し、6週目の変化量は−235.9±257.0μmol/L(−3.9±4.2mg/dL)とプラセボ群に比較して有意(p<0.0001)に低下した。有害事象は51%(21/41例)に認められ、主なものは上気道感染17%(7/41例)、頭痛10%(4/41例)であった9)。
17.2 製造販売後調査等
<異型高フェニルアラニン血症>
17.2.1 使用成績調査
承認後に実施した使用成績調査(10年間)において、27例(DHBS欠損症22例、DHPR欠損症5例)の血清フェニルアラニン値、全般改善度を検討した。血清フェニルアラニン値は、DHBS欠損症では服薬状況が良好であれば全ての患者で3mg/dL以下に維持でき、DHPR欠損症では3mg/dL以下に低下しなかったが5例中4例で低下が認められた。全般改善度は、DHBS欠損症では無効率0%、DHPR欠損症では40.0%(2/5例)であった。副作用は37.0%(10/27例)に認められ、主なものは痙攣11.1%(3/27例)、肝機能異常(2例のγ-GTP増加の検査値異常を含む)11.1%(3/27例)であった。
<テトラヒドロビオプテリン反応性高フェニルアラニン血症>
17.2.2 使用成績調査
承認後に実施した使用成績調査(9年5ヵ月間)において、85例の血清フェニルアラニン値、有効性を評価した。血清フェニルアラニン値は、多くの年齢において維持範囲の上限内で治療されており、維持範囲外で治療されている症例も認められたが血清フェニルアラニン値高値に伴う臨床症状を認めた症例は確認されなかった。有効性評価は、有効92.9%(79/85例)、判定不能7.1%(6/85例)であった。副作用は1.2%(1/85例)に認められ、ALT増加1例であった。
17.3 その他
17.3.1 QT間隔に対する影響
健康成人56例を対象としたthorough QT/QTc試験にて、サプロプテリン塩酸塩20、100mg/kg注)又はプラセボを摂食条件下で単回投与しQTc間隔を測定した。20又は100mg/kg投与で、プラセボと比較しそれぞれ最大3.69ms(90%CI下限5.3ms)、8.32ms(90%CI下限10.6ms)短縮した(外国人データ)。
注)本剤の承認された開始最大用量は1日10mg/kgである。
18. 薬効薬理
18.1 作用機序
サプロプテリン塩酸塩は天然型テトラヒドロビオプテリンを化学合成したものであり、フェニルアラニン水酸化酵素、チロシン水酸化酵素及びトリプトファン水酸化酵素の補酵素である。テトラヒドロビオプテリン欠乏に基づく高フェニルアラニン血症患者では、本剤の補充によりフェニルアラニン値を低下させる。テトラヒドロビオプテリン反応性高フェニルアラニン血症患者では、本剤はフェニルアラニン水酸化酵素の安定性を増加させ、残存活性を賦活化させることによりフェニルアラニン値を低下させると考えられる。
18.2 異型高フェニルアラニン血症モデルに対する作用
18.2.1 ラットの異型高フェニルアラニン血症モデルにサプロプテリン塩酸塩を経口投与したとき、上昇していた血中フェニルアラニン値が正常化した10)。
18.2.2 妊娠後期のモルモットの異型高フェニルアラニン血症モデルにサプロプテリン塩酸塩を経口投与したとき、母動物及び胎児の上昇していた血中フェニルアラニン値が低下した11)。
18.3 脳内ドーパミン、セロトニン生合成に及ぼす影響
ラットの脳室内にテトラヒドロビオプテリンを投与したとき、脳内ドーパミン、セロトニンの含量が用量に比例して増加した12)。
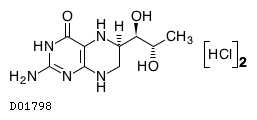
19. 有効成分に関する理化学的知見
19.1. サプロプテリン塩酸塩
20. 取扱い上の注意
アルミ分包開封後は速やかに使用すること。
22. 包装
<ビオプテン顆粒2.5%>
(アルミ分包) 0.4g×100包
<ビオプテン顆粒10%>
(アルミ分包) 1g×30包
23. 主要文献
- 日本先天代謝異常学会−新生児マススクリーニング対象疾患等診療ガイドライン, 11-24, (2019)
- 社内資料:健康成人におけるサプロプテリン塩酸塩の体内動態(1992年3月27日承認、CTD2.7.2.2)
- 社内資料:薬物動態に及ぼす食事の影響(1992年3月27日承認、CTD2.7.2.3)
- 林 敏郎ほか, 基礎と臨床, 26 (8), 3471-3495, (1992)
- 社内資料:ヒトにおける血漿蛋白結合率(1992年3月27日承認、CTD2.7.2.2)
- Curtius HC,et al., Clin Chim Acta., 93 (2), 251-262, (1979) »PubMed
- 北川照男ほか, 小児内科, 22 (11), 1737-1750, (1990)
- 松原洋一ほか, 特殊ミルク情報, (38), 44-59, (2002)
- Levy HL,et al., Lancet, 370 (9586), 504-510, (2007) »PubMed
- 弘津一郎ほか, 応用薬理, 43 (6), 549-553, (1992)
- 藤岡雅司, 大阪市医学会雑誌, 41 (2), 553-568, (1992)
- Miwa S,et al., Arch Biochem Biophys., 239 (1), 234-241, (1985) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
製品情報問い合わせ先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
26. 製造販売業者等
26.1 製造販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1