医薬品情報
| 総称名 | ビンダケル |
|---|---|
| 一般名 | タファミジスメグルミン |
| 欧文一般名 | Tafamidis Meglumine |
| 製剤名 | タファミジスメグルミンカプセル |
| 薬効分類名 | TTR型アミロイドーシス治療薬 |
| 薬効分類番号 | 1290 2190 |
| ATCコード | N07XX08 |
| KEGG DRUG |
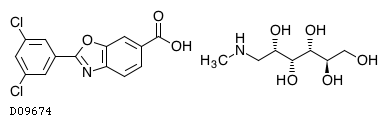
D09674
タファミジスメグルミン
|
| KEGG DGROUP |
DG01009
タファミディス
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年5月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ビンダケルカプセル20mg | Vyndaqel capsules 20mg | ファイザー | 1290001M1022 | 9716.5円/カプセル | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
○トランスサイレチン型家族性アミロイドポリニューロパチーの末梢神経障害の進行抑制
○トランスサイレチン型心アミロイドーシス(野生型及び変異型)
5. 効能または効果に関連する注意
<効能共通>
5.1 本剤の適用にあたっては、最新のガイドライン等を参照し、トランスサイレチンアミロイドーシスの診断が確定していることを確認すること。
5.2 肝移植後の患者における有効性及び安全性は確立していない。臨床試験での使用経験がない。
<トランスサイレチン型家族性アミロイドポリニューロパチー>
5.3 重症度の高い患者(歩行に介助が必要な患者等)における有効性及び安全性は確立していない。臨床試験での使用経験が少ない。
5.4 トランスサイレチンのVal30Met変異型以外の変異を有する患者における有効性及び安全性は確立していない。臨床試験での使用経験が少ない。
<トランスサイレチン型心アミロイドーシス>
5.5 本剤は、トランスサイレチン型心アミロイドーシスによる心不全を有する患者に使用すること。また、「臨床成績」の項の内容を熟知し、臨床試験の選択基準等を十分理解した上で、適応患者の選択を行うこと。[17.1.3参照]
5.6 NYHA心機能分類III度の患者では、NYHA心機能分類I・II度の患者より相対的に本剤の有効性が低い可能性があるので、本剤の作用機序、及び臨床試験で示唆されたNYHA心機能分類と有効性の関係を十分に理解し、患者の状態を考慮した上で、本剤投与の要否を判断すること。[17.1.3参照]
5.7 NYHA心機能分類IV度の患者における有効性及び安全性は確立していない。臨床試験での使用経験がない。
6. 用法及び用量
<トランスサイレチン型家族性アミロイドポリニューロパチー>
通常、成人にはタファミジスメグルミンとして1回20mgを1日1回経口投与する。
<トランスサイレチン型心アミロイドーシス>
通常、成人にはタファミジスメグルミンとして1回80mgを1日1回経口投与する。忍容性がない場合は減量できる。
7. 用法及び用量に関連する注意
<効能共通>
7.1 本剤の使用にあたっては、本剤とタファミジス遊離酸注1)61mgを含有する製剤との取り違えに注意すること。[16.1.3参照]
<トランスサイレチン型心アミロイドーシス>
7.2 タファミジス遊離酸注1)61mgを含有する製剤1カプセル投与時の血漿中タファミジス濃度は本剤4カプセル(タファミジスメグルミン80mg)投与時に相当する。[16.1.3参照]
7.3 タファミジス遊離酸注1)61mgを含有する製剤に忍容性が認められず減量が必要な場合には、本剤を用いること。[16.1.3参照]
7.4 本剤からタファミジス遊離酸注1)61mgを含有する製剤に切り替える場合、タファミジスメグルミン80mgを投与している患者又はタファミジスメグルミン80mgの投与が必要な患者に限りタファミジス遊離酸注1)61mgを含有する製剤1カプセルに切り替えることができる。
注1)一般名はタファミジスであるが、本剤(タファミジスメグルミン)と区別するため、タファミジス遊離酸と記載した。
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者
重度の肝機能障害患者を対象とした有効性及び安全性を指標とした臨床試験は実施していない。[16.6.2参照]
9.4 生殖能を有する者
本剤の消失半減期を考慮し、本剤の投与期間中及び最終投与後1ヵ月間は、妊娠する可能性のある患者には適切な避妊法を用いるように指導すること。[9.5参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている3)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤は乳癌耐性タンパク(BCRP)に対して阻害作用を示す。[16.7.2参照]
薬物代謝酵素用語
乳癌耐性タンパク(BCRP)
10.2 併用注意
| BCRPの基質となる薬剤 メトトレキサート ロスバスタチン イマチニブ等 [16.7.2参照] | 本剤と併用投与した場合、これらの薬剤の副作用が増強されるおそれがあるので、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | 本剤のBCRP阻害作用により、これらの薬剤の血中濃度が増加する可能性がある。 |
11. 副作用
11.2 その他の副作用
| 3%以上 | 1〜3%未満 | 1%未満 | 頻度不明a) | |
| 感覚器 | 回転性めまい | 眼痛、高眼圧症、上強膜炎、聴力低下、網脈絡膜症、眼乾燥 | 鼓膜障害、耳そう痒症、耳痛、耳不快感、眼出血、視力障害、難聴、白内障、霧視 | |
| 肝臓 | γ-GTP増加、肝機能検査値上昇 | 肝酵素上昇、肝腫大、血中ビリルビン増加、肝臓うっ血 | 肝機能異常、AST増加、胆汁うっ滞、胆汁うっ滞性黄疸、尿中ウロビリノーゲン増加、門脈血栓症 | |
| 筋・骨格系 | 背部痛、四肢痛 | 筋攣縮、筋痙縮、頚部痛、腱痛、関節炎、関節痛、筋肉痛、筋肉疲労、筋力低下、骨折 | 足底筋膜炎 | |
| 血液 | 貧血 | 赤血球増加症、国際標準比(INR)増加、血小板減少症 | プロトロンビン時間延長、リンパ節症、大赤血球症、白血球減少 | |
| 呼吸器 | 上咽頭炎、咳嗽 | しゃっくり、咽頭炎、気管支炎、鼻炎、副鼻腔炎、扁桃炎、口腔咽頭痛、睡眠時無呼吸症候群、呼吸困難 | 慢性気管支炎、チェーン・ストークス呼吸、胸水、上気道感染、慢性閉塞性肺疾患、喀血、喘息 | |
| 循環器 | 起立性低血圧、低血圧、房室ブロック | 高血圧、上室性期外収縮、心室性頻脈、心電図異常、頻脈、不整脈、左脚ブロック、心不全、僧帽弁閉鎖不全症 | 心停止、洞結節機能不全、狭心症、三尖弁閉鎖不全症、徐脈、心拍数減少、大動脈弁閉鎖不全症、動悸 | |
| 消化器 | 下痢、悪心 | 消化不良、上腹部痛、腹痛、便秘、嘔吐、鼓腸、食欲減退、腹部膨満、腹部不快感 | 胃炎、胃食道逆流性疾患、胃腸炎、歯感染、歯肉腫脹、消化管運動障害、食道炎、肛門出血、早期満腹、口内乾燥、排便回数増加、痔核 | 軟便、胃腸障害、便習慣変化、おくび、レッチング、感染性腸炎、憩室、口腔障害、十二指腸潰瘍、心窩部不快感、直腸ポリープ、裂孔ヘルニア、嚥下障害、膵炎、膵腫瘤 |
| 精神・神経系 | 頭痛 | 失神、不眠症、浮動性めまい、神経痛 | 異常感覚、一過性脳虚血発作、下肢静止不能症候群、感覚消失、気分変化、傾眠、平衡障害、味覚消失、うつ病、感覚鈍麻、緊張性頭痛、錯感覚、味覚異常、記憶障害 | 錯乱状態、失語症、筋緊張低下、健忘、灼熱感、精神的機能障害、末梢性ニューロパチー |
| 泌尿器・生殖器 | 尿路感染 | 血尿、勃起不全 | 外陰部腟カンジダ症、尿閉、腟感染、膀胱炎 | 尿路痛 |
| 皮膚 | 発疹(湿疹、皮疹、斑状丘疹状皮疹)、そう痒症 | 感染性皮膚潰瘍、四肢膿瘍、色素沈着障害、じん麻疹、脱毛症、皮膚病変、多汗症 | 光線角化症、斑状出血、皮膚乾燥 | |
| 腎臓 | 血中クレアチニン増加、血中尿素増加 | 腎機能障害、急性腎障害、血中クレアチン増加、糸球体濾過率減少、腎感染、腎腫瘤、尿中蛋白陽性 | ||
| その他 | 末梢性浮腫、甲状腺機能低下症 | インフルエンザ様疾患、リンパ腫、血中コレステロール増加、血中テストステロン減少、倦怠感、髄膜炎、体重減少、インフルエンザ、発熱、無力症、疲労、体液貯留、基底細胞癌、血中尿酸増加、女性化乳房、蜂巣炎 | 異常感、水分過負荷、アミロイドーシス、真菌感染、肺炎、悪寒、過敏症、胸部不快感、甲状腺機能亢進症、高尿酸血症、蒼白、痛風、低カリウム血症、低ナトリウム血症、鉄欠乏、転倒、乳房腫脹、乳房腫瘤、末梢腫脹、扁平上皮癌 |
14. 適用上の注意
14.1 薬剤交付時の注意
<効能共通>
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は噛まずに服用させること。
<トランスサイレチン型心アミロイドーシス>
14.1.3 タファミジス遊離酸注1)61mgを含有する製剤から本剤に切り替える場合は、飲み間違えのないよう用法・用量について患者に十分説明すること。
注1)一般名はタファミジスであるが、本剤(タファミジスメグルミン)と区別するため、タファミジス遊離酸と記載した。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人及び外国人健康成人に、タファミジスメグルミン20及び40mg注)を空腹時に単回投与した後の薬物動態パラメータを表1に、血漿中濃度推移を図1に示す。
タファミジスは速やかに吸収され、最高血漿中濃度到達時間(tmax)は投与量によらず、投与後0.5〜4時間であった。最高血漿中濃度(Cmax)及び血漿中濃度−時間曲線下面積(AUC0-∞)の平均値は40mgまでの投与量でほぼ用量に比例して増加した4)。
タファミジスは速やかに吸収され、最高血漿中濃度到達時間(tmax)は投与量によらず、投与後0.5〜4時間であった。最高血漿中濃度(Cmax)及び血漿中濃度−時間曲線下面積(AUC0-∞)の平均値は40mgまでの投与量でほぼ用量に比例して増加した4)。
注)本剤のトランスサイレチン型家族性アミロイドポリニューロパチー及びトランスサイレチン型心アミロイドーシスに対する承認用法用量はそれぞれ1回20mgを1日1回経口投与及び1回80mgを1日1回経口投与である。
| 投与量(mg) | Cmax(μg/mL) | AUC0-∞(μg・h/mL) | tmax(h) | t1/2(h) | |
| 日本人(n=6) | |||||
| 20 | 1.23(0.19) | 60.5(9.8) | 2.5(2〜4) | 40.7(8.7) | |
| 40 | 2.59(0.61) | 115.3(30.7) | 3.0(0.5〜4) | 40.0(10.2) | |
| 外国人(n=3) | |||||
| 20 | 1.06(0.08) | 53.7(7.4) | 3.0(0.5〜4) | 40.6(12.0) | |
| 40 | 2.19(0.39) | 95.2(18.5) | 3.0(1〜4) | 51.0(13.8) | |
図1 タファミジスメグルミンを単回投与後の血漿中濃度推移
(平均値±標準偏差、右図は投与後12時間までの拡大図)
16.1.2 反復投与
16.1.3 タファミジスメグルミン(20mgを4カプセル)とタファミジス遊離酸注1)61mgの相対的バイオアベイラビリティ試験
健康成人にタファミジスメグルミン20mgを4カプセルとタファミジス遊離酸61mgの定常状態時のPKパラメータを比較したところ、両製剤は生物学的同等性の基準を満たした8)(外国人データ)。[7.1-7.3参照]
| AUC0-24(μg・h/mL) | Cmax(μg/mL) | tmax(h) | Cmin(μg/mL) | |
| タファミジス遊離酸61mg | 170.0(23) | 8.55(23) | 4.00(2.00-8.00) | 5.34(27) |
| タファミジスメグルミン(20mg 4カプセル) | 166.2(20) | 9.09(18) | 2.00(0.500-6.02) | 4.90(26) |
図2 タファミジスメグルミン(20mgを4カプセル)とタファミジス遊離酸61mgを7日間反復投与後の血漿中濃度推移
注1)一般名はタファミジスであるが、本剤(タファミジスメグルミン)と区別するため、タファミジス遊離酸と記載した。
16.2 吸収
16.2.1 食事の影響
健康成人にタファミジスメグルミン20mgを空腹時又は食後に単回投与したところ、食事によりCmaxは約23%低下したが、AUC0-lastには影響を及ぼさなかった9)(外国人データ)。
16.3 分布
In vitro試験の結果、タファミジスの血漿蛋白結合率は約99.5%であった10)。
16.4 代謝
In vitro試験において、タファミジスメグルミンはチトクロームP450代謝酵素であるCYP1A2、CYP3A4、CYP3A5、CYP2B6、CYP2C8、CYP2C9、CYP2C19及びCYP2D6を顕著に阻害しなかった。
In vitro試験において、タファミジスメグルミンのCYP1A2活性に対する誘導作用はわずかであったが、CYP3A4及びCYP2B6活性に対しては誘導作用が示唆された。健康成人にタファミジスメグルミンとCYP3A4の基質薬(ミダゾラム)を併用投与したとき、CYP3A4の誘導作用は認められなかった11)12)。[16.7.1参照]
また、臨床用量で想定される血漿中濃度に基づくと、CYP2B6についてもin vivoでの誘導の可能性は低いと考えられた。
16.5 排泄
外国人健康成人に14C-タファミジスメグルミン20mgを単回経口投与した時、血中には主に未変化体が存在した。また、血漿、尿及び糞中には未変化体とタファミジスのグルクロン酸抱合体が存在した。14C-タファミジスメグルミンを投与後、最大23日目までの試料を用いた結果、タファミジスは主に糞を介して排泄され、平均総回収率は総投与量の58.5%であった。一方、尿の平均総回収率は22.4%であった13)。
16.6 特定の背景を有する患者
16.6.1 高齢者
母集団薬物動態解析の結果によると、65歳未満の被験者と比較して、65歳以上の被験者のクリアランスは14.5%低かった14)(外国人データ)。
16.6.2 肝機能障害患者
健康被験者又は軽度及び中等度の肝機能障害を有する被験者にタファミジスメグルミン20mgを単回投与した後の薬物動態パラメータを表3に示す。
軽度(Child-Pughスコア5〜6)の肝機能障害を有する被験者と健康被験者でPKを比較した結果、Cmax及びAUC0-∞は健康被験者に比べてそれぞれ平均6%及び17%低値を示した。
中等度(Child-Pughスコア7〜9)の肝機能障害を有する被験者と健康被験者でPKを比較した結果、Cmaxは平均3%の変化で類似していたがAUC0-∞は健康被験者に比べて平均41%低値を示した15)(外国人データ)。[9.3.1参照]
軽度(Child-Pughスコア5〜6)の肝機能障害を有する被験者と健康被験者でPKを比較した結果、Cmax及びAUC0-∞は健康被験者に比べてそれぞれ平均6%及び17%低値を示した。
中等度(Child-Pughスコア7〜9)の肝機能障害を有する被験者と健康被験者でPKを比較した結果、Cmaxは平均3%の変化で類似していたがAUC0-∞は健康被験者に比べて平均41%低値を示した15)(外国人データ)。[9.3.1参照]
| Cmax(μg/mL) | AUC0-last(μg・h/mL) | tmax(h) | t1/2(h) | ||
| 健康被験者又は軽度の肝機能障害を有する被験者を対象(n=9)a) | |||||
| 健康被験者 | 1.21(0.32) | 66.6(20.8) | 2.0(0.5〜8.0) | 53.9(20.6) | |
| 軽度の肝機能障害を有する被験者 | 1.11(0.20) | 54.5(12.7) | 3.0(0.5〜4.0) | 56.4(18.0) | |
| 健康被験者又は中等度の肝機能障害を有する被験者を対象(n=9) | |||||
| 健康被験者 | 1.28(0.32) | 65.5(14.5) | 2.0(0.5〜8.0) | 54.0(12.0) | |
| 中等度の肝機能障害を有する被験者 | 1.38(0.56) | 42.8(12.9) | 1.0(0.5〜4.0) | 45.1(11.9) | |
16.7 薬物相互作用
16.7.1 ミダゾラム
16.7.2 ロスバスタチン
16.7.3 In vitro試験
タファミジスは乳癌耐性タンパク(BCRP)に対して阻害作用を示し、IC50値は1.16μmol/Lであった18)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<トランスサイレチン型家族性アミロイドポリニューロパチー>
17.1.1 国内第III相試験(中間報告)
トランスサイレチン型家族性アミロイドポリニューロパチー患者10例(Val30Met変異を有する患者9例、Ser77Tyr変異を有する患者1例)に、本剤20mgを1日1回52週間経口投与したとき、主要評価項目である本剤投与8週時及び26週時のトランスサイレチン(TTR)安定化率(%)注1)は、10例全例で32%以上注2)であった19)。
安全性評価対象例10例中、副作用(臨床検査値異常を含む)の発現症例は1例(10.0%)、歯肉腫脹であった。
安全性評価対象例10例中、副作用(臨床検査値異常を含む)の発現症例は1例(10.0%)、歯肉腫脹であった。
17.1.2 海外第II/III相試験
Val30Met変異を有するトランスサイレチン型家族性アミロイドポリニューロパチー患者128例を対象とし、Neuropathy Impairment Score-Lower Limb(NIS-LL)反応率注3)及びNorfolk Quality of Life-Diabetic Neuropathy質問票により評価するTotal Quality of Life(TQOL)スコアの変化量を主要評価項目として、二重盲検比較試験を実施した。本剤20mg又はプラセボを1日1回18ヵ月間経口投与したとき、NIS-LL反応率注3)は本剤群で45.3%(29/64例)、プラセボ群で29.5%(18/61例)であり、統計的に有意な差は認められないものの本剤群で反応率が高かった(p=0.0682、カイ二乗検定)。また、TQOLスコアの変化量(平均値±標準誤差)は本剤群で2.0±2.3、プラセボ群で7.2±2.4であり、統計的に有意な差は認められないものの本剤群でQOL低下が抑制される傾向が認められた(p=0.1157、共分散分析)20)21)22)。
| タファミジス群 (n=64) | プラセボ群 (n=61) | p値 | |
| NIS-LL反応率 | 45.3% | 29.5% | 0.0682 (カイ二乗検定) |
| TQOLスコアの変化量 (平均値±標準誤差) | 2.0±2.3 | 7.2±2.4 | 0.1157 (共分散分析) |
Val30Met以外の変異を有する患者21例8変異を対象として本剤20mgを1日1回経口投与した非盲検試験において主要評価項目であるTTRの安定化率(%)注1)は、6週時には19例中18例(94.7%)、6ヵ月時には18例全例、12ヵ月時には17例全例で32%以上注2)であり、本剤の継続投与による治療効果の持続がみられた。
安全性評価対象例127例中、副作用(臨床検査値異常を含む)の発現症例は67例(52.8%)であった。主な副作用は下痢、頭痛、尿路感染各10例(7.9%)、嘔吐8例(6.3%)、四肢痛7例(5.5%)であった。
安全性評価対象例127例中、副作用(臨床検査値異常を含む)の発現症例は67例(52.8%)であった。主な副作用は下痢、頭痛、尿路感染各10例(7.9%)、嘔吐8例(6.3%)、四肢痛7例(5.5%)であった。
<トランスサイレチン型心アミロイドーシス>
17.1.3 国際共同第III相試験
野生型又は変異型のトランスサイレチン型心アミロイドーシス患者注4)[全集団441例、うち日本人患者17例(すべて野生型)含む]を対象とした、30ヵ月間の二重盲検プラセボ対照試験(本剤80、20mg及びプラセボを1日1回投与)を実施した。本剤併合群(本剤80及び20mg群)は264例(本剤80mg群は176例、20mg群は88例)、プラセボ群は177例であった。日本人症例は、本剤併合群は12例(80mg群は10例、20mg群は2例)、プラセボ群は5例であった。主要評価項目である死因を問わない死亡及び心血管事象に関連する入院頻度を組み合わせた評価項目において、本剤併合群でプラセボ群と比べて統計的に有意な差が認められた(p=0.0006、Finkelstein-Schoenfeld法)。
| タファミジス併合群 (n=264) | プラセボ群 (n=177) | |
| 30ヵ月時点の生存症例数(%)a,b) | 186(70.5%) | 101(57.1%) |
| 1年あたりの心血管事象に関連して入院した回数(平均値)a,b,c) | 0.297 | 0.455 |
| p値d) | 0.0006 | |
本剤の用量別の探索的解析では、30ヵ月時点の生存割合は本剤80mg群69.3%(122/176例)、本剤20mg群72.7%(64/88例)、生存例における心血管事象に関連する平均入院頻度は、本剤80mg群で0.339回/年、本剤20mg群で0.218回/年であった。
ベースラインのNYHA心機能分類別の探索的解析の結果、30ヵ月時点の生存割合はNYHA心機能分類I・II度の集団で本剤併合群81.2%(151/186例)、プラセボ群67.5%(77/114例)、NYHA心機能分類III度の集団で本剤併合群44.9%(35/78例)、プラセボ群38.1%(24/63例)、生存例における心血管事象に関連する平均入院頻度は、NYHA心機能分類I・II度の集団で本剤併合群0.246回/年、プラセボ群0.457回/年、NYHA心機能分類III度の集団で本剤併合群0.516回/年、プラセボ群0.447回/年であった。
安全性評価対象例264例(日本人患者12例を含む)中、副作用(臨床検査値異常を含む)の発現症例は113例(42.8%)であった。主な副作用は下痢16例(6.1%)、悪心11例(4.2%)及び尿路感染10例(3.8%)であった23)。[5.5、5.6参照]
ベースラインのNYHA心機能分類別の探索的解析の結果、30ヵ月時点の生存割合はNYHA心機能分類I・II度の集団で本剤併合群81.2%(151/186例)、プラセボ群67.5%(77/114例)、NYHA心機能分類III度の集団で本剤併合群44.9%(35/78例)、プラセボ群38.1%(24/63例)、生存例における心血管事象に関連する平均入院頻度は、NYHA心機能分類I・II度の集団で本剤併合群0.246回/年、プラセボ群0.457回/年、NYHA心機能分類III度の集団で本剤併合群0.516回/年、プラセボ群0.447回/年であった。
安全性評価対象例264例(日本人患者12例を含む)中、副作用(臨床検査値異常を含む)の発現症例は113例(42.8%)であった。主な副作用は下痢16例(6.1%)、悪心11例(4.2%)及び尿路感染10例(3.8%)であった23)。[5.5、5.6参照]
注1)TTR安定化率(%)=[(本剤投与後の平均FOI−ベースラインの平均FOI)/ベースラインの平均FOI]×100
FOI=尿素添加後のTTR4量体濃度/尿素添加前のTTR4量体濃度
注2)TTR安定化率が32%以上をTTRが安定化したと定義
注3)NIS-LLスコアのベースラインからの増加が2未満
注4)主な選択基準は以下のとおりであった。
NYHA心機能分類I〜III度で、少なくとも1回の心不全による入院歴がある患者又は入院歴がなくとも利尿薬による治療歴のある循環血流量増加若しくは心内圧亢進の所見を伴う心不全を有する患者
野生型
・TTR遺伝子変異を有さない
・組織生検によるアミロイド沈着が認められる
・免疫組織染色、質量分析法等によりアミロイド前駆タンパク質がTTRであると同定される
・心エコーによる拡張末期の心室中隔厚が12mm超
変異型
・心筋症症状及び心筋症と関連するTTR遺伝子変異を有する
・組織生検によるアミロイド沈着が認められる
・心エコーによる拡張末期の心室中隔厚が12mm超
18. 薬効薬理
18.1 作用機序
タファミジスはTTRの天然構造である4量体の2つのサイロキシン結合部位のうち少なくとも1つに結合することで4量体を安定化させ、その解離及び変性を抑制し、新たなTTRアミロイド形成を抑制する24)。
18.1.1 In vitro試験において、TTRとの結合に関する解離定数は2〜3nmol/L(Kd1)及び154〜278nmol/L(Kd2)であった。
18.1.2 In vitro試験において、野生型、Val30Met及びVal122Ile変異型TTR(3.6μmol/L)の酸性条件下における線維形成を抑制し、それぞれに対するEC50値は、2.7、3.2及び4.1μmol/Lであった。
18.1.3 In vitro試験において、野生型、Val30Met、Val122Ile変異型TTRを有するヒト血漿に本薬3.6又は7.2μmol/Lを添加することにより、尿素による4量体の解離を濃度依存的に抑制した。
18.1.4 Val30Met以外の変異を有する被験者から採取した血漿に本薬7.2μmol/Lを添加したところ、25種の変異型で尿素による解離が抑制された。
19. 有効成分に関する理化学的知見
19.1. タファミジスメグルミン
20. 取扱い上の注意
高温を避けて保存すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
<トランスサイレチン型心アミロイドーシス>
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
14カプセル[14カプセル(PTP)×1]
112カプセル[14カプセル(PTP)×8]
23. 主要文献
- 社内資料:胚・胎児発生に関する試験(2013年9月20日承認、CTD2.6.6.6)
- 社内資料:出生前及び出生後の発生並びに母体の機能に関する試験(2013年9月20日承認、CTD2.6.6.6)
- 社内資料:反復投与時の乳汁排泄試験(2013年9月20日承認、CTD2.6.4.6)
- 社内資料:単回投与時の薬物動態(2013年9月20日承認、CTD2.7.2.2)
- 社内資料:日本人患者における反復投与時の薬物動態(2013年9月20日承認、CTD2.7.2.2)
- 社内資料:母集団PK解析(健康成人、トランスサイレチン型家族性アミロイドポリニューロパチー患者)(2019年3月26日承認、CTD2.7.2.3)
- 社内資料:20mg 4カプセル反復投与時の薬物動態(2019年3月26日承認、CTD2.7.2.2)
- 社内資料:タファミジス遊離酸61mgカプセルとタファミジスメグルミン20mgカプセル4個の相対的バイオアベイラビリティ試験(2021年9月27日承認、ビンマックカプセル61mg CTD2.7.1)
- 社内資料:食事の影響試験(2013年9月20日承認、CTD2.7.6.2)
- 社内資料:ヒト血漿蛋白への結合試験(2013年9月20日承認、CTD.2.6.4.4)
- 社内資料:酵素阻害及び誘導(2013年9月20日承認、CTD2.6.4.5)
- 社内資料:酵素誘導試験(2019年3月26日承認、CTD2.6.4.7)
- 社内資料:吸収、分布、代謝及び排泄を検討する試験(2013年9月20日承認、CTD2.7.6.6)
- 社内資料:母集団PK解析(健康成人、トランスサイレチン型家族性アミロイドポリニューロパチー患者、トランスサイレチン型心アミロイドーシス患者)(2019年3月26日承認、CTD2.7.2.3)
- 社内資料:肝機能障害患者における薬物動態(2013年9月20日承認、CTD2.7.2.2)
- 社内資料:ミダゾラムとの薬物相互作用試験(2013年9月20日承認、CTD2.7.2.2)
- 社内資料:ロスバスタチンを用いた薬物相互作用試験
- 社内資料:BCRPに対するin vitro相互作用試験(2019年3月26日承認、CTD2.6.4.7)
- 社内資料:国内第3相非盲検試験(中間報告)(2013年9月20日承認、CTD2.7.6.9)
- Coelho,T.,et al., Neurology., 79 (8), 785-792, (2012) »PubMed
- 社内資料:外国第2/3相二重盲検比較試験(V30M変異を有する患者)(2013年9月20日承認、CTD2.7.3.3、2.7.6.9)
- 社内資料:外国非盲検試験(V30M以外の変異を有する患者)(2013年9月20日承認、CTD2.7.6.11)
- 社内資料:トランスサイレチン型心アミロイドーシス患者を対象とした国際共同試験(2019年3月26日承認、CTD2.7.3.2)
- 社内資料:効力を裏付ける試験(2013年9月20日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
製品情報問い合わせ先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7