医薬品情報
| 総称名 | オーキシス |
|---|---|
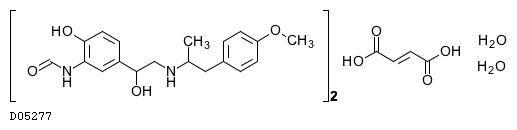
| 一般名 | ホルモテロールフマル酸塩水和物 |
| 欧文一般名 | Formoterol Fumarate Hydrate |
| 製剤名 | ホルモテロールフマル酸塩水和物吸入剤 |
| 薬効分類名 | ドライパウダー吸入式気管支拡張剤 |
| 薬効分類番号 | 2259 |
| ATCコード | R03AC13 R03CC15 |
| KEGG DRUG |
D05277
ホルモテロールフマル酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オーキシス9μgタービュヘイラー28吸入 | Oxis 9μg Turbuhaler 28 doses | アストラゼネカ | 2259711G1024 | 1058.9円/キット | 処方箋医薬品注) |
| オーキシス9μgタービュヘイラー60吸入 | Oxis 9μg Turbuhaler 60 doses | アストラゼネカ | 2259711G2020 | 2219.3円/キット | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対して過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤は慢性閉塞性肺疾患の症状の長期管理に用いること。本剤は慢性閉塞性肺疾患の急性増悪の治療を目的として使用する薬剤ではない。
6. 用法及び用量
通常、成人には1回1吸入(ホルモテロールフマル酸塩水和物として9μg)を1日2回吸入投与する。
7. 用法及び用量に関連する注意
7.1 本剤を他の長時間作動型β2刺激剤又は長時間作動型β2刺激剤を含む配合剤と同時に使用しないこと。
8. 重要な基本的注意
8.1 用法・用量どおり正しく使用しても効果が認められない場合には、本剤が適当ではないと考えられるので、漫然と投与を継続せず中止すること。
8.2 過度に本剤の使用を続けた場合、不整脈、場合により心停止を起こすおそれがあるので、用法・用量を超えて投与しないよう注意すること。また、患者に対し、本剤の過度の使用による危険性について理解させ、用法・用量を超えて使用しないよう注意を与えること。[13.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 甲状腺機能亢進症の患者
甲状腺機能亢進症の症状を悪化させるおそれがある。
9.1.2 高血圧の患者
血圧を上昇させるおそれがある。
9.1.3 心疾患のある患者
β1作用により症状を増悪させるおそれがある。
9.1.4 糖尿病の患者
グリコーゲン分解作用により症状を増悪させるおそれがある。
9.1.5 低カリウム血症の患者
Na+/K+ ATPaseを活性化し細胞外カリウムを細胞内へ移動させることにより低カリウム血症を増悪させるおそれがある。
9.1.6 気管支喘息を合併した患者
気管支喘息の管理が十分行われるよう注意すること。
9.1.7 低酸素血症の患者
血清カリウム値をモニターすることが望ましい。低酸素血症は血清カリウム値の低下が心リズムに及ぼす作用を増強することがある。[11.1.1参照]
9.3 肝機能障害患者
9.3.1 重度な肝機能障害のある患者
本剤は主に肝臓で代謝されるため血中濃度が上昇する可能性がある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
ホルモテロール3mg/kg/日あるいは15mg/kg/日の経口投与により、ラット母動物では、着床数の減少及び吸収胚数並びに出生児損失の増加がみられ、同腹児数及び同腹児重量が低下したことが報告されている。
ホルモテロール3mg/kg/日あるいは15mg/kg/日の経口投与により、ラット母動物では、着床数の減少及び吸収胚数並びに出生児損失の増加がみられ、同腹児数及び同腹児重量が低下したことが報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
ホルモテロールのヒト乳汁への移行は不明であるが、ラット乳汁への移行が報告されている。
ホルモテロールのヒト乳汁への移行は不明であるが、ラット乳汁への移行が報告されている。
9.7 小児等
小児等に対する臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| カテコールアミン アドレナリン イソプレナリン等 | 不整脈、場合によっては心停止を起こすおそれがあるので、副作用の発現に注意し、異常が認められた場合には適切な処置を行うこと。 | 併用により、アドレナリン作動性神経刺激の増大が起きる。 そのため、不整脈を起こすことがある。 |
| キサンチン誘導体 テオフィリン アミノフィリン等 [11.1.1参照] | 低カリウム血症による不整脈を起こすおそれがある。血清カリウム値のモニターを行うことが望ましい。 | キサンチン誘導体はアドレナリン作動性神経刺激を増大させるため、血清カリウム値の低下を増強することがある。 |
| 全身性ステロイド剤 プレドニゾロン ベタメタゾン等 [11.1.1参照] | 低カリウム血症による不整脈を起こすおそれがある。血清カリウム値のモニターを行うことが望ましい。 | 全身性ステロイド剤及び利尿剤は尿細管でのカリウム排泄促進作用があるため、血清カリウム値の低下が増強することが考えられる。 |
| 利尿剤 フロセミド等 [11.1.1参照] | 低カリウム血症による不整脈を起こすおそれがある。血清カリウム値のモニターを行うことが望ましい。 | 全身性ステロイド剤及び利尿剤は尿細管でのカリウム排泄促進作用があるため、血清カリウム値の低下が増強することが考えられる。 |
| β遮断剤 アテノロール等 | 本剤の作用を減弱する可能性がある。 | β受容体において競合的に拮抗する。 |
| QT間隔延長を起こすことが知られている薬剤 抗不整脈剤 三環系抗うつ剤等 | QT間隔が延長され心室性不整脈等のリスクが増大するおそれがある。 | いずれもQT間隔を延長させる可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.2 その他の副作用
| 0.1〜1%未満 | 頻度不明 | |
| 過敏症 | 発疹、蕁麻疹、接触性皮膚炎等の過敏症状 | |
| 口腔・呼吸器 | 気管支痙攣注) | |
| 消化器 | 悪心 | |
| 精神神経系 | 睡眠障害 | 頭痛、振戦、めまい、味覚障害、激越、情緒不安 |
| 循環器 | 動悸、不整脈(心房細動、上室性頻脈、期外収縮等)、狭心症 | 頻脈、血圧上昇 |
| 筋・骨格系 | 筋痙攣 | |
| 内分泌 | 高血糖 |
13. 過量投与
13.1 症状
本剤の過量投与により、動悸、頻脈、不整脈、振戦、頭痛及び筋痙攣等、β刺激剤の薬理学的作用による全身作用が発現する可能性がある。また、重篤な症状として、血圧低下、代謝性アシドーシス、低カリウム血症、高血糖、心室性不整脈あるいは心停止等が発現する可能性がある。[8.2参照]
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 吸入前
(1)本剤の投与にあたって、吸入器の操作法、吸入法等を十分に説明すること。
(2)患者に本剤を交付する際には、包装中に添付している患者用説明文書を渡し、使用方法を指導すること。
(3)初めて本剤を投与する患者には、本剤が十分に気道に到達するよう吸入方法をよく説明したうえ、吸入の訓練をさせること。
14.1.2 吸入時
本剤は口腔内への吸入投与のみに使用すること。
14.1.3 保管時
(1)使用後は必ずキャップ(カバー)を閉めて保管すること。
(2)マウスピースの外側を週に1〜2回乾燥した布で清拭すること(水洗いはしないこと)。
16. 薬物動態
16.1 血中濃度
健康成人(15例)に本剤54μg注)を活性炭の経口併用投与下で単回吸入投与したとき、ホルモテロールは速やかに吸収され、投与後10分以内に最高血漿中濃度(幾何平均266pmol/L)に達した。終末相の半減期は8.5時間であった。また、ホルモテロール27μg注)を単回静脈内投与した時の定常状態分布容積は約5L/kgであった1)(外国人データ)。
図1 単回吸入投与後の血漿中ホルモテロール濃度(15例の平均値±標準偏差)
16.3 分布
16.4 代謝
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第III相試験
日本人患者を含む慢性閉塞性肺疾患患者を対象とした国際共同二重盲検比較試験において、本剤(ホルモテロールフマル酸塩水和物)4.5μg1回2吸入1日2回を199例(日本人患者108例を含む)に12週間投与したところ、本剤吸入60分後における肺機能検査値(FEV1)において、プラセボを投与された208例(日本人患者110例を含む)に比較して有意な上昇を示し、本剤吸入前FEV1値(トラフFEV1値)においてもプラセボに比較して有意な上昇を示した。FEV1値の改善は本剤吸入5分後に発現した。また、本剤はプラセボに比較して慢性閉塞性肺疾患の症状による夜間覚醒、呼吸困難、咳(各々の程度を点数化して評価)並びにSt.George's Respiratory Questionnaire(SGRQ)による健康関連の生活の質(QOL)を有意に改善した6)。
| FEV1値測定時期 | 投与群 | 症例数 | 平均変化量(%)注1) | プラセボ群との差注2) [95%信頼区間] (p値) |
| 吸入60分後 | プラセボ | 208 | 101.28 | − |
| ホルモテロールフマル酸塩水和物 | 199 | 113.36 | 1.114 [1.083,1.145] (<0.0001) | |
| 吸入前(トラフ) | プラセボ | 204 | 99.77 | − |
| ホルモテロールフマル酸塩水和物 | 196 | 104.65 | 1.044 [1.017,1.072] (=0.0015) |
副作用発現頻度は、本剤群で3.5%(7/199例)であった。副作用の内訳は、慢性閉塞性肺疾患1.0%(2/199例)、狭心症、心房粗動、動悸、筋骨格系胸痛、眼瞼炎及び不眠症各0.5%(1/199例)であった。
17.1.2 国内長期投与試験
国内の慢性閉塞性肺疾患患者を対象とした長期投与試験において、本剤の9μg1回1吸入1日2回を125例に52週間投与したとき、投与前からのFEV1の改善が投与後52週間維持された7)。
副作用発現頻度は、本剤群で5.6%(7/125例)であった。副作用の内訳は、咽頭炎、肺炎、慢性閉塞性肺疾患、薬疹、尿中ブドウ糖陽性、狭心症及び心室性期外収縮 各0.8%(1/125例)であった。
副作用発現頻度は、本剤群で5.6%(7/125例)であった。副作用の内訳は、咽頭炎、肺炎、慢性閉塞性肺疾患、薬疹、尿中ブドウ糖陽性、狭心症及び心室性期外収縮 各0.8%(1/125例)であった。
18. 薬効薬理
19. 有効成分に関する理化学的知見
19.1. ホルモテロールフマル酸塩水和物
22. 包装
<オーキシス9μgタービュヘイラー28吸入>
[1本、乾燥剤入り]
<オーキシス9μgタービュヘイラー60吸入>
[1本、乾燥剤入り]
23. 主要文献
- 社内資料:ホルモテロール吸入投与時の肺内到達率(SD-037-0602)(2009年10月16日承認、CTD2.7.2.2)
- 社内資料:ホルモテロールのin vitro血漿蛋白結合(843-RD-0354)(2009年10月16日承認、CTD2.7.2.2)
- Rosenborg J,et al., Drug Metab Dispos., 27, 1104-16, (1999) »PubMed
- 社内資料:ホルモテロールのシトクロムP450阻害作用の検討(843-RD-0395)(2009年10月16日承認、CTD2.7.2.2)
- 社内資料:吸入ホルモテロールの第I相単回投与試験(37-3032)(2009年10月16日承認、CTD2.7.2.2)
- Bogdan MA,et al., BMC Pulm Med., 11, 1471-9, (2011)
- 社内資料:日本人慢性閉塞性肺疾患患者における国内第III相長期投与試験(2012年6月29日承認、CTD2.7.3.3)
- Ullman A,et al., Allergy., 47, 384-7, (1992) »PubMed
- Ida H., Arzneimittelforschung., 26 (7), 1337-40, (1976) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
Meiji Seikaファルマ株式会社
くすり相談室
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル0120-093-396
03-3273-3539
03-3273-3539
FAX:03-3272-2438
製品情報問い合わせ先
Meiji Seikaファルマ株式会社
くすり相談室
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル0120-093-396
03-3273-3539
03-3273-3539
FAX:03-3272-2438
26. 製造販売業者等
26.1 製造販売元
アストラゼネカ株式会社
大阪市北区大深町3番1号
26.2 販売元
Meiji Seikaファルマ株式会社
東京都中央区京橋2-4-16