医薬品情報
| 総称名 | シンバスタチン |
|---|---|
| 一般名 | シンバスタチン |
| 欧文一般名 | Simvastatin |
| 薬効分類名 | HMG-CoA還元酵素阻害剤 高脂血症治療剤 |
| 薬効分類番号 | 2189 |
| ATCコード | C10AA01 |
| KEGG DRUG |
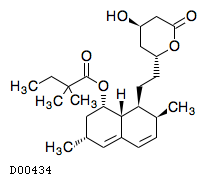
D00434
シンバスタチン
|
| KEGG DGROUP |
DG01946
脂質低下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年6月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| シンバスタチン錠5mg「オーハラ」 (後発品) | SIMVASTATIN TABLETS 5mg「OHARA」 | 大原薬品工業 | 2189011F1262 | 10.4円/錠 | 処方箋医薬品注) |
| シンバスタチン錠10mg「オーハラ」 (後発品) | SIMVASTATIN TABLETS 10mg「OHARA」 | 大原薬品工業 | 2189011F2226 | 24.2円/錠 | 処方箋医薬品注) |
| シンバスタチン錠20mg「オーハラ」 (後発品) | SIMVASTATIN TABLETS 20mg「OHARA」 | 大原薬品工業 | 2189011F3206 | 74.9円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
適用の前に十分な検査を実施し、高脂血症、家族性高コレステロール血症であることを確認した上で本剤の適用を考慮すること。
本剤は高コレステロール血症が主な異常である高脂血症によく反応する。
本剤は高コレステロール血症が主な異常である高脂血症によく反応する。
6. 用法及び用量
通常、成人にはシンバスタチンとして5mgを1日1回経口投与する。なお、年齢、症状により適宜増減するが、LDL-コレステロール値の低下が不十分な場合は1日20mgまで増量できる。
7. 用法及び用量に関連する注意
服用時間
コレステロールの生合成は夜間に亢進することが報告されており、本剤の臨床試験においても、朝食後に比べ、夕食後投与がより効果的であることが確認されている。したがって、本剤の適用にあたっては、1日1回夕食後投与とすることが望ましい。
8. 重要な基本的注意
8.1 あらかじめ高脂血症治療の基本である食事療法を行い、更に運動療法や、高血圧・喫煙等の虚血性心疾患のリスクファクターの軽減等も十分考慮すること。
8.2 投与中は血中脂質値を定期的に検査し、治療に対する反応が認められない場合には投与を中止すること。
8.3 肝炎、黄疸等の肝機能障害があらわれることがある。また、まれに肝不全に至ることがあるので、定期的に肝機能検査等の観察を十分に行うこと。[11.1.3参照]
8.4 血小板減少があらわれることがあるので、血液検査等の観察を十分に行うこと。[11.1.5参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 アルコール中毒患者
本剤は主に肝臓において代謝され、作用するので肝障害を悪化させるおそれがある。
9.1.2 横紋筋融解症があらわれやすいとの報告がある以下の患者
9.1.3 重症筋無力症又はその既往歴のある患者
重症筋無力症(眼筋型、全身型)が悪化又は再発することがある。[11.1.8参照]
9.2 腎機能障害患者
9.2.1 腎障害又はその既往歴のある患者
横紋筋融解症の報告例の多くが腎機能障害を有する患者であり、また、横紋筋融解症に伴って急激な腎機能の悪化が認められている。
9.2.2 腎機能検査値異常のある患者
本剤とフィブラート系薬剤を併用する場合には、治療上やむを得ないと判断される場合にのみ併用することとし、本剤の投与量は10mg/日を超えないこと。急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。やむを得ず併用する場合には、定期的に腎機能検査等を実施し、自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。[10.2参照]
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。本剤は主に肝臓において代謝され作用するので肝障害を悪化させるおそれがある。[2.2参照]
9.3.2 肝障害又はその既往歴のある患者(重篤な肝障害のある患者を除く)
本剤は主に肝臓において代謝され、作用するので肝障害を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。ラットでシンバスタチンの活性代謝物(オープンアシド体)及び他のHMG-CoA還元酵素阻害剤の大量投与で胎児の骨格奇形が報告されている。[2.3参照]
9.6 授乳婦
投与しないこと。ラットで乳汁中への移行が観察されている。[2.3参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。また、横紋筋融解症があらわれやすいとの報告がある。[11.1.1参照]
10. 相互作用
相互作用序文
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
OATP1B1
薬物代謝酵素用語
乳癌耐性蛋白(BCRP)
10.1 併用禁忌
10.2 併用注意
| クマリン系抗凝固剤: ワルファリンカリウム | 抗凝血作用がわずかに増強する。 クマリン系抗凝固剤を併用する場合はプロトロンビン時間をモニターし抗凝固剤の量を調節すること。 | 機序不明 |
| フィブラート系薬剤: ベザフィブラート等 [9.2.2参照] | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。併用を必要とする場合には、本剤の投与量は10mg/日を超えないこと。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。 | これらの薬剤も横紋筋融解症が知られている。 危険因子:腎機能に関する臨床検査値に異常が認められる患者 |
| ダナゾール | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。併用を必要とする場合には、本剤の投与量は10mg/日を超えないこと。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。 | 腎障害のある患者には特に注意すること。 |
| シクロスポリン | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。併用を必要とする場合には、本剤の投与量は10mg/日を超えないこと。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。 | シクロスポリンはCYP3A4を阻害し、併用により本剤の代謝が抑制されるおそれがある。シクロスポリンのOATP1B1阻害作用により、本剤のオープンアシド体の肝取り込みが抑制され、血漿中濃度が上昇するおそれがある。腎障害のある患者には特に注意すること。 |
| エリスロマイシン クラリスロマイシン HIVプロテアーゼ阻害剤: リトナビル等 | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。 | これらの薬剤はCYP3A4を阻害し、併用により本剤の代謝が抑制されるおそれがある。腎障害のある患者には特に注意すること。 |
| ニコチン酸 | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。 | 腎障害のある患者には特に注意すること。 |
| エファビレンツ | 併用により本剤の血漿中濃度が低下したとの報告がある。 | エファビレンツのCYP3A4誘導作用により本剤の代謝が促進されるおそれがある。 |
| アミオダロン アムロジピン ベラパミル | 併用により本剤のAUCが上昇し、横紋筋融解症又はミオパチーが起きるおそれがある。 | 機序不明 |
| ジルチアゼム | 併用により本剤のAUCが上昇し、横紋筋融解症又はミオパチーが起きるおそれがある。 | ジルチアゼムによりCYP3A4を介する本剤の代謝が抑制されるおそれがある。 |
| グレープフルーツジュース | 併用により本剤のAUCが上昇したとの報告がある。本剤の投与中はグレープフルーツジュースの摂取は避けること。 | グレープフルーツジュースはCYP3A4を阻害し、本剤の代謝が抑制されるおそれがある。 |
| グラゾプレビル | 併用により本剤の血漿中濃度が上昇するおそれがある。 | グラゾプレビルが腸管のCYP3A及びBCRPを阻害する。 |
| バダデュスタット | 併用により本剤の血漿中濃度が上昇するおそれがある。 | バダデュスタットがBCRPを阻害する。 |
| ダプトマイシン | 併用した場合CKが上昇する可能性があることから、ダプトマイシン投与中は本剤の休薬を考慮すること。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 横紋筋融解症、ミオパチー(いずれも頻度不明)
11.1.2 免疫介在性壊死性ミオパチー(頻度不明)
近位筋脱力、CK高値、炎症を伴わない筋線維の壊死、抗HMG-CoA還元酵素(HMGCR)抗体陽性等を特徴とする免疫介在性壊死性ミオパチーがあらわれ、投与中止後も持続する例が報告されているので、患者の状態を十分に観察すること。なお、免疫抑制剤投与により改善がみられたとの報告例がある。
11.1.3 肝炎、肝機能障害、黄疸(いずれも頻度不明)
まれに肝不全に至ることがある。[8.3参照]
11.1.4 末梢神経障害(頻度不明)
四肢の感覚鈍麻、しびれ感・冷感等の感覚障害、あるいは筋力低下等の末梢神経障害があらわれることがある。
11.1.5 血小板減少(0.2%)[8.4参照]
11.1.6 過敏症候群(頻度不明)
ループス様症候群、血管炎等を含む過敏症候群が報告されている。
11.1.7 間質性肺炎(0.07%)
長期投与であっても、発熱、咳嗽、呼吸困難、胸部X線異常等が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.8 重症筋無力症(頻度不明)
重症筋無力症(眼筋型、全身型)が発症又は悪化することがある。[9.1.3参照]
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 消化器 | 腹痛、嘔気、嘔吐、下痢、消化不良、食欲不振、便秘、腹部膨満感、口内炎 | 膵炎、鼓腸放屁、舌炎 | |
| 肝臓 | AST上昇、ALT上昇、LDH上昇、γ-GTP上昇 | Al-P上昇、総ビリルビン値上昇 | |
| 皮膚 | そう痒、発疹、蕁麻疹、脱毛、紅斑 | 光線過敏、扁平苔癬 | |
| 筋肉 | CK上昇、ミオグロビン上昇 | 筋肉痛、筋痙攣 | |
| 血液 | 白血球減少 | 貧血 | |
| 精神神経系 | 頭痛、めまい、しびれ | 不眠、認知機能障害(記憶障害、混乱等)、抑うつ | |
| その他 | 倦怠感、BUN上昇、浮腫、関節痛、ほてり、胸痛、味覚異常、勃起不全、HbA1c上昇、血糖値上昇、テストステロン低下 | 心悸亢進、頻尿、口渇、耳鳴、発熱 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
海外において、本剤を含むHMG-CoA還元酵素阻害剤投与中の患者では、糖尿病発症のリスクが高かったとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性に2.5注)、5、10及び20mgを1回経口投与したとき、HMG-CoA還元酵素阻害活性より求めた血漿中薬物濃度は投与量に依存して増加し、投与後1.4〜3.7時間で最高値に達した3)。
16.1.2 連続投与時の蓄積性
健康成人に20mg 1日1回又は10mg 1日2回注)を7日間連続経口投与したとき、投与7日目の薬物動態パラメータは投与1日目と比較して有意な変動はみられず、蓄積性は認められなかった3)。
16.1.3 生物学的同等性試験
<シンバスタチン錠5mg「オーハラ」>
シンバスタチン錠5mg「オーハラ」とリポバス錠5を、クロスオーバー法によりそれぞれ1錠(シンバスタチンとして5mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された4)。
| n | AUC(0-12)(ng・h/mL) | Cmax(ng/mL) | tmax(h) | t1/2(h) | |
| シンバスタチン錠5mg「オーハラ」 | 20 | 2.04±0.88 | 0.51±0.24 | 2.2±2.5 | 3.4±2.6 |
| リポバス錠5 | 20 | 1.89±0.95 | 0.55±0.33 | 1.6±0.7 | 2.8±1.5 |
血漿中シンバスタチン濃度の推移
<シンバスタチン錠10mg「オーハラ」>
シンバスタチン錠10mg「オーハラ」とリポバス錠10を、クロスオーバー法によりそれぞれ1錠(シンバスタチンとして10mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された5)。
| n | AUC(0-24)(ng・h/mL) | Cmax(ng/mL) | tmax(h) | t1/2(h) | |
| シンバスタチン錠10mg「オーハラ」 | 20 | 7.50±5.78 | 2.70±2.76 | 1.3±0.6 | 2.1±1.2 |
| リポバス錠10 | 20 | 8.07±6.62 | 2.48±1.82 | 1.5±0.8 | 3.1±2.4 |
血漿中シンバスタチン濃度の推移
<シンバスタチン錠20mg「オーハラ」>
シンバスタチン錠20mg「オーハラ」とリポバス錠20を、クロスオーバー法によりそれぞれ1錠(シンバスタチンとして5mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された6)。
| n | AUC(0-24)(ng・h/mL) | Cmax(ng/mL) | tmax(h) | t1/2(h) | |
| シンバスタチン錠20mg「オーハラ」 | 23 | 15.61±7.96 | 4.31±2.98 | 1.1±0.6 | 4.0±2.1 |
| リポバス錠20 | 23 | 16.11±9.00 | 3.97±1.74 | 2.0±1.5 | 3.7±2.4 |
血漿中シンバスタチン濃度の推移
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、血液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
健康成人男性に2.5注)、5、10及び20mgを1回経口投与したとき、速やかに吸収された3)。
16.4 代謝
16.5 排泄
シンバスタチンの主排泄経路は胆汁排泄であると考えられ、健康成人男性に2.5注)、5、10及び20mgを1回経口投与したとき、投与後24時間までの総阻害物質の尿中排泄率は投与量の0.34〜0.42%であった3)。
注)本剤の承認された用法及び用量は、シンバスタチンとして5mgを1日1回経口投与である。なお、年齢、症状により適宜増減するが、LDL-コレステロール値の低下が不十分な場合は1日20mgまで増量できる。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相臨床試験(5〜20mg/日投与)
シンバスタチン5〜20mgを1日1回投与した二重盲検比較試験において、10mg又は20mg投与群で用量依存的なLDL-コレステロールの低下がみられ、5mg 1日1回投与時に比較して明らかな増量効果が認められている。なお、用量間に安全性についての差異は認められなかった8)。
17.3 その他
18. 薬効薬理
18.1 作用機序
18.2 コレステロール合成阻害作用
18.3 脂質低下作用
18.4 動脈硬化進展抑制作用
シンバスタチンは、コレステロール負荷ウサギにおける大動脈及び冠状動脈硬化の進展を有意に抑制した16)。
18.5 外因性コレステロール吸収抑制作用
コレステロール負荷ウサギにおいてシンバスタチンを連続経口投与したとき、消化管からの[3H]コレステロールの吸収が抑制された17)。
19. 有効成分に関する理化学的知見
19.1. シンバスタチン
20. 取扱い上の注意
開封後は湿気を避けて保存すること。
22. 包装
<シンバスタチン錠5mg「オーハラ」>
(PTP)100錠(10錠×10)
<シンバスタチン錠10mg「オーハラ」>
(PTP)100錠(10錠×10)
<シンバスタチン錠20mg「オーハラ」>
(PTP)100錠(10錠×10)
23. 主要文献
- Niemi,M., Pharmacogenomics, 8, 787-802, (2007) »PubMed
- Niemi,M., Clin.Pharmacol.Ther., 87, 130-133, (2010) »PubMed
- 大多和昌克他, 臨床医薬, 5, 1123-1140, (1989)
- 社内資料:生物学的同等性試験(錠5mg)
- 社内資料:生物学的同等性試験(錠10mg)
- 社内資料:生物学的同等性試験(錠20mg)
- 第十八改正日本薬局方解説書, C2495-2501, (2021)
- 中谷矩章他, 臨床医薬, 17, 1501-1547, (2001)
- Eckernas,S.A.et al., Br.J.Clin.Pharmacol., 35, 284-289, (1993) »PubMed
- Bradford,R.H.et al., Arch.Intern.Med., 151, 43-49, (1991) »PubMed
- The European Study Group, Am.J.Cardiol., 70, 1281-1286, (1992)
- Di Veroli,C.et al., Curr.Ther.Res., 52, 1-6, (1992)
- Nagata,Y.et al., Biochem.Pharmacol., 40, 843-850, (1990) »PubMed
- Ishida,F.et al., Biochim.Biophys.Acta, 1042, 365-373, (1990) »PubMed
- Todd,P.A.et al., Drugs, 40, 583-607, (1990) »PubMed
- Kobayashi,M.et al., Jpn.J.Pharmacol., 49, 125-133, (1989) »PubMed
- Ishida,F.et al., Biochim.Biophys.Acta, 963, 35-41, (1988) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
大原薬品工業株式会社
お客様相談室
〒104-6591
東京都中央区明石町8-1聖路加タワー36階
電話:0120-419-363
FAX:03-6740-7702
製品情報問い合わせ先
大原薬品工業株式会社
お客様相談室
〒104-6591
東京都中央区明石町8-1聖路加タワー36階
電話:0120-419-363
FAX:03-6740-7702
26. 製造販売業者等
26.1 製造販売元
大原薬品工業株式会社
滋賀県甲賀市甲賀町鳥居野121-15