医薬品情報
| 総称名 | プラバスタチンNa |
|---|---|
| 一般名 | プラバスタチンナトリウム |
| 欧文一般名 | Pravastatin Sodium |
| 薬効分類名 | HMG-CoA還元酵素阻害剤 高脂血症治療剤 |
| 薬効分類番号 | 2189 |
| ATCコード | C10AA03 |
| KEGG DRUG |
D00893
プラバスタチンナトリウム
|
| KEGG DGROUP |
DG01946
脂質低下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年8月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| プラバスタチンNa錠5mg「TCK」 (後発品) | PRAVASTATIN Na Tablets 「TCK」 | 辰巳化学 | 2189010F1403 | 10.4円/錠 | 処方箋医薬品 |
| プラバスタチンNa錠10mg「TCK」 (後発品) | PRAVASTATIN Na Tablets 「TCK」 | 辰巳化学 | 2189010F2426 | 15.4円/錠 | 処方箋医薬品 |
2. 禁忌
4. 効能または効果
5. 効能または効果に関連する注意
適用の前に十分な検査を実施し、高脂血症、家族性高コレステロール血症であることを確認した上で本剤の適用を考慮すること。本剤は高コレステロール血症が主な異常である高脂血症によく反応する。
6. 用法及び用量
通常、成人にはプラバスタチンナトリウムとして、1日10mgを1回または2回に分け経口投与する。
なお、年齢・症状により適宜増減するが、重症の場合は1日20mgまで増量できる。
なお、年齢・症状により適宜増減するが、重症の場合は1日20mgまで増量できる。
7. 用法及び用量に関連する注意
メバロン酸の生合成は夜間に亢進することが報告されているので、適用にあたっては、1日1回投与の場合、夕食後投与とすることが望ましい。
8. 重要な基本的注意
8.1 あらかじめ高脂血症の基本である食事療法を行い、更に運動療法や高血圧・喫煙等の虚血性心疾患のリスクファクターの軽減等も十分考慮すること。
8.2 投与中は血中脂質値を定期的に検査し、治療に対する反応が認められない場合には投与を中止すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 甲状腺機能低下症の患者
横紋筋融解症があらわれやすいとの報告がある。
9.1.2 遺伝性の筋疾患(筋ジストロフィー等)又はその家族歴のある患者
横紋筋融解症があらわれやすいとの報告がある。
9.1.3 薬剤性の筋障害の既往歴のある患者
横紋筋融解症があらわれやすいとの報告がある。
9.1.4 アルコール中毒の患者
本剤は主に肝臓において代謝され、作用するので肝機能障害を悪化させるおそれがある。また、横紋筋融解症があらわれやすいとの報告がある。
9.1.5 重症筋無力症又はその既往歴のある患者
重症筋無力症(眼筋型、全身型)が悪化又は再発することがある。[11.1.9参照]
9.2 腎機能障害患者
9.2.1 腎機能検査値異常のある患者
本剤とフィブラート系薬剤を併用する場合には、治療上やむを得ないと判断される場合にのみ併用すること。やむを得ず併用する場合には、定期的に腎機能検査等を実施し、自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。[10.2参照]
9.2.2 腎機能障害又はその既往歴のある患者
横紋筋融解症の報告例の多くが腎機能障害を有する患者であり、また、横紋筋融解症に伴って急激な腎機能の悪化が認められている。[9.8参照]
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害又はその既往歴のある患者
本剤は主に肝臓において代謝され、作用するので肝機能障害を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。他のHMG-CoA還元酵素阻害剤において、動物実験で出生児数の減少、生存・発育に対する影響及び胎児の生存率の低下と発育抑制が報告されている。また他のHMG-CoA還元酵素阻害剤において、ラットに大量投与した場合に胎児の骨格奇形、ヒトでは妊娠3ヵ月までの間に服用した場合に胎児の先天性奇形があらわれたとの報告がある。[2.2参照]
9.6 授乳婦
投与しないこと。やむを得ず投与する場合には授乳を中止させること。ラットで乳汁中への移行が報告されている。[2.2参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
加齢による腎機能低下を考慮し、定期的に血液検査を行い、慎重に投与すること。[9.2.2参照]
10. 相互作用
10.2 併用注意
| フィブラート系薬剤 ベザフィブラート等 [9.2.1参照] | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇を認めた場合は直ちに投与を中止すること。 | 両剤とも単独投与により横紋筋融解症が報告されている。 危険因子:腎機能に関する臨床検査値に異常が認められる患者 |
| 免疫抑制剤 シクロスポリン等 ニコチン酸 | 急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇を認めた場合は直ちに投与を中止すること。 | 機序は不明である。 危険因子:重篤な腎機能障害のある患者 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれ、これに伴って急性腎障害等の重篤な腎機能障害があらわれることがある。
11.1.2 肝機能障害(頻度不明)
黄疸、著しいAST・ALTの上昇等を伴う肝機能障害があらわれることがある。
11.1.3 血小板減少(頻度不明)
紫斑、皮下出血等を伴う重篤な症例も報告されている。
11.1.4 間質性肺炎(頻度不明)
長期投与であっても、発熱、咳嗽、呼吸困難、胸部X線異常等が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.5 ミオパチー(頻度不明)
11.1.6 免疫介在性壊死性ミオパチー(頻度不明)
近位筋脱力、CK高値、炎症を伴わない筋線維の壊死、抗HMG-CoA還元酵素(HMGCR)抗体陽性等を特徴とする免疫介在性壊死性ミオパチーがあらわれ、投与中止後も持続する例が報告されている。免疫抑制剤投与により改善がみられたとの報告例がある。
11.1.7 末梢神経障害(頻度不明)
11.1.8 過敏症状(頻度不明)
ループス様症候群、血管炎等の過敏症状があらわれたとの報告がある。
11.1.9 重症筋無力症(頻度不明)
重症筋無力症(眼筋型、全身型)が発症又は悪化することがある。[9.1.5参照]
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 皮膚 | − | 発疹、そう痒、蕁麻疹 | 紅斑、脱毛、光線過敏、湿疹 |
| 消化器 | − | 胃不快感、下痢、腹痛 | 嘔気・嘔吐、便秘、口内炎、消化不良、腹部膨満感、食欲不振、舌炎 |
| 肝臓 | AST上昇、ALT上昇、γ-GTP上昇 | LDH上昇、ALP上昇 | 肝機能異常、ビリルビン上昇 |
| 腎臓 | − | − | BUN上昇、血清クレアチニン上昇 |
| 筋肉注) | CK上昇 | − | 筋脱力、筋肉痛、筋痙攣 |
| 精神神経系 | − | − | めまい、頭痛、不眠 |
| 血液 | − | − | 血小板減少、貧血、白血球減少 |
| その他 | − | 尿酸値上昇、尿潜血 | 耳鳴、関節痛、味覚異常、倦怠感、浮腫、しびれ、顔面潮紅 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 SD系ラットにプラバスタチンナトリウムを投与した実験(10・30・100mg/kg/日混餌投与 24ヵ月間)において、100mg/kg/日投与群(最大臨床用量の250倍)の雄にのみ肝腫瘍の発生が対照群と比較して有意に認められているが、雌には認められていない。
15.2.2 イヌにプラバスタチンナトリウムを投与した実験(12.5・50・200mg/kg/日 5週 経口及び12.5・25・50・100mg/kg/日 13週 経口)において、100mg/kg/日投与群で脳の微小血管に漏出性出血等が認められている。
16. 薬物動態
16.1 血中濃度
16.1.1 連続投与
健康成人男性5例にプラバスタチンナトリウム20mg、1日2回、7日間連続経口投与したとき、朝投与前の血漿中にはプラバスタチンナトリウムの未変化体及び代謝物はともに検出されなかった1)。
16.1.2 生物学的同等性試験
<プラバスタチンNa錠5mg「TCK」>
プラバスタチンNa錠5mg「TCK」とメバロチン錠5を、クロスオーバー法によりそれぞれ2錠(プラバスタチンナトリウム10mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された2)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→6hr (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
| プラバスタチンNa錠5mg「TCK」 | 26.27±7.81 | 13.33±4.11 | 0.98±0.20 | 1.43±0.63 |
| メバロチン錠5 | 27.05±8.92 | 14.04±5.20 | 1.03±0.20 | 1.34±0.57 |
<プラバスタチンNa錠10mg「TCK」>
プラバスタチンNa錠10mg「TCK」とメバロチン錠10を、クロスオーバー法によりそれぞれ1錠(プラバスタチンナトリウム10mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→6hr (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
| プラバスタチンNa錠10mg「TCK」 | 28.12±13.18 | 14.31±6.31 | 1.03±0.26 | 1.16±0.45 |
| メバロチン錠10 | 30.61±13.19 | 15.21±6.68 | 0.98±0.30 | 1.27±0.40 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
プラバスタチンナトリウムはラットにおいては主として胃、小腸上・中部から吸収された4)。
16.3 分布
16.3.1 血漿蛋白結合率
血漿蛋白結合率は53%であった5)。
16.3.2 動物における組織分布
ラット及びイヌにおいて、プラバスタチンナトリウムはコレステロール生合成の盛んな肝臓、小腸等に高濃度に分布するが、脳、生殖器臓器等他の臓器への分布は極めて低かった4)。
16.4 代謝
16.4.1 動物における代謝
ラットにおいて、プラバスタチンナトリウムは主として肝臓で酸化、異性化、抱合(主としてグルタチオン抱合)を受けて代謝された6)。
16.4.2 尿及び糞中代謝物
健康成人男性8例に[14C]プラバスタチンナトリウム19.2mgを経口単回投与した時の尿(0-48時間)及び糞(0-96時間)中で、未変化体は尿中放射能の29%、糞中放射能の47.6%を占めていた。主な代謝物は3α-iso-異性体で、尿中放射能の10%、糞中放射能の13.9%を占め、6-epi-異性体は尿中放射能の2.8%、糞中放射能の0.7%を占めていた7)(外国人データ)。
16.5 排泄
16.5.1 動物における排泄
ラット、イヌ、サルではいずれも胆汁排泄を経由した糞中排泄が主で(80%以上)、尿中排泄は2〜13%と少なかった4)。
16.5.2 連続投与
健康成人男性5例にプラバスタチンナトリウム20mg、1日2回、7日間連続投与したとき、尿中排泄パターンや回収率は投与期間中一定であった1)。
16.7 薬物相互作用
16.7.1 薬物代謝酵素
プラバスタチンナトリウムは、ヒト肝ミクロソームを用いた代謝試験において安定であり、チトクロームP450の分子種である3A4(CYP3A4)で代謝を受けなかった8)(in vitro)。
(1)CYP3A4の代謝を受ける薬剤に対する影響
プラバスタチンナトリウムは、ヒト肝ミクロソームを用いた試験において、CYP3A4の基質であると報告されているニフェジピン、メキサゾラム、テストステロンの代謝に影響を与えなかった9)(in vitro)。
(2)CYP3A4を阻害する薬剤の影響
(3)グレープフルーツジュースの影響
グレープフルーツジュースの反復飲用は、プラバスタチンナトリウムの薬物動態に有意な影響を与えなかった12)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
17.1.2 国内第III相試験
家族性高コレステロール血症患者を含む高脂血症患者284例中、効果判定症例252例に対し、プラバスタチンナトリウム10mgを1日2回(5mg×2)又は対照薬としてクリノフィブラート600mgを1日3回(200mg×3)16週間投与する二重盲検比較試験を実施したところ、有効率はプラバスタチンナトリウム投与群で76.2%(99/130例)、クリノフィブラート投与群で32.0%(39/122例)であり、有意にプラバスタチンナトリウム投与群の有効性が高かった15)。
副作用発現頻度は、プラバスタチンナトリウム投与群で2.9%(4/140例)であり、主な副作用は発疹2.1%(3/140例)であった。臨床検査値異常は7.9%(11/140例)で、主な臨床検査値異常はAST上昇、ALT上昇、尿酸上昇、尿潜血陽性が各1.4%(2/140例)であった。
副作用発現頻度は、プラバスタチンナトリウム投与群で2.9%(4/140例)であり、主な副作用は発疹2.1%(3/140例)であった。臨床検査値異常は7.9%(11/140例)で、主な臨床検査値異常はAST上昇、ALT上昇、尿酸上昇、尿潜血陽性が各1.4%(2/140例)であった。
17.1.3 国内第III相試験
家族性高コレステロール血症患者を含む高脂血症患者352例中、効果判定症例314例に対し、プラバスタチンナトリウム10mgを1日2回(5mg×2)又は対照薬としてプロブコール500mgを1日2回(250mg×2)16週間投与する二重盲検比較試験を実施したところ、有効率はプラバスタチンナトリウム投与群で90.4%(141/156例)、プロブコール投与群で73.4%(116/158例)であり、有意にプラバスタチンナトリウム投与群の有効性が高かった16)。
副作用発現頻度は、プラバスタチンナトリウム投与群で2.3%(4/171例)であった。臨床検査値異常は7.6%(13/171例)であり、主な臨床検査値異常はALT上昇2.3%(4/171例)であった。
副作用発現頻度は、プラバスタチンナトリウム投与群で2.3%(4/171例)であった。臨床検査値異常は7.6%(13/171例)であり、主な臨床検査値異常はALT上昇2.3%(4/171例)であった。
17.1.4 国内第II相試験(1日1回朝投与と夕投与との比較)
家族性高コレステロール血症患者を含む高脂血症患者77例中、効果判定症例66例に対し、プラバスタチンナトリウム10mg/日を1回朝又は夕に12週間投与する二重盲検比較試験を実施したところ、血清総コレステロール及びLDL-コレステロールは朝、夕投与ともに著明に低下し、有効率はそれぞれ84.4%(27/32例)、91.2%(31/34例)であり、両群間に有意差はなかった17)。
副作用は両群で発現しなかった。また、臨床検査値異常は朝投与群で5.1%(2/39例)、夕投与群で10.8%(4/37例)であり、主な臨床検査値異常は、朝投与群でALT上昇5.1%(2/39例)、夕投与群でLDH上昇8.1%(3/37例)であった。
副作用は両群で発現しなかった。また、臨床検査値異常は朝投与群で5.1%(2/39例)、夕投与群で10.8%(4/37例)であり、主な臨床検査値異常は、朝投与群でALT上昇5.1%(2/39例)、夕投与群でLDH上昇8.1%(3/37例)であった。
17.1.5 国内第III相試験(1日2回投与と1回夕投与との比較)
家族性高コレステロール血症患者を含む高脂血症患者208例中、効果判定症例171例に対し、プラバスタチンナトリウム10mgを1日2回(5mg×2)又は1日1回(10mg×1)12週間投与する二重盲検比較試験を実施したところ、血清総コレステロール及びLDL-コレステロールは1日2回投与、1日1回投与ともに著明に低下し、有効率はそれぞれ93.0%(80/86例)、92.9%(79/85例)であり、両群間に有意差はなかった18)。
副作用発現頻度は、1日2回投与群で2.3%(2/88例)であり、1日1回投与群では発現しなかった。臨床検査値異常は、1日2回投与群で3.4%(3/88例)、1日1回投与群で4.7%(4/85例)であり、主な臨床検査値異常は、1日2回投与群でALT上昇2.3%(2/88例)であった。
副作用発現頻度は、1日2回投与群で2.3%(2/88例)であり、1日1回投与群では発現しなかった。臨床検査値異常は、1日2回投与群で3.4%(3/88例)、1日1回投与群で4.7%(4/85例)であり、主な臨床検査値異常は、1日2回投与群でALT上昇2.3%(2/88例)であった。
17.1.6 国内第III相試験(長期投与試験)
17.2 製造販売後調査等
17.2.1 市販後調査:MEGA Study
冠動脈疾患又は脳卒中の既往のない高脂血症患者を、食事療法+プラバスタチンナトリウム10〜20mg/日併用群又は食事療法単独群に無作為に割付けた。非盲検下で平均5.3年追跡した解析対象例7,832例において、致死性/非致死性心筋梗塞、狭心症、心臓死/突然死、及び冠動脈血行再建術施行のいずれかの冠動脈疾患の発症は、プラバスタチンナトリウム併用群66例(3.3/千人・年)、食事療法単独群101例(5.0/千人・年)であり、有意差が認められた23)。
17.3 その他
17.3.1 血液凝固能への影響
高コレステロール血症患者にプラバスタチンナトリウム10mg/日を12週間投与し、その前後における血液凝固系への影響を検討した結果、血清脂質の著明な改善とともに、凝固・血小板系亢進の改善が認められた24)。
17.3.2 血清ステロイドホルモンに及ぼす影響
老年者高脂血症患者にプラバスタチンナトリウム10〜20mg/日を投与し、経時的に各種ステロイドホルモンを測定した結果、いずれも影響は認められなかった25)。
17.3.3 胆汁脂質に及ぼす影響
高脂血症患者にプラバスタチンナトリウム10〜20mg/日を12週間投与し、胆汁脂質、胆汁酸分画を測定した結果、最大コレステロール溶存能、胆石形成指数のいずれにも投与前後で影響は見られなかった26)。
17.3.4 血中糖代謝に及ぼす影響
高脂血症を伴う糖尿病患者にプラバスタチンナトリウム10〜20mg/日投与を行った結果、特に変化を認めなかった27)。
17.3.5 眼科検査に及ぼす影響
高脂血症患者にプラバスタチンナトリウム10〜20mg/日、6〜12ヵ月投与し、投与前後に細隙灯検査を含む眼科検査を行った結果、特に異常を認めなかった28)。
18. 薬効薬理
18.1 作用機序
プラバスタチンナトリウムはコレステロール生合成系の律速酵素であるHMG-CoA還元酵素を特異的かつ拮抗的に阻害し、他の生合成段階には影響を与えない。その作用はコレステロール生合成の主要臓器である肝臓、小腸に選択的であり、血清コレステロール値を速やかにかつ強力に低下させ、血清脂質を改善させる29)30)。
18.1.1 臓器選択的コレステロール生合成阻害作用
プラバスタチンナトリウムはラットにおいてコレステロール生合成の主要臓器である肝臓や小腸のコレステロール生合成を選択的に阻害し、ホルモン産生臓器を含む他の臓器での阻害は非常に弱かった29)。
18.1.2 LDL受容体活性に及ぼす影響
プラバスタチンナトリウムはWHHL-ウサギ(ヒト家族性高コレステロール血症のモデル動物)において、コレステロールの生合成を阻害し肝細胞内のコレステロール含量を低下させた。その結果、LDL受容体活性が増強し、血中から肝細胞内へのLDLの取り込みが増加し血清中のLDL-コレステロール値が低下した30)。
18.2 脂質低下作用
18.2.1 プラバスタチンナトリウムは経口投与により、イヌ、サル、ウサギの血清コレステロール値を用量依存的に低下させた29)。
18.2.2 プラバスタチンナトリウム12.5mg/kg/日をWHHL-ウサギに投与したところ、血清コレステロール値は有意に低下し、また、50mg/kg/日の投与量にてVLDLやLDLのコレステロール値を優先的に低下させることが認められた29)。
18.2.3 プラバスタチンナトリウムの主な代謝物である3α-iso-異性体のHMG-CoA還元酵素の阻害活性は弱く(プラバスタチンナトリウムの2%の阻害活性)、6-epi-異性体はプラバスタチンナトリウムの80%の阻害活性を有するが少量であるため、体内では未変化体が主要な活性体であると考えられた7)(外国人データ)。
18.3 冠状動脈病変及び黄色腫に及ぼす影響
プラバスタチンナトリウムをWHHL-ウサギに経口投与したところ、冠状動脈病変の発症頻度の低下と進展抑制が認められた。また、黄色腫の進展を抑制した31)。
19. 有効成分に関する理化学的知見
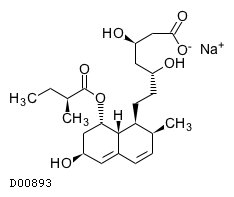
19.1. プラバスタチンナトリウム
22. 包装
<プラバスタチンNa錠5mg「TCK」>
100錠(10錠(PTP)×10)
1000錠(10錠(PTP)×100)
<プラバスタチンNa錠10mg「TCK」>
100錠(10錠(PTP)×10)
1000錠(10錠(PTP)×100)
23. 主要文献
- 笹原邦宏ほか, 臨床医薬, 4 (1), 45-65, (1988)
- 社内資料:生物学的同等性試験(錠5mg)
- 社内資料:生物学的同等性試験(錠10mg)
- Komai T,et al., Eur J Drug Metab Pharmacokinet., 17 (2), 103-113, (1992) »PubMed
- 第十八改正 日本薬局方解説書, C4794-4798, (2021), (廣川書店)
- Muramatsu S,et al., Xenobiotica, 22 (5), 487-498, (1992) »PubMed
- Everett DW,et al., Drug Metab Dispos., 19 (4), 740-748, (1991) »PubMed
- 石神未知ほか, Prog Med., 18 (5), 972-980, (1998)
- Tsujita Y,et al., Ann Rep Sankyo Res Lab., 49, 1-61, (1997)
- Neuvonen PJ,et al., Clin Pharmacol Ther., 63 (3), 332-341, (1998) »PubMed
- Azie NE,et al., Clin Pharmacol Ther., 64 (4), 369-377, (1998) »PubMed
- Fukazawa I,et al., Br J Clin Pharmacol., 57 (4), 448-455, (2004) »PubMed
- 中谷矩章ほか, 臨床医薬, 4 (2), 201-227, (1988)
- 中谷矩章ほか, 臨床医薬, 7 (4), 745-769, (1991)
- 八杉忠男ほか, 臨床評価, 16 (2), 211-249, (1988)
- 五島雄一郎ほか, 医学のあゆみ, 146 (13), 927-955, (1988)
- 中谷矩章ほか, 臨床医薬, 6 (9), 1803-1828, (1990)
- 松沢佑次ほか, 臨床評価, 19 (1), 47-92, (1991)
- 山本 章ほか, 臨床医薬, 4 (3), 409-437, (1988)
- 齋藤 康ほか, 臨床医薬, 7 (4), 771-797, (1991)
- 馬渕 宏ほか, Geriat Med., 34 (3), 339-362, (1996)
- 中谷矩章ほか, Geriat Med., 34 (3), 363-379, (1996)
- Nakamura H,et al., Lancet, 368 (9542), 1155-1163, (2006) »PubMed
- 和田英夫ほか, 臨床医薬, 4 (11), 2149-2160, (1988)
- 井藤英喜, 臨床医薬, 4 (3), 395-407, (1988)
- 梶山梧朗ほか, 臨床医薬, 4 (2), 191-200, (1988)
- 芳野 原ほか, 糖尿病, 31 (5), 385-391, (1988) »DOI
- 塩 宏, 臨床医薬, 4 (6), 1041-1050, (1988)
- Tsujita Y,et al., Biochim Biophys Acta., 877 (1), 50-60, (1986) »PubMed
- Kita T,et al., Drugs Affecting Lipid Metabolism., 251-254, (1987)
- Watanabe Y,et al., Biochim Biophys Acta., 960 (3), 294-302, (1988) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
辰巳化学株式会社
薬事・学術課
〒921-8164
金沢市久安3丁目406番地
電話:076-247-2132
FAX:076-247-5740
製品情報問い合わせ先
辰巳化学株式会社
薬事・学術課
〒921-8164
金沢市久安3丁目406番地
電話:076-247-2132
FAX:076-247-5740
26. 製造販売業者等
26.1 製造販売元
辰巳化学株式会社
金沢市久安3丁目406番地