医薬品情報
| 総称名 | イリボー |
|---|---|
| 一般名 | ラモセトロン塩酸塩 |
| 欧文一般名 | Ramosetron Hydrochloride |
| 製剤名 | ラモセトロン塩酸塩口腔内崩壊錠 |
| 薬効分類名 | 下痢型過敏性腸症候群治療剤 |
| 薬効分類番号 | 2399 |
| KEGG DRUG |
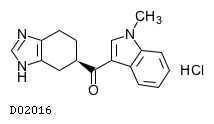
D02016
ラモセトロン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年3月 改訂(再審査結果)(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| イリボーOD錠2.5μg | Irribow OD Tablets 2.5μg | アステラス製薬 | 2399014F3029 | 37.3円/錠 | 劇薬, 処方箋医薬品 |
| イリボーOD錠5μg | Irribow OD Tablets 5μg | アステラス製薬 | 2399014F4025 | 61円/錠 | 劇薬, 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
5.1 下痢型過敏性腸症候群治療の基本である食事指導及び生活指導を行った上で、症状の改善が得られない患者に対して、本剤の適用を考慮すること。
5.2 慢性便秘症又は便秘型過敏性腸症候群の患者でないことを確認すること。
5.3 十分な問診により、下痢状態が繰り返していること及び便秘状態が発現していないことを確認のうえ投与すること。
5.4 類似症状を呈する疾患(大腸癌、炎症性腸疾患、感染性腸炎等)が疑われる場合には、必要に応じて専門的な検査を考慮すること。
6. 用法及び用量
<男性における下痢型過敏性腸症候群>
通常、成人男性にはラモセトロン塩酸塩として5μgを1日1回経口投与する。
なお、症状により適宜増減するが、1日最高投与量は10μgまでとする。
なお、症状により適宜増減するが、1日最高投与量は10μgまでとする。
<女性における下痢型過敏性腸症候群>
通常、成人女性にはラモセトロン塩酸塩として2.5μgを1日1回経口投与する。
なお、効果不十分の場合には増量することができるが、1日最高投与量は5μgまでとする。
なお、効果不十分の場合には増量することができるが、1日最高投与量は5μgまでとする。
7. 用法及び用量に関連する注意
7.1 用量調整を行う場合は1カ月程度の症状推移を確認してから実施すること。また、症状変化に応じた頻繁な用量調整を行わないようにすること。
7.2 本剤による治療により継続的な症状の改善が得られた場合、本剤の投与を漫然と継続することなく、投与開始3カ月を目処に、治療の継続、終了を検討すること。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 腹部手術歴のある患者
本剤の投与による便秘、硬便等の発現に伴うイレウス等の発現に注意すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラットにおいて乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。副作用が発現した場合には、投与を中止すること。一般に高齢者では生理機能が低下している。
10. 相互作用
相互作用序文
CYP1A2阻害作用を有する薬剤との併用により、本剤の血中濃度が上昇する可能性がある。[16.4参照]
薬物代謝酵素用語
CYP1A2
10.2 併用注意
| フルボキサミン [16.7.1参照] | 本剤の血中濃度が上昇し、副作用が増強されるおそれがある。 | フルボキサミンのCYP1A2阻害作用により本剤の血中濃度が上昇する可能性がある。 |
| 抗コリン作用を有する薬剤 抗コリン剤 三環系抗うつ剤 フェノチアジン系薬剤 モノアミン酸化酵素阻害剤 等 | 便秘、硬便等の副作用が増強されるおそれがある。 | 抗コリン作用により薬理効果が増強される可能性がある。 |
| 止しゃ剤 ロペラミド塩酸塩 等 アヘンアルカロイド系麻薬 アヘンチンキ 等 | 便秘、硬便等の副作用が増強されるおそれがある。 | 止しゃ作用により薬理効果が増強される可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
抗悪性腫瘍剤投与に伴う消化器症状(悪心、嘔吐)の治療のためにラモセトロン塩酸塩を静脈内投与された患者において、ショック、アナフィラキシーが報告されている。
11.1.2 虚血性大腸炎(頻度不明)
腹痛、血便等の虚血性大腸炎が疑われる症状があらわれた場合には、本剤の投与を中止するなど適切な処置を行うこと。[8.参照]
11.1.3 重篤な便秘(頻度不明)
本剤では便秘、硬便が認められ、類薬では海外において重篤な便秘の発現とその合併症(腸閉塞、イレウス、宿便、中毒性巨大結腸、続発性腸虚血、腸管穿孔)が報告されており死亡例も認められていることから、本剤の投与により便秘、硬便が認められた場合には患者の症状に応じて休薬、中止等の適切な処置を行うこと。[8.参照]
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 0.1〜1%未満 | 頻度不明 | |
| 血液及びリンパ系障害 | 貧血、白血球数減少、白血球数増加、血小板数減少 | |||
| 心臓障害 | 動悸 | |||
| 胃腸障害 | 便秘、硬便 | 腹部膨満 | 腹痛、上腹部痛、悪心、胃不快感、胃炎、腹部不快感、痔核、排便障害、下痢、嘔吐、逆流性食道炎、十二指腸潰瘍、下腹部痛、肛門周囲痛、痔出血 | 血便 |
| 全身障害及び投与局所様態 | 胸部不快感、倦怠感、口渇 | |||
| 肝胆道系障害 | 肝機能異常、γ-GTP上昇 | AST上昇、ALT上昇、Al-P上昇、ビリルビン上昇、LDH上昇 | ||
| 感染症及び寄生虫症 | 憩室炎 | |||
| 筋骨格系及び結合組織障害 | 背部痛 | |||
| 神経系障害 | 頭痛、傾眠 | |||
| 腎及び尿路障害 | 尿中蛋白陽性、尿中ブドウ糖陽性、血中尿素増加 | 頻尿 | ||
| 皮膚及び皮下組織障害 | 発疹、蕁麻疹 | |||
| 生殖系及び乳房障害 | 前立腺炎 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
14.1.3 本剤は寝たままの状態では、水なしで服用させないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
16.1.2 反復投与
健康成人男性6名にラモセトロン塩酸塩錠0.6mgを1日2回7日間反復経口投与したとき、体内動態の変化はなく、蓄積性は認められなかった3)。
16.1.3 食事の影響
健康成人男性20名にイリボー錠5μgを空腹下もしくは食後単回経口投与したところ、食後投与時のCmax及びAUCに影響は認められず、イリボー錠のバイオアベイラビリティは食事の影響を受けないと考えられた1)。
16.1.4 性差
健康成人男女各20名にイリボー錠5μgを単回経口投与したとき、女性のCmax及びAUCは男性のそれぞれ1.5倍及び1.7倍であった2)。
16.1.5 生物学的同等性試験
健康成人男性に2×2クロスオーバー法により、イリボーOD錠5μgを水なしにて、イリボー錠5μgを水とともに単回経口投与した場合の血漿中未変化体濃度の推移及び薬物動態パラメータを下記の図表に示した。血漿中未変化体濃度はいずれの場合も投与後約2時間にCmaxに達した後、7時間の半減期で消失した4)。
Cmax及びAUCについて統計解析を行ったところ、イリボーOD錠は水なしで服用または水とともに服用した場合のいずれにおいても、イリボー錠と生物学的に同等であることが確認された4)5)。
Cmax及びAUCについて統計解析を行ったところ、イリボーOD錠は水なしで服用または水とともに服用した場合のいずれにおいても、イリボー錠と生物学的に同等であることが確認された4)5)。
| 投与量 | Cmax(pg/mL) | Tmax(h) | AUC(pg・h/mL) | t1/2(h) |
| イリボーOD錠5μg(水なし) | 23.29±5.51 | 2.3±0.8 | 187.10±53.83 | 7.0±1.6 |
| イリボー錠5μg | 25.33±6.45 | 1.9±0.6 | 188.77±63.29 | 7.0±1.6 |
16.4 代謝
16.7 薬物相互作用
16.7.1 フルボキサミン
16.7.2 パロキセチン
健康成人男女35名にパロキセチン20mg(CYP2D6阻害薬)を10日間服用下、ラモセトロン塩酸塩錠10μgを単回経口投与したところ、Cmax及びAUCはともに影響を受けなかった8)(外国人データ)。
注)本剤の承認された1日最高投与量は男性で10μg、女性で5μgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(男性)
イリボー錠5μgを1日1回、朝食前に経口投与した無作為化二重盲検群間比較試験の結果は、主要評価項目である過敏性腸症候群症状の全般改善効果の最終時点における月間レスポンダー率に関して、イリボー錠5μg群はプラセボ群を上回り有意な差が認められた。また、臨床検査値異常を含む副作用発現症例はイリボー錠5μg群で215例中41例(19.1%)、プラセボ群で227例中30例(13.2%)であり、イリボー錠5μg群で発現率5%以上の副作用は硬便であった9)。[8.参照]
| 投与群 | 症例数 | レスポンダー率 | 両側95%信頼区間 | P値※ | プラセボとの差 | |
| 下限 | 上限 | |||||
| プラセボ | 223 | 24.2% | 18.7 | 30.4 | <0.001 | 22.7% |
| イリボー錠5μg | 211 | 46.9% | 40.0 | 53.9 | ||
| 投与群 | 症例数 | 副作用発現率 | 例数(発現率) | ||
| 便秘 | 硬便 | 腹部膨満 | |||
| プラセボ | 227 | 30例(13.2%) | 2(0.9%) | 1(0.4%) | 3(1.3%) |
| イリボー錠5μg | 215 | 41例(19.1%) | 7(3.3%) | 13(6.0%) | 5(2.3%) |
17.1.2 国内第III相試験(女性)
イリボー錠2.5μgを1日1回、朝食前に経口投与した無作為化二重盲検群間比較試験の結果は、主要評価項目である過敏性腸症候群症状の全般改善効果の最終時点における月間レスポンダー率に関して、イリボー錠2.5μg群はプラセボ群を上回り有意な差が認められた。また、臨床検査値異常を含む副作用発現症例はイリボー錠2.5μg群で292例中95例(32.5%)、プラセボ群で284例中50例(17.6%)であり、女性では男性に比べ副作用発現率が高く、イリボー錠2.5μg群で発現率10%以上の副作用は便秘及び硬便であった10)。[8.参照]
| 投与群 | 症例数 | レスポンダー率 | 両側95%信頼区間 | P値※ | プラセボとの差 | |
| 下限 | 上限 | |||||
| プラセボ | 284 | 32.0% | 26.7 | 37.8 | <0.001 | 18.6% |
| イリボー錠2.5μg | 292 | 50.7% | 44.8 | 56.6 | ||
| 投与群 | 症例数 | 副作用発現率 | 例数(発現率) | ||
| 便秘 | 硬便 | 腹部膨満 | |||
| プラセボ | 284 | 50例(17.6%) | 13(4.6%) | 16(5.6%) | 1(0.4%) |
| イリボー錠2.5μg | 292 | 95例(32.5%) | 32(11.0%) | 66(22.6%) | 3(1.0%) |
18. 薬効薬理
18.1 作用機序
5-HT3受容体を遮断することにより、排便亢進や下痢を抑制するとともに大腸痛覚の過敏を抑制する11)。
18.2 5-HT3受容体に対する親和性
受容体結合実験において、選択的なヒト5-HT3受容体親和性を示した12)(in vitro)。
18.3 5-HT3受容体拮抗作用
18.4 排便異常に対する作用
18.5 大腸機能に対する作用
18.6 腹痛に対する作用
拘束ストレスによるラット大腸痛覚閾値低下に対して、本剤は用量依存的な改善作用を示した11)。
19. 有効成分に関する理化学的知見
19.1. ラモセトロン塩酸塩
20. 取扱い上の注意
20.1 本品はアルミ袋により品質保持をはかっているので、アルミ袋開封後は湿気及び光を避けて保存すること。
20.2 製剤表面に白または赤い斑点が見られることがあるが、本剤の添加物によるものである。
20.3 製剤の特性上、擦れにより錠剤表面が一部白く見えることがある。
22. 包装
<イリボーOD錠2.5μg>
100錠(10錠×10、乾燥剤入り)
<イリボーOD錠5μg>
100錠(10錠×10、乾燥剤入り)
23. 主要文献
- 古家英寿 他, 臨床医薬, 23 (8), 765-772, (2007)
- 古家英寿 他, 臨床医薬, 23 (8), 755-763, (2007)
- 中島光好 他, 臨床と研究, 72 (11), 2912-2926, (1995)
- 社内報告書:健康成人・口腔内崩壊錠水なし
- 社内報告書:健康成人・口腔内崩壊錠水あり
- 社内報告書:ヒト肝ミクロソーム・代謝(2008年7月16日承認 CTD2.7.2.2.1.2)
- Kadokura,T.et al., Eur.J.Clin.Pharmacol., 64 (7), 691-695, (2008) »PubMed »DOI
- Kadokura,T.et al., Eur.J.Clin.Pharmacol., 64 (6), 605-609, (2008) »PubMed »DOI
- 松枝 啓 他, 臨床医薬, 24 (7), 633-654, (2008)
- 社内報告書:女性患者・第III相試験(2015年5月26日承認 CTD2.7.6.6)
- Hirata,T.et al., Neurogastroenterol.Motil., 20 (5), 557-565, (2008) »PubMed »DOI
- Hirata,T.et al., J.Pharmacol.Sci., 104, 263-273, (2007) »PubMed »DOI
- Hirata,T.et al., Inflammopharmacol., 15 (1), 5-9, (2007) »PubMed »DOI
- Hirata,T.et al., J.Pharmacol.Sci., 106 (2), 264-270, (2008) »PubMed »DOI
- Funatsu,T.et al., Eur.J.Pharmacol., 573 (1-3), 190-195, (2007) »PubMed »DOI
24. 文献請求先及び問い合わせ先
文献請求先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
製品情報問い合わせ先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
26. 製造販売業者等
26.1 製造販売
アステラス製薬株式会社
東京都中央区日本橋本町2丁目5番1号