医薬品情報
| 総称名 | サビーン |
|---|---|
| 一般名 | デクスラゾキサン |
| 欧文一般名 | Dexrazoxane |
| 製剤名 | 注射用デクスラゾキサン |
| 薬効分類名 | アントラサイクリン系抗悪性腫瘍剤の血管外漏出治療剤 |
| 薬効分類番号 | 3929 |
| ATCコード | V03AF02 |
| KEGG DRUG |
D03730
デクスラゾキサン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(再審査結果)(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| サビーン点滴静注用500mg | SAVENE for Intravenous Infusion 500mg | キッセイ薬品工業 | 3929410D1022 | 46437円/瓶 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
アントラサイクリン系抗悪性腫瘍剤の血管外漏出
6. 用法及び用量
通常、成人には、デクスラゾキサンとして、1日1回、投与1日目及び2日目は1000mg/m2(体表面積)、3日目は500mg/m2を1〜2時間かけて3日間連続で静脈内投与する。なお、血管外漏出後6時間以内に可能な限り速やかに投与を開始し、投与2日目及び3日目は投与1日目と同時刻に投与を開始する。また、用量は、投与1日目及び2日目は各2000mg、3日目は1000mgを上限とする。
中等度及び高度の腎機能障害のある患者(クレアチニンクリアランス:40mL/min未満)では投与量を通常の半量とする。
7. 用法及び用量に関連する注意
身長、体重より求めた体表面積より投与量を算出すること。
8. 重要な基本的注意
8.1 本剤は必ずアントラサイクリン系抗悪性腫瘍剤が投与された患者に対して使用されるため、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで使用すること。
8.2 投与後は血管外漏出の症状が軽快するまで、定期的に漏出部位の状態を観察すること。
8.3 本剤は投与中及び投与終了後に骨髄抑制をおこすことがあるため、定期的に血液検査を行うとともに患者の状態を十分観察し、異常が認められた場合には適切な処置を行うこと。[11.1.1参照]
8.4 本剤の投与により免疫機能が低下している患者に、生ワクチン又は弱毒生ワクチンを接種すると、ワクチン由来の感染を増強又は持続させるおそれがあるので、本剤投与中にこれらのワクチンを接種しないこと。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
血液毒性の発現に注意して観察すること。デクスラゾキサンは大部分が腎排泄されることが知られており、腎機能障害のある患者では、本剤の排泄率が低下し、全身への曝露時間が延長する可能性があることから、副作用が強くあらわれるおそれがある。[16.6.1参照]
9.3 肝機能障害患者
肝機能障害の副作用がおこることがある。
9.4 生殖能を有する者
9.4.1 生殖可能な年齢の患者
性腺に対する影響を考慮すること。[15.2.1参照]
9.4.2 妊娠する可能性がある女性患者及びパートナーが妊娠する可能性のある男性患者
本剤の妊娠に及ぼす危険性について患者に説明した上で、本剤投与中及び少なくとも投与終了後3ヵ月を経過するまでは避妊するよう指導すること。[9.5参照]
9.5 妊婦
注)ラゾキサン(本薬を含むラセミ体)の試験成績である。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
患者の状態を十分に観察しながら慎重に投与すること。本剤は、主として腎臓から排泄されるが、一般に高齢者では腎機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| フェニトイン | 痙攣の悪化を誘発するおそれがある。 | 細胞毒性を有する薬剤と併用することによりフェニトインの吸収作用を減退させるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制(白血球減少、好中球減少、血小板減少、ヘモグロビン減少)(48.1%注))
重篤な血球減少があらわれることがあり、投与後10日以上経過して発現する例が報告されている。また、骨髄抑制に起因する重篤な感染症(2.1%注))、発熱性好中球減少症(11.0%注))があらわれることがある。[8.3参照]
注)使用成績調査の結果から算出
11.2 その他の副作用
| 10%以上 | 10%未満 | 頻度不明 | |
| 消化器 | 悪心、嘔吐 | 下痢、口内炎、口内乾燥、口渇、食欲減退、腹痛、胃炎 | |
| 皮膚 | 脱毛、点状出血、そう痒 | ||
| 肝臓 | AST上昇、ALT上昇、総ビリルビン上昇 | Al-P上昇 | γ-GTP上昇 |
| 腎臓 | クレアチニン上昇 | ||
| 精神神経系 | 浮動性めまい、頭痛、感覚消失、傾眠、失神、振戦、うつ病、不眠症 | ||
| 呼吸器 | 呼吸困難、咳、肺炎 | ||
| 循環器 | 高血圧、深部静脈血栓症、ほてり、心房細動 | ||
| 注射部位 | 注射部位反応(注射部位の疼痛、紅斑、腫脹、肥厚、硬結、注射部位静脈炎、血管穿刺部位血栓、血栓性静脈炎等) | ||
| その他 | 発熱 | 感染(創傷感染、丹毒、ヘルペスウイルス感染、好中球減少性感染等)、創部痛、疲労、関節痛、浮腫、顔面浮腫、衰弱、腹水、脱水、骨盤痛、腟出血、貧血、かすみ目、体重減少、カルシウム上昇、カルシウム低下、ナトリウム低下、カリウム上昇、カリウム低下 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は用時調製すること。
14.1.2 本剤1バイアルあたり注射用水25mLを加え、20mg/mL溶液とした後、必要量を注射筒で抜き取り、速やかに500mLの乳酸リンゲル液、日局生理食塩液又は5%ブドウ糖注射液で希釈すること。
14.1.3 調製した溶液は速やかに使用し、残液は廃棄すること。
14.2 薬剤投与時の注意
14.2.1 血管外漏出部位に十分な血流を確保するため、氷嚢などで冷却している場合は投与15分以上前に血管外漏出部位から取り外すこと。
14.2.2 他の薬剤との混注はしないこと。
14.2.3 調製した溶液は、投与する直前まで室温で管理し、調製後150分以内に投与を完了すること。
14.2.4 薬剤が皮膚・粘膜に付着しないよう注意すること。また、本剤に接触した場合には、直ちに水でよく洗い流すこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.2 非臨床試験に基づく情報
15.2.1 反復投与毒性試験で精巣重量の低値(ラット)又は精巣萎縮(ラット、ウサギ)が認められたとの報告がある。[9.4.1参照]
15.2.2 遺伝毒性については、in vitro又はin vivo試験(マウスリンフォーマTK試験、ほ乳類培養細胞を用いた小核試験、マウスを用いた小核試験)成績において、陽性を示したとする報告がある。
15.2.3 がん原性試験注2)で造血系腫瘍[組織球性及びリンパ球性の悪性リンパ腫又はリンパ性白血病](雌マウス)又は子宮腺癌(雌ラット)の発現頻度の増加が認められたとの報告がある。
注1)これらの患者への投与は承認外である。
注2)ラゾキサン(本薬を含むラセミ体)の試験成績である。
16. 薬物動態
16.1 血中濃度
16.1.1 海外市販後臨床試験
アントラサイクリン系抗悪性腫瘍剤の血管外漏出患者6例を対象として、投与1日目及び2日目はデクスラゾキサン1000mg/m2を、3日目は500mg/m2を1日1回1〜2時間かけて、3日間連日静脈内投与したときの全身クリアランスは、投与1日目及び2日目でそれぞれ9.9±3.1及び11.1±4.5L/hr、定常状態分布容積は、それぞれ30.5±11.1及び35.8±19.7L(平均値±標準偏差)であった。消失半減期は、投与1〜3日目を通して2.1〜2.2時間(平均値)とほぼ同様であった。24時間血中濃度−時間曲線下面積は、投与1日目及び2日目でそれぞれ187455及び170305ng・hr/mL(平均値)であり、反復投与による蓄積は認められなかった(外国人データ)6)。
16.1.2 国内臨床試験
アントラサイクリン系抗悪性腫瘍剤の血管外漏出患者2例に対して、本剤を1日1回90分かけて、3日間連日静脈内投与したときの血漿中薬物動態パラメータは以下のとおりであった7)。
| 投与日 | 投与量(mg/m2) | Cmaxa)(ng/mL) | AUClastb)(ng・hr/mL) | CLtot(L/hr) | Vdss(L) | t1/2(hr) | |
| 患者1c) | 投与1日目 | 500 | 20122 | 82915 | 10.1 | 52.3 | 3.1 |
| 投与2日目 | 500 | 25508 | 90239 | 9.4 | 42.1 | 2.9 | |
| 投与3日目d) | 250 | 8318 | − | − | − | − | |
| 患者2 | 投与1日目 | 1000 | 47549 | 125745 | 12.0 | 42.1 | 2.1 |
| 投与2日目 | 1000 | 51166 | 127903 | 11.8 | 39.8 | 2.1 | |
| 投与3日目 | 500 | 19739 | 46115 | 13.7 | 46.0 | 1.9 |
16.4 代謝
デクスラゾキサンはin vivoで速やかに(数分以内で)加水分解され、1つの環が開環した2種類の中間代謝物になる。中間代謝物Bの濃度はデクスラゾキサン濃度の8〜29%に達し、中間代謝物Cの濃度は同3〜5%に達した。その後、これらの代謝物は再び速やかに(15分で最高濃度に到達後、半減期2.5時間と0.6時間で消失)2つの環が開環したADR-925に変換され、その後、血清中から半減期24時間で消失した(外国人データ)8)。
16.6 特定の背景を有する患者
16.6.1 腎機能低下者
腎機能の程度が異なる24例の成人男性及び成人女性を対象として150mg/m2注)のデクスラゾキサンを一定速度で15分間静脈注入したとき、デクスラゾキサンのCLtotは腎機能低下者で低下し、AUC0-∞は、腎機能正常者(CCr>80mL/min)と比べて、中等度(CCr:30〜50mL/min)及び重度(CCr<30mL/min)の腎機能低下者では2倍高値を示した(外国人データ)9)。[9.2参照]
注)本剤の承認されている用法・用量は、「通常、成人には、デクスラゾキサンとして、1日1回、投与1日目及び2日目は1000mg/m2(体表面積)、3日目は500mg/m2を1〜2時間かけて3日間連続で静脈内投与する。なお、血管外漏出後6時間以内に可能な限り速やかに投与を開始し、投与2日目及び3日目は投与1日目と同時刻に投与を開始する。また、用量は、投与1日目及び2日目は各2000mg、3日目は1000mgを上限とする。中等度及び高度の腎機能障害のある患者(クレアチニンクリアランス:40mL/min未満)では投与量を通常の半量とする。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外第II相試験
アントラサイクリン系抗悪性腫瘍剤の血管外漏出患者23例に、血管外漏出の発生後から6時間以内に本剤の投与を開始し(1000mg/m2)、初回投与開始24時間後(1000mg/m2)及び48時間後(500mg/m2)に投与を繰り返したところ、血管外漏出に対して外科的処置が必要な患者は認められなかった。また、いずれの患者においても、血管外漏出による壊死は発現せず、本剤投与後に新たな水疱の発現も認められなかった10)。副作用発現割合は、82.6%(19/23例)であった。主な副作用は、注射部位疼痛30.4%(7/23例)、注射部位静脈炎26.1%(6/23例)、悪心21.7%(5/23例)、注射部位反応17.4%(4/23例)であった。主な臨床検査値異常は、白血球数減少73.9%(17/23例)、好中球数減少63.6%(14/23例)、ヘモグロビン減少39.1%(9/23例)、AST上昇26.3%(5/19例)、血小板数減少21.7%(5/23例)であった11)。
17.1.2 海外第II/III相試験
アントラサイクリン系抗悪性腫瘍剤の血管外漏出患者57例に、血管外漏出の発生後から6時間以内に本剤の投与を開始し(1000mg/m2)、初回投与開始24時間後(1000mg/m2)及び48時間後(500mg/m2)に投与を繰り返したところ、血管外漏出に対する外科的処置が行われた患者は36例中1例(2.8%)であった。また、最終評価時において血管外漏出による壊死が確認された患者は36例中1例(2.8%)であり、外科的処置を行った患者と同一症例であった10)。副作用発現割合は、47.4%(27/57例)であった。主な副作用は、悪心17.5%(10/57例)、脱毛症8.8%(5/57例)、注射部位疼痛7.0%(4/57例)、発熱7.0%(4/57例)、嘔吐7.0%(4/57例)、処置後感染7.0%(4/57例)であった。主な臨床検査値異常は、白血球数減少71.9%(41/57例)、好中球数減少59.6%(34/57例)、ヘモグロビン減少43.9%(25/57例)、血小板数減少28.1%(16/57例)、AST上昇28.1%(16/57例)、ALT上昇28.1%(16/57例)、クレアチニン上昇14.0%(8/57例)、ビリルビン上昇10.5%(6/57例)であった11)。
17.1.3 国内臨床試験
アントラサイクリン系抗悪性腫瘍剤の血管外漏出患者2例に本剤を投与した。1例目の被験者は腎機能低下が認められたため、投与量を通常の半量とし、1及び2日目は500mg/m2、3日目は250mg/m2を投与し、2例目の被験者は1及び2日目は1000mg/m2、3日目は500mg/m2を投与したところ、血管外漏出に対する外科的処置は実施されず、血管外漏出による壊死も確認されなかった。副作用として、1例目の被験者に悪心、血中尿素増加、血中クレアチニン増加、倦怠感、発熱性好中球減少症、胸膜炎、肺炎及び貧血、2例目の被験者に注入部位反応、アスパラギン酸アミノトランスフェラーゼ増加、リンパ球数減少、血小板数減少、好中球数減少、紫斑、頭痛、白血球数減少及び血中クレアチニン増加が認められた7)。
18. 薬効薬理
18.1 作用機序
ダウノルビシン誘発皮膚潰瘍モデルにおいて、デクスラゾキサンは単回腹腔内投与により潰瘍発現を用量依存的に抑制し、1日1回3日間の反復腹腔内投与では潰瘍面積を著しく減少させた。また、ダウノルビシン及びドキソルビシン誘発皮膚潰瘍モデルにおいて、デクスラゾキサンは静脈内投与においても潰瘍抑制作用を示し、静脈内と腹腔内の投与経路の違いによる効果の差異は認められなかった。
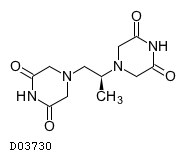
19. 有効成分に関する理化学的知見
19.1. デクスラゾキサン
22. 包装
1バイアル
23. 主要文献
- Duke DI., Teratology., 11 (1), 119-126, (1975) »PubMed
- Tebbi CK,et al., J Clin Oncol., 25 (5), 493-500, (2007) »PubMed
- Salzer WL,et al., Leukemia., 24 (2), 355-370, (2010) »PubMed
- Schwartz CL,et al., Blood., 114 (10), 2051-2059, (2009) »PubMed
- Swain SM,et al., J Clin Oncol., 15 (4), 1318-1332, (1997) »PubMed
- 社内資料:海外市販後臨床試験(TT04)
- 社内資料:国内臨床試験(KDX1101)
- Schroeder PE,et al., Cancer Chemother Pharmacol., 52 (2), 167-174, (2003) »PubMed
- Brier ME,et al., J Clin Pharmacol., 51 (5), 731-738, (2011) »PubMed
- Mouridsen HT,et al., Ann Oncol., 18 (3), 546-550, (2007) »PubMed
- 臨床的安全性(承認年月日:2014年1月17日、CTD 2.7.4)
24. 文献請求先及び問い合わせ先
文献請求先
キッセイ薬品工業株式会社
くすり相談センター
〒112-0002
東京都文京区小石川3丁目1番3号
電話:フリーダイヤル:0120-007-622
製品情報問い合わせ先
キッセイ薬品工業株式会社
くすり相談センター
〒112-0002
東京都文京区小石川3丁目1番3号
電話:フリーダイヤル:0120-007-622
26. 製造販売業者等
26.1 製造販売元
キッセイ薬品工業株式会社
松本市芳野19番48号