医薬品情報
| 総称名 | カイロック |
|---|---|
| 一般名 | シメチジン |
| 欧文一般名 | Cimetidine |
| 製剤名 | シメチジン細粒 |
| 薬効分類名 | 胃炎・消化性潰瘍治療剤 |
| 薬効分類番号 | 2325 |
| ATCコード | A02BA01 |
| KEGG DRUG |
D00295
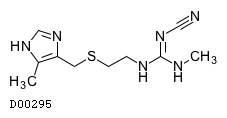
シメチジン
|
| KEGG DGROUP |
DG01481
ヒスタミンH2受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| カイロック細粒40% | CYLOCK FINE GRANULES | 藤本製薬 | 2325001C2092 | 10.2円/g |
2. 禁忌
次の患者には投与しないこと
シメチジンに対し過敏症の既往歴のある患者
4. 効能または効果
○下記疾患の胃粘膜病変(びらん、出血、発赤、浮腫)の改善
急性胃炎、慢性胃炎の急性増悪期
6. 用法及び用量
<胃潰瘍、十二指腸潰瘍>
通常、成人にはシメチジンとして1日800mgを2回(朝食後及び就寝前)に分割して経口投与する。また、1日量を4回(毎食後及び就寝前)に分割もしくは1回(就寝前)投与することもできる。なお、年齢、症状により適宜増減する。
<吻合部潰瘍、Zollinger-Ellison症候群、逆流性食道炎、上部消化管出血(消化性潰瘍、急性ストレス潰瘍、出血性胃炎による)>
通常、成人にはシメチジンとして1日800mgを2回(朝食後及び就寝前)に分割して経口投与する。また、1日量を4回(毎食後及び就寝前)に分割して投与することもできる。なお、年齢、症状により適宜増減する。
ただし、上部消化管出血の場合には、通常注射剤で治療を開始し、内服可能となった後は経口投与に切り替える。
ただし、上部消化管出血の場合には、通常注射剤で治療を開始し、内服可能となった後は経口投与に切り替える。
<下記疾患の胃粘膜病変(びらん、出血、発赤、浮腫)の改善
急性胃炎、慢性胃炎の急性増悪期>
急性胃炎、慢性胃炎の急性増悪期>
通常、成人にはシメチジンとして1日400mgを2回(朝食後及び就寝前)に分割して経口投与する。また、1日量を1回(就寝前)投与することもできる。なお、年齢、症状により適宜増減する。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
血液像、肝機能、腎機能等に注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 薬物過敏症の既往歴のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中に移行することが報告されている。[16.3.1参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量するか投与間隔を延長するなど慎重に投与すること。高齢者では腎機能が低下していることが多いため、血中濃度が持続するおそれがある。[9.2参照]
10. 相互作用
相互作用序文
本剤は、肝薬物代謝酵素P-450を阻害する。特にCYP3A4とCYP2D6に対して強い阻害効果を有することが報告されている1)(外国人データ)。
薬物代謝酵素用語
CYP
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2D6
10.2 併用注意
| 肝薬物代謝酵素P-450の活性低下により代謝、排泄が遅延する薬剤 主な薬剤: クマリン系抗凝血剤 ワルファリン ベンゾジアゼピン系薬剤 ジアゼパム トリアゾラム ミダゾラム等 抗てんかん剤 フェニトイン カルバマゼピン等 抗うつ剤 三環系抗うつ剤 イミプラミン等 パロキセチン β-遮断剤 プロプラノロール メトプロロール ラベタロール等 カルシウム拮抗剤 ニフェジピン等 抗不整脈剤 リドカイン等 キサンチン系薬剤 テオフィリン アミノフィリン等 | これらの医薬品の血中濃度を高めることが報告されているので、これらの医薬品を減量するなど慎重に投与すること。 | 本剤が肝薬物代謝酵素P-450(CYP1A2、CYP2C9、CYP2D6、CYP3A4等)を阻害して、これらの医薬品の代謝、排泄を遅延させる。 |
| プロカインアミド | これらの医薬品の血中濃度を高めることが報告されているので、これらの医薬品を減量するなど慎重に投与すること。 | 本剤が近位尿細管におけるプロカインアミドの輸送を阻害し、腎クリアランスを減少させる。 |
| エリスロマイシン | これらの医薬品の血中濃度を高めることが報告されているので、これらの医薬品を減量するなど慎重に投与すること。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(全身発赤、呼吸困難等)があらわれることがある。
11.1.2 再生不良性貧血、汎血球減少、無顆粒球症、血小板減少(いずれも頻度不明)
初期症状として全身倦怠、脱力、皮下・粘膜下出血、発熱等がみられたら、その時点で血液検査を実施し、異常が認められた場合には直ちに投与を中止すること。
11.1.3 間質性腎炎、急性腎障害(いずれも頻度不明)
初期症状として発熱、腎機能検査値異常(BUN、クレアチニン上昇等)等が認められた場合には直ちに投与を中止すること。
11.1.4 皮膚粘膜眼症候群(Stevens-Johnson症候群)、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(いずれも頻度不明)
11.1.5 肝障害(頻度不明)
黄疸、また、AST、ALTの上昇等があらわれることがあるので、定期的に肝機能検査を行うこと。
11.1.6 房室ブロック等の心ブロック(頻度不明)
11.1.7 意識障害、痙攣(いずれも頻度不明)
特に腎機能障害患者においてあらわれやすいので、注意すること。[9.2参照]
発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 腎臓 | BUN上昇、一過性のクレアチニン上昇 | ||
| 過敏症 | 発疹 | 末梢神経障害注) | |
| 内分泌 | 女性化乳房 | 乳汁分泌、帯下増加、勃起障害 | |
| 精神神経系 | めまい | 可逆性の錯乱状態、痙攣、頭痛、四肢のしびれ・こわばり感、眠気、ヒポコンドリー様症状、無気力感、うつ状態、幻覚 | |
| 循環器 | 動悸 | 頻脈、徐脈 | |
| 消化器 | 便秘 | 腹部膨満感、下痢 | |
| その他 | 発熱、全身熱感、排尿困難、筋肉痛、膵炎、脱毛 |
13. 過量投与
13.1 症状
外国において、シメチジン20gから40gを投与後に意識喪失等の重篤な中枢神経症状が発現した症例、及び40g以上のシメチジンを単回経口服用した成人での死亡症例の報告がある。日本では1回50錠(10g)、外国では100錠(20g)までの過量投与の報告があるが、特に重大な影響はみられなかった。
13.2 処置
15. その他の注意
15.1 臨床使用に基づく情報
本剤の投与が胃がんによる症状を隠蔽することがあるので、悪性でないことを確認のうえ投与すること。
15.2 非臨床試験に基づく情報
15.2.1 動物の毒性試験で弱い抗アンドロジェン作用に基づく前立腺及び精のう重量の減少が報告されている。
15.2.2 ラットに24ヵ月投与した毒性試験で良性の精巣の間細胞腫の発生が増加したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.3 分布
16.6 特定の背景を有する患者
17. 臨床成績
17.1 有効性及び安全性に関する試験
<胃潰瘍、十二指腸潰瘍、吻合部潰瘍>
| 内視鏡判定による潰瘍治癒率 | 自覚症状改善度(中等度以上改善率) | |
| 胃潰瘍 | 68.7%(180/262例) | 90.9%(259/285例) |
| 十二指腸潰瘍 | 76.0%(114/150例) | 90.5%(152/168例) |
| 吻合部潰瘍 | 71.4%(15/21例) | 95.5%(21/22例) |
| 総数 | 71.4%(309/433例) | 90.9%(432/475例) |
<上部消化管出血>
17.1.2 国内臨床試験9)
止血効果:内服可能な上部消化管出血に対して、1日800mg投与後3日以内の止血率は77.3%(99/128例)、7日以内の止血率は96.1%(123/128例)、止血効果として有効以上が97.6%(123/126例)であった。
自覚症状改善度:中等度改善以上が93.7%(104/111例)であった。
以上のように上部消化管出血に対しても良好な結果を示した。
18. 薬効薬理
18.1 作用機序
胃粘膜壁細胞のヒスタミンH2受容体を遮断し、持続的に胃酸分泌を抑制する。
18.2 胃液分泌抑制作用
18.2.1 基礎分泌
男性十二指腸潰瘍患者にシメチジン200mg経口投与した場合、投与後1〜3時間の2時間分泌量は91.2%抑制された10)。
18.2.2 テトラガストリン、ベタゾール及びインスリン刺激分泌
18.2.3 食餌刺激分泌
18.2.4 夜間分泌
男性十二指腸潰瘍患者の午後11時〜午前6時までの夜間分泌量はシメチジン200mg経口投与で71.7%、300mg経口投与で94.0%抑制され、酸分泌抑制作用の持続時間は200mgで約4時間、300mgで約6時間であった15)。
18.2.5 24時間分泌
18.3 ペプシン分泌抑制作用
18.4 長期投与に伴う酸分泌機能の変動
18.5 血中ガストリンに及ぼす影響
18.6 ガストリン細胞数の変化
十二指腸潰瘍患者において、シメチジン1,000mg/日を4週間、更に400mg/日を20週間経口投与で、投与前、投与開始後4週間、12週間及び24週間の幽門部ガストリン細胞数には有意な変化は認められなかった24)。
18.7 胃内容排出に対する影響
十二指腸潰瘍患者のシメチジン300mg経口投与後の1時間及び3時間の胃内容排出には、いずれも有意な変化は認められなかった25)(外国人データ)。
18.8 膵外分泌機能に対する影響
胃潰瘍、十二指腸潰瘍、胃・十二指腸共存潰瘍患者に対するシメチジン800mg/日19〜42日間の経口投与で投与前後の膵外分泌機能には有意な差は認められなかった26)。
18.9 胃粘膜電位差に対する作用
健康男性にシメチジン300mgを投与した場合、アスピリンによる胃粘膜電位差の低下を抑制することにより、胃粘膜関門の破綻を防ぎ粘膜障害を阻止した27)(外国人データ)。
18.10 胃粘膜PGE2生合成能に対する影響
十二指腸潰瘍患者においてシメチジン1,000mg/日4週間の経口投与で、胃粘膜のPGE2生合成量は投与前に比し増加した28)。
19. 有効成分に関する理化学的知見
19.1. シメチジン
20. 取扱い上の注意
光により、わずかに着色することがあるため、開封後は遮光して保存すること。
22. 包装
200包[0.5g分包×200]
100g[バラ]
500g[バラ]
23. 主要文献
- Knodell RG,et al., Gastroenterology, 101 (6), 1680-1691, (1991) »PubMed
- 社内資料:カイロック錠200のヒトにおける血中濃度に関する資料-単回及び1週間反復投与-
- 社内資料:カイロック細粒40%のヒトにおける血中濃度に関する資料-カイロック錠200との比較試験-
- Somogyi A,et al., Br.J.Clin.Pharmacol., 7 (6), 627-629, (1979) »PubMed
- Ma KW,et al., Gastroenterology., 74 (2), 473-477, (1978)
- Kogan FJ,et al., J.Clin.Pharmacol., 23, 252-256, (1983) »PubMed
- 社内資料:カイロック錠臨床報告集計
- 社内資料:カイロック細粒臨床報告集計
- 社内資料:カイロック錠止血効果集計
- 三好秋馬 他, 医学のあゆみ, 107 (9), 588-592, (1978)
- 三好秋馬 他, 内科宝函, 26 (6), 205-215, (1979)
- 男全正三 他, 基礎と臨床, 16 (11), 5798-5802, (1982)
- 須山哲次 他, 胃分泌研究会誌, 12, 49-52, (1980)
- 矢花 剛 他, 臨牀と研究, 61 (11), 3715-3720, (1984)
- 三好秋馬 他, 内科宝函, 26 (6), 217-224, (1979)
- Pounder RE,et al., Lancet ii, 1069-1072, (1975) »PubMed
- Shiratori K,et al., Gastroenterology, 84 (5,Part2), 1308, (1983)
- 岡 裕爾 他, 診療と新薬, 17 (6), 1367-1371, (1980)
- 湯川永洋 他, 診療と新薬, 17 (6), 1411-1419, (1980)
- 榊 信広 他, 臨牀と研究, 57 (11), 3621-3632, (1980)
- 相良勝郎 他, 診療と新薬, 17 (6), 1449-1456, (1980)
- Henn RM,et al., N.Eng.J.Med., 293 (8), 371-375, (1975) »PubMed
- Pounder RE,et al., Gut., 17 (3), 161-168, (1976) »PubMed
- Arnold R, et al., Cimetidine,edited by W.Creutzfeldt,Excerpta Medica, 87-99, (1977)
- Richardson CT,et al., Gastroenterology, 71 (1), 19-23, (1976) »PubMed
- 亀井 力 他, 診療と新薬, 17 (6), 1305-1316, (1980)
- Mackercher PA,et al., Gastroenterology, 70 (5, Part2), 912, (1976)
- Branski D,et al., Scand.J.Gastroenterol., 19 (4), 457-460, (1984) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
藤本製薬株式会社
学術部
〒580-8503
大阪府松原市西大塚1丁目3番40号
電話:0120-225-591
FAX:0120-116-026
製品情報問い合わせ先
藤本製薬株式会社
学術部
〒580-8503
大阪府松原市西大塚1丁目3番40号
電話:0120-225-591
FAX:0120-116-026
26. 製造販売業者等
26.1 製造販売元
藤本製薬株式会社
〒580-8503
大阪府松原市西大塚1丁目3番40号
藤本製薬グループ